摘要
关键词:疫苗接种,佐剂,现代技术,未来展望。
疫苗接种无疑是人类历史上最显著的健康成就之一。在短短的两个多世纪,疫苗使我们能够实现不同寻常的目标,例如彻底消灭天花,在世界大部分地区消灭小儿麻痹症,以及在一些国家大幅度降低许多传染病的死亡率和发病率。在世界上许多地方疫苗接种政策是公共卫生的基石,安全有效的疫苗受到人们极大的关注。疫苗的效力不仅取决于抗原成分,还取决于佐剂,其以一种更有效的方式刺激免疫系统。佐剂被定义为添加到疫苗中的成分,以改善对抗原的免疫反应。此外,佐剂有几个优点,如减少每剂疫苗的抗原量和疫苗接种次数,在某些情况下,它们增加抗原成分的稳定性,延长其半衰期并间接提高其免疫原性。现有许多不同类型的佐剂用于疫苗生产(表1)。
表1 根据佐剂的主要作用机制分类
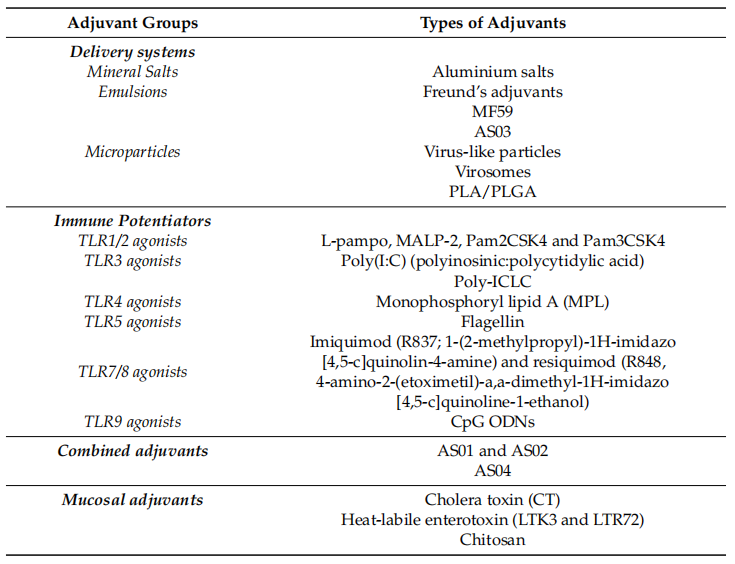
佐剂根据不同的标准进行分组,例如它们的物理化学性质、来源和作用机制。最受关注的分类系统之一是基于其作用机制,将其分为两大类:递送系统(颗粒)和免疫增强剂。另一类佐剂是粘膜佐剂,这是一组与前面的佐剂具有某些特征的化合物。在递送系统佐剂中,抗原与佐剂相结合,特别是作为抗原载体。此外,它们能够通过激活先天免疫系统诱导局部促炎反应,导致免疫细胞募集到免疫部位。确切地说,抗原-佐剂复合物通过病原体相关分子模式(PAMPs)激活模式识别受体(PRR)途径。这引起先天免疫细胞的激活,伴随有细胞因子和趋化因子的产生。同样的途径被免疫增强剂直接激活(图1)。
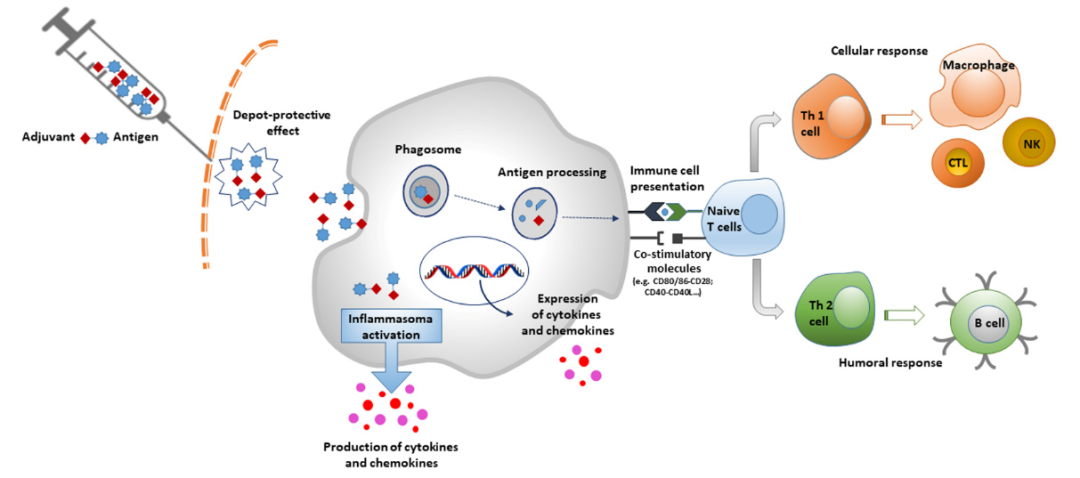
图1 佐剂的作用机制
添加佐剂对老年人使用的疫苗特别有效,因为这类受试者会出现免疫衰老的生理现象,它在自然感染或人工刺激(接种疫苗)后导致免疫反应减弱。在这种情况下,佐剂的存在可使疫苗克服这一限制。而且,佐剂对亚单位疫苗特别有用,因为亚单位疫苗通常免疫原性弱,无法单独刺激强烈的免疫反应。然而,并非所有疫苗都需要佐剂。例如获得认证的脑膜炎球菌结合疫苗不含佐剂,因为与蛋白质载体的结合本身能够刺激良好的免疫反应。表2列出了目前认证的佐剂疫苗。
表2 当前通过FDA和EMA认证的人用佐剂疫苗

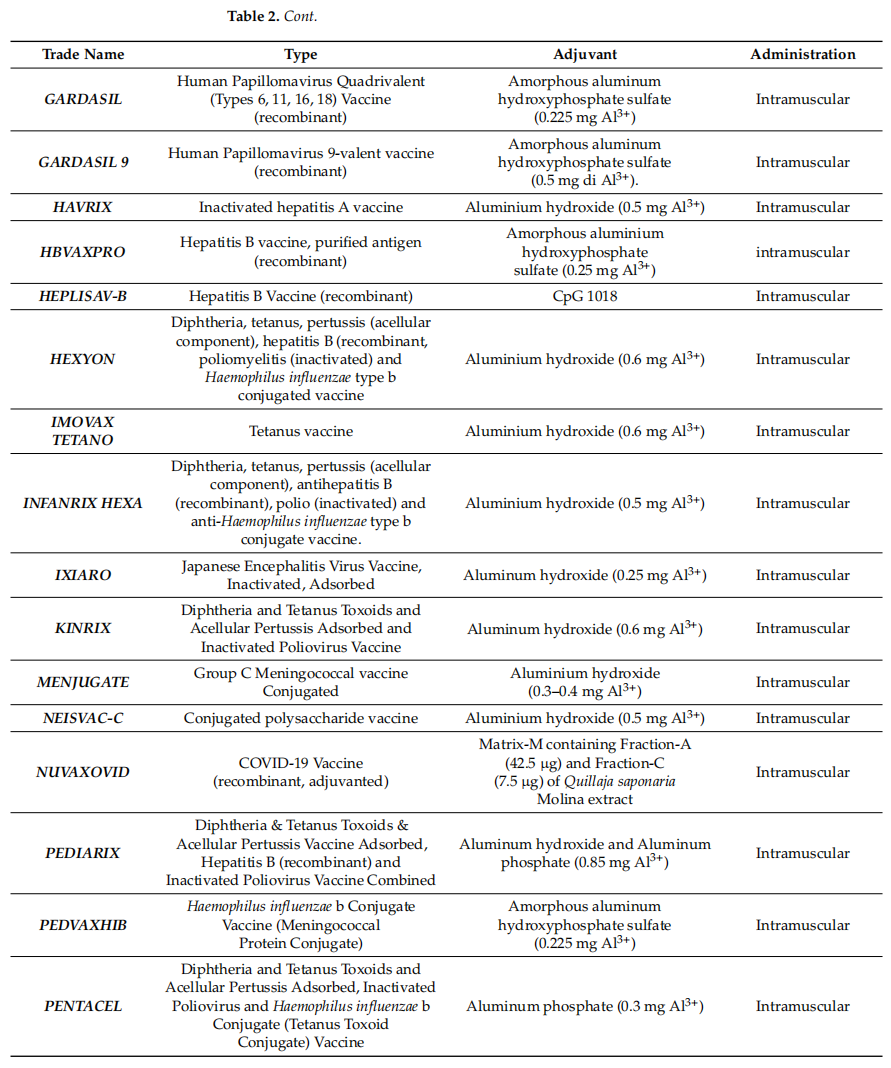
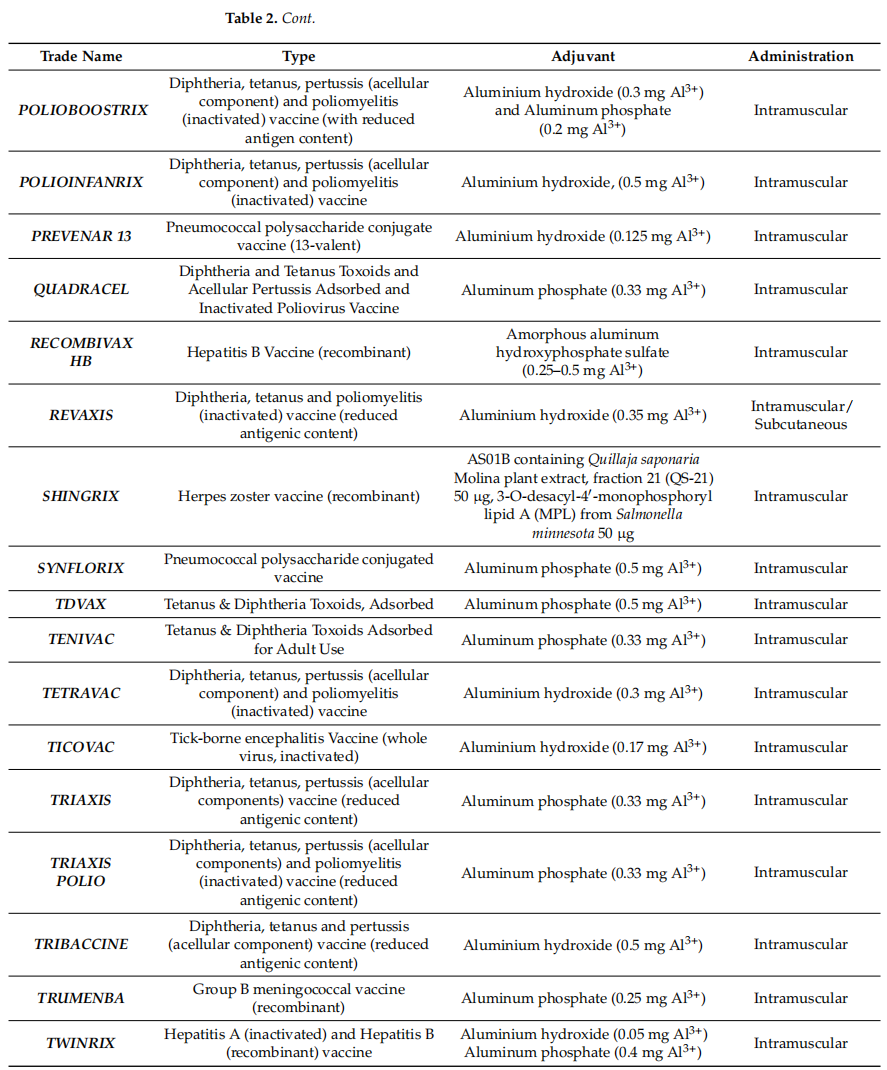
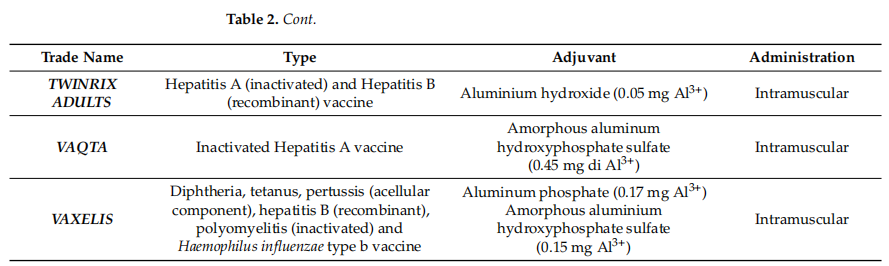
如表所示,目前绝大多数由EMA和FDA批准的人用疫苗都包括铝盐佐剂。鉴于这些佐剂是疫苗配方中使用最早的佐剂,为了提高疫苗的安全性和有效性,增加新佐剂的数量是绝对必要的,因此,有必要加强对具有佐剂特性的新分子和因子的研究,增加体外和体内研究的数量。与此同时,由于佐剂的使用和研究、新细胞底物的使用或工艺变更或转移申请方面的监管挑战,新产品的批准可能会受到延迟和提高成本。这方面可能成为抑制新奇事物、增加成本和延迟疫苗适用性的障碍,特别是在资源匮乏的国家。
此外,2019冠状病毒病大流行凸显了获得有效疫苗以应对新的大流行潜在威胁的重要性。事实上,COVID-19的RNA疫苗具有内在佐剂特性,其与编码RNA载体的脂质体成分相关。然而,最新认证的COVID-19疫苗是基于含有刺突蛋白的经典平台,并添加了一种名为Matrix-M的新佐剂,该佐剂含有皂角提取物的成分A和C。
在选择疫苗佐剂时需要考虑很多方面,其中安全性是第一位。一种好的佐剂必须是安全的,耐受性好,易于生产的;具有良好的药学特性(pH值、渗透压、内毒素水平等)以及保质期长;最后,在经济上可行。在不影响佐剂安全性的前提下兼顾所有这些特性是很困难的。因此,目前使用的疫苗中佐剂应用较少。
尽管疫苗取得了巨大的成就,但近几十年来,人们对这些产品产生了许多担忧。一种反对疫苗的文化即“疫苗犹豫”已在世界范围内蔓延。2019冠状病毒病(COVID-19)大流行刺激了“疫苗犹豫”,它一方面表明了疫苗接种作为抵抗传染病基本武器的重要性,但另一方面也凸显了一部分人的犹豫行为。许多研究已报道了造成这种态度的几个原因,但许多研究表明,最主要的原因是疫苗副作用的恐惧和疫苗组成的不信任,特别是佐剂是一种比其他成分更能引起公众关注的成分。事实上,疫苗的副作用通常是轻微和短暂的,其通常表现为注射部位的局部疼痛和红斑,轻微的全身不适和流感样症状,这些影响通常在接种疫苗几小时或几天后消失,很少有过敏反应或其他严重副作用的病例报道。
这篇综述评价了当前使用的疫苗佐剂,评估正在进行关于佐剂的特性和未来可能使用的研究,强调科学文献中存在的潜在问题和副作用的依据。
2.1 矿物盐
铝盐
20世纪20年代发现了铝盐的佐剂特性,1926年人们开始用这些化合物作为疫苗佐剂。最初考虑在培养基中添加铝盐,以便诱导破伤风和白喉抗原的沉淀,从而帮助其纯化。然而,其结果表明,铝沉淀抗原比可溶性抗原具有更强的免疫原性。因此,铝盐是使用时间最长和最常用的佐剂,目前认证的疫苗中约有三分之一含有铝。因此,铝盐是疫苗佐剂中安全性测试最多的佐剂。
人类通过不同的途径接触到铝,尤其是食物和空气。它主要通过消化道和呼吸道被人体吸收,随后进行扩散,然后经过三步排除过程,可是这一过程永远不会完成。低于3%的吸入铝和1%的摄入铝扩散到整个生物体。然而,在人体中发现95%的铝通过受污染的食物摄入的。世界卫生组织(WHO)规定通过食物摄入铝的最高水平应为1mg/kg/d(成人为60至70mg/d)。最后,铝包含在肠外溶液内,因此,通过注射扩散到血液和各种体液区室,在这种情况下,为了避免铝的积累,其在静脉注射溶液中的浓度应<25g/L。
铝一旦被生物体吸收,在人体组织中扩散。大部分金属储存在骨骼、肝脏、肺和神经系统中。对于患有慢性肾病的人来说,铝不能被清除,并随着时间的推移而积累,尤其是在骨骼和神经系统中积累。在这类病人中高水平的铝会沉积在大脑中引起脑病。在大鼠体内注射同位素铝-26 (26Al)后其精确地量化了铝对大脑的渗透。在生理条件下,铝的脑渗透被量化为每克脑组织的0.001%~0.005%,这与给药途径和化学形式无关。2010年Goullé等量化了人组织中铝水平,其应用电感耦合等离子体与质谱检测相结合的技术对20例已故患者进行分析,这些患者以前没有接触过金属,也没有接受过任何含铝或其他微量矿物质的治疗,以湿重表示的中位数结果如下:肺=0.47g/g,脑=0.19g/g,肝脏=0.15g/g,心脏=0.10g/g,肌肉=0.08g/g和肾脏=0.06g/g。
铝主要通过泌尿系统被生物体缓慢排出。有些铝会永久沉积在人体内,其含量会随着接触程度和年龄的增加而增加。在成年人体内永久沉积铝的量约为30~50mg。
在疫苗中铝以结晶氢氧化铝(AlH)复杂聚合物或无定形羟磷酸铝(AlP)的簇状纳米颗粒形式存在。AlH呈针状纳米颗粒(Ø20nm),而AlP在透射电镜下呈网状。这两种形式通常溶于柠檬酸盐,但AlP比AlH更易溶解。抗原通过静电相互作用和配体交换吸附到佐剂颗粒表面。铝盐抗原结合增强抗原提呈细胞(APCs)对抗原的摄取和提呈。而且,铝盐刺激NLRP3炎症小体的作用,导致IL-1β和IL-18的产生,引起局部炎症和APCs的募集。
许多疫苗是抗原吸附在AlH或AlP上(例如,白喉和破伤风疫苗、无细胞百日咳疫苗、乙型肝炎疫苗以及肺炎球菌和脑膜炎球菌疫苗)。因为它们的免疫原性弱,需要增强免疫反应,以便引起有效的疫苗接种。在欧洲,《欧洲药典》规定疫苗中的铝含量最高不超过1.25mg/剂。在美国,《美国联邦法规》规定生物制品(包括疫苗)中的铝含量为0.85mg/剂。铝主要以可溶性柠檬酸盐或氯化物盐的形式存在于食物中,而无机铝化合物的佐剂是难溶的,这是佐剂作用方式的一部分。因此,由于铝在生理pH值下的溶解度较差,肌肉注射或皮下注射后疫苗中铝的吸收率预计会非常慢。
为了评估肌肉注射后铝的动力学,Flarend等人进行了一些体内研究,通过肌肉注射26Al标记的AlH和AlP,其总铝剂量为0.85 mg,实验28天内AlH吸收率为17%,AlP吸收率为51%。26Al的最大血清浓度(Cmax)是2µg/L,即家兔铝的正常值(30µg/L)为7%。基于这些结果,肌内注射铝盐疫苗佐剂后铝Cmax的预期增加量为0.04µg/L,即平均血铝水平5 µg/L的0.8%。在本试验中,大脑中的铝水平浓度在10 - 8~10 - 7mg/g之间,即10−5~10−4µg/g,因此<0.0001µg/g,这比人脑中0.2µg/g的平均浓度低2000多倍。此外,一些研究评估了注射柠檬酸26Al后人体内铝的排泄情况。一项相当古老的研究表明,静脉注射26柠檬酸铝后,59%的注射剂量在一天内随尿排出,随后几天排出速度变慢(第5天平均滞留率为27%),而最近的一项研究表明,在注射铝剂8年后,残留率约为2%。
铝的毒性仅次于体液和组织中增加的金属水平。特别是当肾功能受损时,这种增加是排除它的能力而改变的。尤其血液透析的肾功能衰竭患者具有较高的铝水平,伴随可能的神经毒性风险。肾移植能够解决铝的过剩,并可能解决相关的神经毒性。多年来,科学家们一直在争论神经退行性疾病可能是铝致神经毒性,到目前为止,还没有确凿的证据表明,这一作用仍然存在争议。
铝的神经毒性已在体外、离体和体内动物模型和人体中进行了研究。在体外对细菌进行了一些研究,显示铝不存在致突变性,此外,使用对氧化诱变剂敏感的菌株后,对铝的氧化作用模式产生了疑问。在体外对细胞系进行了研究,以评估不同形式的铝可能的遗传毒性。研究人员在细胞系进行评估不同形式的铝可能引起的遗传毒性。一些科学家使用多个供体的淋巴细胞在动物模型中进行胚胎毒性研究,最后,在体内进行各种研究。在这些研究中最常用的技术是彗星试验和微核试验。有趣的是,研究结果往往不一致和相互矛盾,这可能存在方法上的缺陷。因此,到目前为止,尽管铝盐能够产生或多或少强烈的氧化应激,但仍不能肯定地说(在推荐剂量下)用作佐剂的铝盐会有毒性作用。
2.2 乳剂
这一类重要佐剂的前身是完全和不完全的弗氏佐剂。这两种佐剂都是油包水乳剂,其能够提呈抗原并刺激先天免疫系统。在其构造中完全弗氏佐剂(CFA)包括热杀死的分枝杆菌,它增强了刺激免疫反应,目前其诱导小鼠强烈的免疫激活和自身免疫(如葡萄膜炎和实验性自身免疫性脑脊髓炎)。然而,CFA能够引起强烈的和持久的局部炎症,这可能导致动物明显的疼痛,并可能在注射部位发生溃疡。不完全弗氏佐剂(IFA)不含分枝杆菌,在20世纪50年代被用作人流感疫苗的佐剂,与无佐剂的相同疫苗相比,它可以诱导更强、更持久的抗体反应。IFA的佐剂活性是基于油性抗原沉积的特征,抗原在注射部位持续释放,这同时导致抗原寿命的增加以及强烈的局部先天免疫刺激,伴随吞噬、白细胞募集和浸润以及细胞因子的产生。然而,IFA的强烈副作用,疫苗配方中应用IFA及其人类的常规使用受到阻碍。特别是,毒性是含量高的非生物降解的废油以及它们的品质差引起的。2005年WHO进行的一项调查显示,大约100万名IFA患者进行免疫接种后出现了严重的副作用,例如在4万名接种疫苗的人中出现了无菌脓肿。
2.2.1 MF59
MF59是一种油包水乳剂,其由角鲨烯、Span 85和Tween 80组成,其溶解于pH 6.5的10 mM柠檬酸钠缓冲液,平均粒径约为165 nm。这是1997年意大利批准的第一种用作人类疫苗的水包油乳剂。它目前用于三价和四价(TIV和QIV)流感疫苗Fluad (Seqirus),这些疫苗最初仅用于65岁以上的人群,但后来被批准用于其他流感风险群体如幼儿和婴儿,并在H1N1大流行疫苗期间用于孕妇和幼儿。研究表明:MF59的存在可提高2岁以下儿童流感疫苗的有效性。MF59还作为HBV疫苗的佐剂进行了测试,其能够引起强烈的免疫反应,而且比铝诱导的免疫反应更好。MF59的作用机理与铝盐相似。注射部位的储存状况几乎可以忽略不计,因为研究表明其半衰期为42h。相反,MF59具有诱导细胞和体液免疫反应的强大能力,包括产生高滴度的功能性抗体。MF59的存在刺激局部先天免疫细胞分泌趋化因子,如C-C基序趋化因子配体4 (CCL4),C-C基序趋化因子配体25 (CCL2), C-C基序趋化因子配体5 (CCL5)和C-X-C Motif配体8 (CXCL8),它反过来驱动白细胞募集、抗原摄取和迁移到淋巴结,触发适应性免疫反应。另外,研究报道,MF59能够增加调节白细胞跨内皮迁移的基因簇的表达,以及随后招募的MHCII+CD11b+细胞进入注射部位,引发强大的免疫应答。在35个国家数百万剂的应用证明了MF59是安全且耐受性良好。
2.2.2 AS03
AS03是由表面活性剂聚山梨酸酯80和角鲨烯和DL-α-生育酚两种可生物降解的油脂在磷酸盐缓冲盐水中组成的油包水佐剂乳液。这种佐剂已用于流感疫苗,引起类似MF59的免疫反应,也用于疟疾疫苗。2009年欧盟委员会批准AS03佐剂的疫苗Pandemrix上市,而2013年,美国食品和药物管理局(FDA)获批了一种AS03佐剂甲型流感(H5N1)单价疫苗。然而,α-生育酚的抗氧化和免疫刺激特性似乎比MF59增强了免疫刺激。事实上,在6至35个月的儿童中使用AS03佐剂流感疫苗显示出强烈的免疫反应,甚至在接种疫苗6个月后也是如此。为了阐明DL-α-生育酚在AS03中的作用,我们比较了AS03和缺乏DL-α-生育酚的乳剂的作用。通过测定抗原摄取、免疫细胞募集和分泌的细胞因子水平,我们得出结论是缺乏DL-α-生育酚导致免疫应答和抗体滴度降低。而且,有研究表明AS03能够通过激活NF-κB刺激免疫系统,诱导肌肉和淋巴结分泌细胞因子和趋化因子,促进先天免疫细胞的迁移。另外,AS03可刺激CD4+ T细胞特异性免疫反应,这可以决定持久的中和抗体产生和更高水平的记忆B细胞。AS03的成分进一步添加了两种强免疫刺激剂,即QS-21(一种从黄芪中提取的皂苷)和3- O -去酰基-40 -单磷酰脂质A (MPL),以增强其免疫原性,从而形成AS02。
2.3 微粒
2.3.1 病毒样颗粒
病毒样颗粒(VLP)是由自组装衣壳蛋白外壳组成的二十面体或棒状纳米颗粒(Ø 20 - 200nm)。长期以来,人们一直在研究并将其用于疫苗开发。它们是非传染性粒子,因为它们不包含任何遗传物质。它们是一种被称为纳米疫苗的最重要代表之一新型疫苗,这种疫苗在疫苗开发中正变得越来越重要。VLP是一种智能纳米颗粒,因为它们是具有重复表位的外部病毒外壳形成,免疫系统将其识别为非自身,从而产生强烈的免疫反应。然而,它与天然病毒共有的这一特性,但并不具有感染的能力。除了这些重复的结构基序外,VLPs的大小与病毒相似(通常在20-800nm之间),并且经过快速有效的处理,即使在没有佐剂的情况下也能产生快速而持久的免疫反应。根据是否存在包膜,VLPs可分为非包膜VLPs和包膜VLPs (eVLP),无包膜VLPs又可分为单衣壳蛋白VLPs和多衣壳蛋白VLPs,以及单层、双层和三层VLPs。多衣壳无包膜的VLPs一个经典例子是由乳头瘤病毒L1和L2蛋白形成的,它们能够自组装形成微粒。eVLP从宿主细胞获得脂质膜,在组装和出芽过程中表达,又分为单层、双层和多层。它们可以由不同的病毒类型形成,其表达系统包括大肠杆菌,酵母(酿酒酵母和毕赤酵母)、杆状病毒、哺乳动物细胞、植物细胞和无细胞系统。在细胞系统中生产VLP采用一种称为“组装-然后纯化”的多步骤方法,首先利用衣壳蛋白的自发组装能力直接出现在表达细胞载体内,其次纯化新形成的颗粒。有时,为了获得较纯的颗粒,在细胞内组装后,新颗粒必须分解,从而使它们第二次重新组合。另一种制造方法使用无细胞体外组装加工系统,其组成与传统细胞方法的相反,特别是,它们在表达和纯化后,体外表达系统被用于生产衣壳蛋白自发组装的平台,而无需拆卸新形成的VLPs。目前,有两种重要的添加佐剂的疫苗使用纳米颗粒平台产生免疫:乙型肝炎和乳头瘤病毒(HPV)疫苗。当前,使用的乙型肝炎疫苗是一种含有乙型肝炎表面抗原的重组疫苗(HBsAg),以VLPs的形式,用于预防乙肝感染,其利用重组DNA技术,以酿酒酵母为表达载体生产疫苗。每个剂量含有10µg/0.5 mL VLPs(儿童)或20µg/mL(成人),两者都吸附于氢氧化铝。该疫苗接种于15岁以下的婴儿、儿童和青少年,或感染乙型肝炎的高危人群,在乙肝病毒携带者母亲所生的新生儿中也显示出极好的免疫原性(95% - 99%的有效性)。乙肝疫苗似乎能提供至少10年的免疫力。
HPV疫苗也是基于VLP平台的疫苗。HPV病毒粒子是非包膜的,含有双链DNA (dsDNA)。衣壳具有二十面体对称性,由主要结构蛋白和次要结构蛋白组成,即L1蛋白和L2蛋白。目前的九价HPV疫苗可预防九种不同的病毒基因型,这些病毒基因型可导致90%的宫颈癌和80-95%的肛门生殖器癌,建议从9岁开始对男性和女性接种。九价型HPV疫苗含有9种不同HPV基因型(6、11、16、18、31、45、53、58)的L1蛋白形成VLPs,并通过重组DNA技术合成。VLPs的优势在于它是一种不含病毒基因组的蛋白质结构,不具有传染性和致癌性。目前用于表达L1蛋白的载体是酿酒酵母。VLPs与佐剂(AlP)协同使用可产生良好的免疫应答,因此预防宫颈癌达90%。此外,事实证明,疫苗诱导的抗体能够穿过胎盘,保护新生儿免受HPV 6和11的感染。
2.3.2 病毒颗粒
病毒体是一种与天然病毒结构非常相似的疫苗平台。在结构上,它们是重组流感病毒包膜形成的VLPs,由血凝素(HA)、神经氨酸酶(NA)和磷脂(磷脂酰乙醇胺和磷脂酰胆碱)组成,缺乏病毒遗传物质。1975年首次提出使用病毒颗粒生产流感疫苗。自此,出现了这类疫苗有效性的科学证据,并用于预防甲型肝炎(Epaxal)和流感(Inflexal)的两种疫苗。Inflexal Ⅴ是一种适用于所有年龄组的佐剂流感疫苗,对健康和免疫功能低下的儿童、成人和老年人都有良好的疗效。它能诱导B细胞应答并产生特异性抗体。病毒颗粒保留了血凝素的受体结合能力和膜融合活性,但缺乏病毒性RNA,它们结合后不能诱导细胞感染。而且与亚基和分裂病毒粒子流感疫苗相比,这种结合能力增加了它们的免疫原性。病毒颗粒作为一个完美的递送系统,能够将抗原转移到抗原呈递细胞(APCs)的细胞质中,并诱导细胞毒性T淋巴细胞(CTL)反应。然而,由于它们较弱的佐剂特性,病毒颗粒不能有效的激活APC和促进交叉呈递。这种内在的限制可以通过添加更强的佐剂来去除。例如基于TLR4配体单磷酰脂质A (MPLA)和金属离子螯合脂质DOGS-NTA-Ni吸附到膜上的病毒颗粒,研制了一种新型流感疫苗。在体外,与未添加佐剂的病毒颗粒相比,吸附了MPLA的病毒颗粒能够诱导更强的APCs活化。此外,具有MPLA佐剂的病毒颗粒免疫小鼠诱导特异性CTLs的产生。
生产的流感病毒颗粒使用洗涤剂(乙二醇)-正十二烷基单醚(C12E8)溶解病毒包膜,随后进行超离心并去除病毒核衣壳,然后,使用疏水珠从上清液中去除洗涤剂,随后病毒膜脂和包膜糖蛋白重新组装,形成约100-200 nm的颗粒。研究表明,这一过程形成的流感病毒颗粒表现出与野生型病毒非常相似的融合特性。流感病毒通过受体介导的内吞作用进入细胞,然后与核内体膜融合。由于膜融合活性,不同的大分子可以被包裹在病毒颗粒腔内到达靶细胞的细胞质。例如,包裹在病毒颗粒内的DTA(白喉毒素的A亚基)可以成功地转运到靶细胞的细胞质中,导致蛋白质合成的完全抑制,甚至质粒DNA也可被包裹在阳离子脂质形成的病毒颗粒内。这种病毒颗粒DNA可以有效地转染靶细胞。
病毒颗粒传递系统和佐剂的显著优势是能够通过疏水脂质相互作用将抗原吸附到它们的表面和管腔上。而且,在疫苗生产中病毒颗粒比VLPs更受欢迎,因为后者由于其蛋白质结构运动受到限制。此外,将抗原吸附到病毒颗粒的液体磷脂双分子层表面会刺激与宿主细胞受体的相互作用。FDA已批准病毒颗粒作为人类使用的纳米载体,因为它们具有很高的耐受性和安全性。与亚单位疫苗引起较弱的免疫反应相比,病毒颗粒能够诱导强大的体液和细胞免疫,这与自然感染和其他强效佐剂具有非常相似的方式。
目前为止,除了上述两种流感和甲型肝炎的基于病毒颗粒的疫苗外,这几种基于病毒颗粒的HIV、HPV、RSV和疟疾疫苗也在研究。
艾滋病毒颗粒疫苗在临床I期显示出符合期望的结果,有可能很快会上市。尽管疫苗可以通过肌肉注射或皮下注射,但粘膜途径可能引起更强的免疫反应,因为艾滋病毒传播的主要途径是粘膜组织,因此,强大的粘膜抗体产生是抵抗HIV感染的重要防御机制。研究人员已经从流感病毒中制备了基于HIV病毒颗粒的疫苗,其主要通过吸附一些HIV-1毒力抗原,如gp41和p1肽,并加入3M -052和一种增加病毒颗粒膜硬度的耐热佐剂。另一项研究,一种热稳定性的HIV-1病毒颗粒疫苗由流感包膜的病毒颗粒组成,其含有HA、NA、卵磷脂、脑磷脂和其他磷脂,外加3M-052、toll样受体(TLR7/8)和海藻糖。
关于HPV,一些研究侧重于含有E6和E7蛋白的基于病毒颗粒的疫苗,其通过受体介导的内吞作用与宿主细胞膜融合。研究表明,重组HPV16 E7流感病毒颗粒诱导了强烈的CTL反应,并阻止了HPV16+向癌症转化。此外,用E7病毒颗粒免疫诱导了抗E7的IgG抗体反应。
3.1 TLR1/2激动剂
在TLR1/2激动剂中,L-pampo是一种由Pam3Csk4(Pam3)和多肌苷:多胞苷酸(polyI:C)组成的强效佐剂体系,其分别为强效TLR1/2和TLR3激动剂。Lee等人研究表明L-pampo诱导的抗HBV抗体的产生比明矾更强,并且还参与细胞介导的免疫反应,如增加多功能CD4+ T细胞。此外,还研究了抗SARS-CoV-2的有效佐剂。具体而言,与广泛使用的佐剂相比,SARS-CoV-2抗原如受体结合域(RBD)和S1抗原,或RBD- Fc接合L-pampo可对SARS-CoV-2产生强烈的体液和细胞免疫应答。
此外,细菌脂蛋白是TLR2识别的最有效的配体。研究表明,从细菌脂蛋白中提取的合成脂肽是B细胞和巨噬细胞的强激活剂,可以用作疫苗佐剂。来自发酵支原体的2 kDa巨噬细胞激活脂肽-2 (MALP-2)通过TLR2-和myd88依赖的信号通路激活免疫细胞。除MALP-2外,Pam2CSK4和Pam3CSK4也是公认的TLR2激动剂,它们已被评估为治疗利什曼原虫、疟疾和流感等传染病的药物。
TLR3受体激动剂
在发现TLRs之前,一种合成的dsRNA,即[poly(I:C)]被发现具有高度诱导IFN产生的能力。TLR3是一种检测病毒dsRNA的细胞核内体的受体,它识别poly(I:C),因为它在结构上模拟病毒RNA,从而诱导I型IFN和III型IFN的产生,并引起Th1细胞因子反应。在TLR3- poly(I:C)相互作用后产生的I型IFN对于常规树突状细胞(cDCs)有效激活CD8 T细胞反应尤为重要。另外,poly(I:C)产生的I型IFN刺激T细胞的克隆扩增,增加效应T细胞的比例和抗原特异性B细胞的数量。由于这些原因,poly(I:C)作为一种潜在的佐剂已被广泛研究,然而,poly(I:C)对人体有毒性作用。因此,科学家们的关注点已集中在poly(I:C)的衍生物,如poly(ICLC)和poly(IC12U),以及其他合成的TLR3激动剂,如ARNAX, IPH3102和RGC100。Poly(ICLC)是羧甲基纤维素中的poly-L-赖氨酸,与poly(I:C)类似,其能够刺激IFN的产生。然而,它对血清核酸酶具有较高的抗性,同时具有较高的免疫刺激作用。poly(ICLC)的一个有趣的方面是能够诱导天然免疫途径中其他几个基因序列的表达,包括炎性体和补体系统AS,类似于活病毒疫苗。迄今为止,一些研究已经使用聚(ICLC)作为传染病的候选疫苗,如恶性疟原虫和HIV以及癌症。研究表明,与其他TLR激动剂(如LPS和CpG)相比,poly(ICLC)能够引发更强的Th1免疫应答,这是疫苗接种的一个积极方面。Poly(IC12U)通过尿嘧啶和鸟苷残基之间的错配降低Poly(I:C)的毒性。然而,尽管这种变化降低了毒性,但它导致I型IFN的产量低于poly(I:C)。与poly(I:C)和poly(ICLC)不同,poly(IC12U)与TLR3结合,但不与MDA5结合。与poly(ICLC)类似,一些研究将ploy(IC12U)作为HIV、流感和癌症疫苗的佐剂。ARNAX是一种具有佐剂潜力的TLR3激动剂,它是一种TLR3特异性配体,其毒性低于poly(I:C)。poly(I:C)的毒性与其激活MAVS通路(RIG-I和/或MDA5的激活)的能力有关。因此,Matsumoto等人开发了一种包括GpC磷酸化寡脱氧核苷酸和dsRNA的配体,该配体被TLR3识别并内化到核内体中。由于RNA链的长度相对较短,该配体能够激活TLR3,同时避免MDA5的检测。在小鼠模型中,佐剂不能诱导血清炎症细胞因子水平的显著增加,但有利于DC交叉呈递抗原并引发Th1谱。研究ARNAX最重要的两个领域是癌症免疫治疗和流感疫苗接种。
3.2 TLR4激动剂
TLR4激动剂作为疫苗佐剂有AS01、AS02和AS04,它们都含有TLR4内体的配体MPLA。
具体来说,AS01已被用于开发疟疾、艾滋病毒和结核病的疫苗。AS01是一种包裹在脂质体结构中复合佐剂,其由两种不同的免疫刺激分子MPLA和QS-21组成。QS-21是一种天然的三萜苷类皂苷类物质,提取自枇杷膏的树皮。这两种化合物利用脂质体作为载体通过胆固醇依赖性内吞作用到达细胞。在细胞内,QS-21导致溶酶体不稳定并促进蛋白激酶SYK的激活。MPLA连接内体TLR4,诱导TRIF依赖的信号通路。单独使用QS-21具有重要而不利的溶血作用,可诱导细胞死亡。然而,溶血活性的QS-21和随后的细胞死亡通过脂质体包封终止。AS01激活细胞凋亡蛋白酶-1,从而促进NLRP3炎性体的激活和从APCs中释放IL-1β和IL-18。IL-18的释放导致IFN-γ的快速产生,尤其是淋巴结中的自然杀伤细胞,从而促进DC的成熟并诱导Th1型免疫反应。
3.3 TLR5激动剂
TLR5是一种识别细菌鞭毛蛋白的受体,它由几种免疫细胞表达。TLR5与配体的结合导致炎症途径的激活和许多炎症介质的释放,如TNF-α, IL-1β, IL-6和NO。此外,鞭毛蛋白能够引起Th1和Th2反应,而不像其他TLR配体只能够引起Th1反应。另外,鞭毛蛋白通过激活NLRC4炎性体诱导IL-1β的产生和释放。鞭毛蛋白不依赖TLR5或NLRC4的模型能够发挥佐剂活性,但效率低于野生型。事实上,在小鼠模型中这两种受体都不存在时,佐剂的能力大大降低,这表明至少需要一种受体存在才能驱动免疫反应;而两者的存在提供了最好的免疫结果。研究表明,鞭毛蛋白在免疫功能低下的人群中仍能维持其佐剂作用,例如HIV阳性的病人。Cui等评论了使用鞭毛蛋白作为佐剂的研究。最简单的方法是抗原给药,该方法成功地诱导了黏膜免疫反应,对防止呼吸道和胃肠道感染至关重要。研究人员已经开展了许多研究,特别是关于鞭毛蛋白作为流感疫苗佐剂的作用。鼠伤寒沙门菌鞭毛蛋白与不同的流感抗原联合使用,如灭活的PR8流感病毒(IPR8)、HA(H5N1)和禽流感病毒(AIV)H5N1都获得了强大的免疫反应(特别是产生IgA的粘膜)。在活减毒细菌中修饰的鞭毛蛋白获得了嵌合鞭毛蛋白或鞭毛蛋白抗原复合物,例如结核分枝杆菌、霍乱弧菌、化脓性链球菌、单核细胞增生李斯特菌和产肠毒素大肠杆菌(ETEC)。此外,重组鞭毛蛋白-抗原融合蛋白的生产已在动物模型中用于传染病和癌症的佐剂疫苗。迄今为止,至少有三种用鞭毛作为佐剂的疫苗处于临床试验阶段:两种是流感病毒,另一种是鼠疫耶尔森氏菌。
3.4 TLR7/8激动剂
一些研究表明TLR7/8激动剂能够强烈诱导Th1免疫应答。与TLR7/8结合的配体产生高水平的I型IFN,IL-12, TNF-α和IL-1β。另外,TLR7/8和TLR9激动剂是唯一能够激活和促进cDCs和浆细胞样树突状细胞(pDCs)克隆扩增的激动剂分子,也能调动CD14+CD16+炎症单核细胞和CD14dimCD16+巡逻单核细胞。TLR7/8激动剂最重要的代表是一些合成的小分子,命名为咪喹莫特(R837)和瑞喹莫特(R848),其属于咪唑喹啉类。当今咪喹莫特被批准用于治疗生殖器疣、浅表基底细胞癌和光化性角化病,而雷西喹莫特已被研究用于抗病毒和抗癌治疗。然而,这些小分子已被证明有一些内在的限制。特别是,它们可以扩散到远离给药部位的地方,从而远离抗原,从而降低疗效并诱发全身副作用。因此,研究已证明这些分子与铝佐剂的直接结合能够提高疫苗的效力。先前的一些研究将咪唑喹啉类药物与HIV-1 Gag蛋白或整个灭活流感病毒直接偶联,增加了Th1应答和抗原特异性的T细胞数量。此外,它与合成聚合物支架、脂质-聚合物两亲体、聚乙二醇(PEG)、纳米凝胶、明铝和各种其他合成聚合物的偶联显著增加了咪唑喹啉类药物的递送,并促进了DC和抗原特异性T细胞的成熟。而且,咪唑喹啉与一种或多种其他TLR激动剂(如MPLA (TLR4)和MPLA + CpG ODN (TLR4和TLR9)混合研究表明,这种组合增加了先天免疫反应,产生了显著抗原特异性中和抗体和改善Th1反应。所有这些创新方面都突出了TLR7/8激动剂作为佐剂候选药物的卓越潜力。
3.5. TLR9激动剂
TLR9自然识别以未甲基化胞嘧啶-磷酸-鸟嘌呤(CpG)二核苷酸为代表的细菌DNA基序,通过myd88依赖途径驱动先天免疫系统的激活。这些分子基序用于具有特定修饰的合成佐剂,以防止被核酸酶降解。在自然杀伤细胞、B细胞和pDCs中,CpG-ODNs产生强大的趋化因子、细胞因子和抗体,驱动强烈的Th1型免疫反应。迄今为止,研究人员已开发了三种不同类型的CpG-ODN配体,其分为三类(A - C),但只有B类分子作为佐剂用于临床试验。CpG-B ODN定位于核内体并引起pDCs成熟。此外,CpG-B ODN可以直接与B细胞相互作用,增强抗体的产生。在小鼠模型中显示,CpG-B ODN作为佐剂可产生可观且持久的抗体,优于铝佐剂或非佐剂疫苗。最近许可的CpG 1018是一种具有较高的化学稳定性和佐剂能力的寡核苷酸,可引发Th1型免疫反应,被用作乙肝疫苗Heplisav-B的佐剂。Heplisav-B中的CpG 1018提高了疫苗效力,与需要三剂才能产生最佳保护的传统乙型肝炎疫苗相比,只需接种两剂即可。目前为止,CpG 1018正在用于开发几种疫苗,包括针对黑色素瘤和COVID-19的疫苗,另一种CpG ODN CpG 7909在HBV和疟疾疫苗临床评估中显示出令人鼓舞的效果,其他下一代TLR9激动剂已开发。一个有效的代表是MGN1703,其包括CG基序的小DNA分子,但它在结构上不同于CPG ODN。MGN1703是一段中间为双链的反向互补DNA组成,两个单链环包围,它包括三个非甲基化的CG基序并形成哑铃状结构,与线性分子CpG ODNs形成对比。MGN1703作为癌症疫苗的佐剂进行了测试,发现它能够激活先天和适应性免疫反应,只有轻微或暂时的副作用。
尽管疫苗具有良好的安全性,但近年来,人们对疫苗可能产生的负面影响产生了新的关注,除了众所周知的副作用外,还描述了一种新的疾病分类学实体。最早由Shoenfeld等人提出实体是佐剂诱导的自身免疫/炎症综合征(ASIA)。这种综合征包括一些免疫介导的疾病,这些疾病可能发生在暴露于佐剂后的易感遗传个体中。其特征主要是自身抗体的产生,一旦触发因子被移除,情况会好转。该综合征发病时,一些外部因素如感染性因子或佐剂(即粉尘、硅胶、铝盐等)作用于易感遗传背景,其通过自身免疫性疾病(ADI)发展相关的特定HLA抗原介导。尤其是这些患者中HLA-DRB1和PTPN22基因同时存在已证明是最常见的自身免疫背景。根据最近的科学证据,一些病理情况,如结节病、Sjögren综合征(SS)、未分化结缔组织病(UCTD)、硅胶植入物不相容综合征(SIIS)和免疫相关不良事件(irAEs)是ASIA背景的典型例子。除了疫苗中含有的常见佐剂外,许多其他物质如硅酮、石蜡、透明质酸、丙烯酰胺和甲基丙烯酸酯也具有佐剂的特性。
Watad等人将ASIA标准分为主要标准和次要标准。在临床表现之前,主要标准包括暴露于各种外源性刺激(感染、接触佐剂)以及出现典型的临床表现,如肌痛、肌炎、关节痛、关节炎、慢性疲劳、睡眠障碍、脱髓鞘、记忆丧失、发热和口干。次要标准包括自身抗体或针对佐剂的抗体的出现,特定HLA模式(即HLA DRB1, HLA DQB1)的存在,以及自身免疫性疾病的发展,即多发性硬化症或系统性硬化症。
以前的一些研究表明含有铝盐的疫苗能引起ASIA。一个典型的例子是HPV四价疫苗(含铝盐),据报道,接种疫苗后几周内易感受试者的自我免疫风险会增加,它或者是HBV疫苗。然而,Linneberg研究铝盐潜在副作用结果表明,与接受常规过敏治疗的对照组相比,经皮下多次过敏原联合氢氧化铝免疫治疗以及随后接受比三剂疫苗中含铝量高100倍人死亡率更低,自身免疫性疾病更少。
科学家们的努力已转向研究生物标志物诊断ASIA或预测它的易感性(除了之前已经提到的)。例如,在患有ASIA受试者中ACE 1和IL-2受体增加50%,维生素D的缺乏增加了ASIA的发病率(缺乏免疫调节作用)。通过对500例ASIA的分析,Watad等人强调了易感性似乎与ASIA非常相关。这项研究表明,女性个体、吸烟者、以往患有自身免疫性疾病或家庭成员患有后者的人患ASIA的比例较高。其中多基因自身免疫性疾病最为常见,UCTD和Sjögren综合征患病率最高,分别为38.8%和16.8%。在54.4%自身抗体检测阳性的患者中48.2%为ANA阳性。很明显,考虑到自身免疫/自身炎症状态的发展背后,其有环境和遗传因素。接种疫苗与出现症状之间的中位时间为一周(2天至5年);48.2%的人群在接触至少一种疫苗后出现临床症状。然而,除了这一科学证据外,一些研究表明接种佐剂疫苗与ASIA之间没有关系。在这些研究中,已表明疫苗接种和自身免疫之间的联系可能是虚假的,因为存在混淆因素和随机事件的结果,而不是真正的因果关系。疫苗接种或接触外来物质与自身免疫/炎症和免疫介导事件的潜在发生之间可能存在的联系不应成为降低疫苗接种覆盖率的“虚假神话”。实际上,疫苗不良事件很少发生。由于缺乏信息和可靠的数据,亚洲是一个恰当的总括性术语,可以把各种事件和显然不相关的反应集合在一起,这些反应的共同根源是暴露于疫苗、硅胶或其他外来物质。需要强调的是,即使未来的研究表明佐剂和自身免疫之间存在真正的相关性,然而,这不会削弱疫苗免疫实践所发挥的巨大和毋庸置疑的保护作用,疫苗免疫实践提供了许多临床益处;事实上,疫苗有助于根除和控制许多传染病,提高人类生活质量。
疫苗接种一直是人类与传染病作斗争的最有力武器之一。由于这些有效和安全的预防手段,人类已能消灭人类历史上最可怕的敌人(病原微生物)。最近的COVID-19大流行充分强调了疫苗接种的重要性,疫苗研究必须取得进一步进展并为未来的大流行做准备。疫苗的效力取决于佐剂的基本特性和作用。关于疫苗接种的未来,必须更加重视这些分子,以便生产出越来越安全有效的疫苗。目前该领域的相关产品等研究正在进行,以便实现这一目标,造福人类。






