在过去十年中,单克隆抗体 (mAb) 作为治疗各种疾病的高效、灵活的工具获得了巨大的治疗应用。尽管取得了这一成功,但仍有机会通过优化成本效益措施,降低基于抗体的疗法的生产成本。为了降低生产成本,在过去几年中实施了基于最先进的补料分批和灌流的新型工艺强化方法。在工艺强化的基础上,我们在这里介绍一种新颖、创新的混合工艺的可行性和好处,该工艺结合了补料分批操作的稳健性和通过流化床离心机 (FBC) 实现的完整培养基置换的好处。在最初的小规模 FBC 模拟筛选中,我们研究了多个工艺参数,导致细胞增殖提高和活性趋势延长。随后,最高产的工艺方案被转移到 5 L规模,进一步优化并与标准补料分批工艺进行比较。我们的数据表明,在使用与标准补料分批操作相同的反应器尺寸和工艺持续时间的同时,新型混合工艺可显著提高峰值细胞密度 (163%) 并将 mAb 量显著增加约 254%。此外,我们的数据显示了工艺之间具有可比的关键质量属性 (CQA),并揭示了规模放大的可能性,并且无需进行广泛的额外工艺监控。因此,这种新的工艺强化策略具有转移到未来工业生产环境中的巨大潜力。
简介
重组表达的生物治疗药物,如单克隆抗体 (mAb)、激素、细胞因子和疫苗,近年来在制药行业受到极大关注。特别是,自 1986 年首次获得临床批准(Orthoclone OKT3®)以来,基于 mAb 的新型疗法已成为临床应用和生物生产的主要兴趣点。从那时起,无数的临床试验凸显了这些生物治疗药物的独特优势,例如灵活调整应用、低毒性、高特异性和合适的体内半衰期。因此,截至今天,超过 100 种基于 mAb 的治疗药物已获得美国食品和药物管理局 (FDA) 的批准,还有更多药物正在临床开发中,证明人们对这些生物药物的兴趣仍在增加。
治疗性抗体的特点是复杂的翻译后修饰,以确保蛋白质的生物活性和低毒性。因此,哺乳动物细胞系,如中国仓鼠卵巢 (CHO) 细胞,被用于表达这些复杂的生物分子,而不是微生物宿主。与小分子疗法相比,基于抗体的免疫疗法生产成本相当高,导致其价格非常昂贵。为了降低成本,新颖的创新强化策略是必要的。
补料分批 (FB) 等不连续工艺形式因其稳健性、简单性和可重复性而成为大规模生产 mAb 的最先进技术。该工艺过程可分为三个连续的培养阶段:细胞呈指数增长的对数期、细胞无生长的稳定期和通常由于凋亡细胞数量增加而导致细胞活性下降的死亡期。在防止营养限制的 FB 工艺中,这些不同阶段之间的过渡通常由抑制分子(如生长抑制剂、副产物和裂解细胞碎片)的积累触发,最终限制了该类工艺的整体生产力和时间跨度。自 1990 年以来,不连续形式的产品滴度从 0.1 g/L 提高到 5 g/L,主要是通过优化细胞系、培养基系统、过程控制以及从批次模式切换到 FB 模式。此外,已经开发了不同的策略来提高细胞的生产力,例如添加特定分子来提高生产力、增加渗透压,以及在稳定期改变温度或 pH 值,从而使细胞活性和生产力能够持续很长一段时间。然而,不连续操作的关键限制是细胞源性抑制分子的积累以及培养基中的营养限制,这限制了该工艺的单位体积生产率。
为了绕过不连续工艺形式的不利特征,已经在不间断的培养基置换的基础上寻求替代工艺策略。这些灌流细胞培养系统通过置换培养基使细胞进一步增殖,从而去除抑制性分子并提供新鲜营养素。为了不断去除无细胞培养基部分,开发了细胞截留装置,最常见的系统基于交替式切向流 (ATF) 或切向流过滤 (TFF)。通过使用废弃(bleeding)系统来调节活细胞浓度,可以达到伪稳态,以防止营养限制和细胞源性分子的浓度,从而允许连续培养。因此,与不连续工艺相比,灌流细胞培养能够提高单位体积生产率和设施利用率。然而,这些连续培养需要大量的培养基 - 每天多达几个反应器体积 - 用于细胞截留的大型膜装置,以及复杂的过程监测。这种增加的培养基消耗是灌流工艺中的主要成本驱动因素之一。
所有这些混合工艺都利用过滤系统来连续置换反应器中的废培养基。但是,过滤系统显示出明显的缺点,例如置换速度慢,这会导致新供应培养基的反向混合以及膜堵塞和污染。该领域的一项新兴技术是流化床离心机 (FBC),它可以从上清液中快速无菌分离细胞,并在温和的工艺条件下进行洗涤和浓缩。 FBC 的功能原理依赖于抵消离心力和流动力而产生的细胞捕获,而低分子量颗粒,如废培养基和 mAb,可以流过。该系统最初是作为细胞澄清设备开发的,显示出 mAb 和细胞的高回收率。然而,细胞和培养基的非侵入性 FBC 分离也被假定在上游工艺过程中适用,以允许完整的培养基置换中间工艺。 10 多年前就提出了将洗涤后的细胞返回细胞培养系统的一般概念,而其中一个概念包括两个并行运行的生物反应器,其中细胞培养液通过 FBC 系统处理,转移到第二个生物反应器中,已在 Jacob Arthur Tijsterman(2015 年)的研究中进行了描述。但是,这些工艺概念的概念验证数据仍然缺失。
在这项工作中,我们提出了一种新的工艺方案,其中仅使用一个生物反应器并应用培养基置换来强化常见的补料分批操作。这种新的强化工艺概念基于 FBC 提供的有益培养基置换,旨在实现更高的单位体积生产率,同时避免过度使用培养基和对广泛过程控制的需求。这种新工艺基于中间收获 (Intermediate Harvest) 步骤,在第一个培养阶段之后,收获产品,同时用新鲜培养基清洗细胞,然后返回同一个生产反应器进行第二个生产阶段(图 1)。新的强化工艺在小规模筛选系统中进行了测试,以研究对培养的影响,并连续放大和进一步优化。总的来说,应该使用规模缩小选项开发一个在生产率和培养基消耗方面具有有益特征的强化工艺。
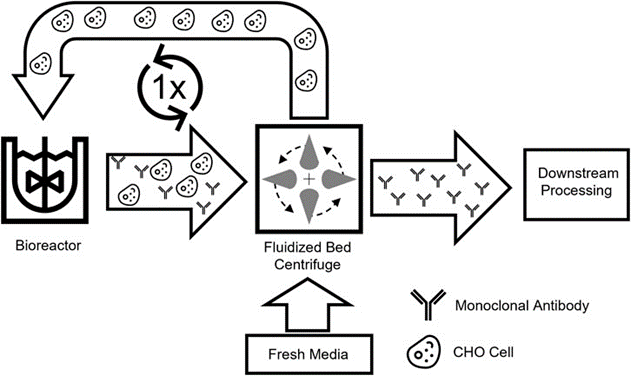
图 1. 中间收获过程的示意图。含有分泌物的细胞培养液从生物反应器中收集,并通过一次性流化床离心机分离。之后,清洗后的细胞可以重新引入生产生物反应器并用于新工艺。
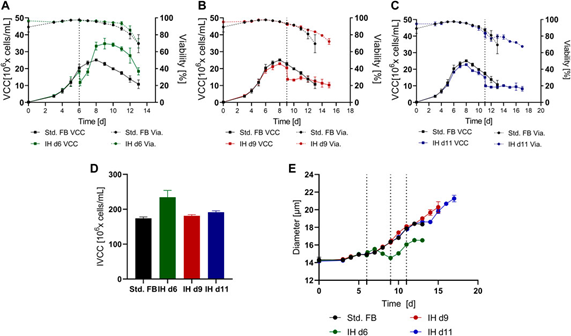

图 2. 在不同时间点进行和不进行完全培养基置换的标准补料分批 (std. FB) 培养随时间推移的培养结果。 (A)、(B) 和 (C) 为在第 6 天(IH d6;n = 3)、第 9 天(IH d9;n = 3), 和第 11 天 (IH d11; n = 2) 进行培养基置换时的活细胞密度(VCC)和活性(Via.)的变化,分别与标准FB (n = 3) 培养相比。培养基置换的各个时间点用虚线表示。 (D) 在整个培养期内所有培养的 IVCC 值。 (E) 每个培养随时间变化的细胞直径。
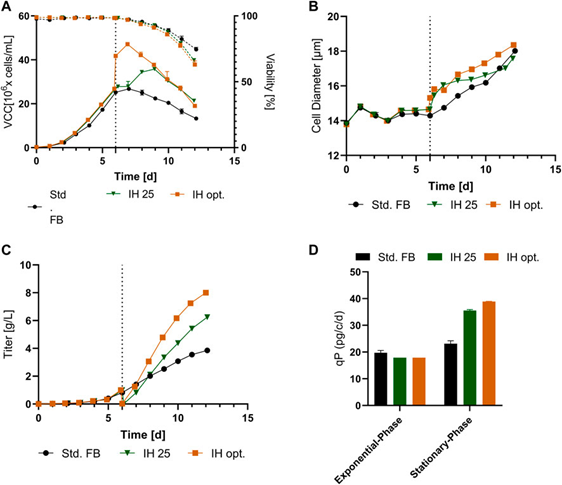
图 3. 在中间收获 (IH) 和最终收获 (EH) 的各个时间点进行的小规模筛选的上清液分析。 (A) 在小规模筛选中每种方法的 mAb 累积量。 (B) IH 之前的第一个培养阶段和 IH 和 EH (EH) 之间的第二阶段的平均细胞特异性生产力。在 EH 之前的整个工艺持续时间内计算控制 FB 的生产率。 (C) 在 IH 和 EH 的时间点,每种方法的 HCP 含量与表达的 mAb 的比率。
图 4. IH 操作后从 5 L 反应器转移到 250 mL 缩小模型的培养结果。 (A) 标准 FB、以 25 × 10^6 cells/mL (IH 25) 重新接种的IH方法以及优化的IH工艺(IH opt.)随时间变化的 VCC(实线)和活性(虚线)曲线。 (B) 所有方法随时间的细胞直径变化。 (C) 培养过程中的 mAb 滴度 (g/L)。 (D) 以 pg/c/d 为单位的细胞特异性生产力 (qP),用于每个进行的实验的指数和稳定阶段。

图 5. 标准 FB (n = 2) 和优化 IH 在 UniVessel 培养中的细胞和表达参数(IH opt.;n = 1)。 (A) 两种方法的 VCC(实线)和活性(虚线)。 (B) 培养过程中的直径。 (C) 两个实验随时间的体积。 (D) 标准FB和优化IH随时间的滴度 (g/L)。 (E) 每种方法中 IH 和 EH(最终收获)产生的 mAb 总量。 (F) 两个实验中针对指数阶段(最多第六天)和稳定阶段(从第六天到结束)的 qP (pg/c/d) 。
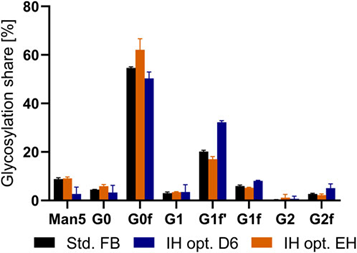
图 6. 标准补料分批 (FB) 工艺和优化的中间收获(IH opt.)在第六天以及最终收获 (EH) 中表达的 mAb 的糖基化百分比分布。
总结
在这项研究中,开发了一种介于灌流细胞培养和经典 FB 培养之间的新型混合工艺。因此,研究了在普通 FB 培养过程中与 FBC 系统 (IH) 进行完整且快速的培养基置换的影响。我们的结果显示,根据 IH 的时间点,对培养有两种不同的影响。在指数生长期,可以实现细胞的显著延长增殖,从而导致更高的峰值细胞密度。相比之下,静止期的 IH 会导致细胞增殖持续停滞,延长高细胞活性,并随后延长工艺持续时间。考虑到最终产品滴度没有显著差异,并且在后期时间点进行IH操作时的杂质/产品比率增加,因此选择指数增长阶段的 IH 进行放大。可行性以及小规模的可比性可以在放大的系统中得到证明。此外,通过增加罐的利用率并随后在 IH 操作后浓缩细胞,可以在后续步骤中进一步优化该工艺。结果显示,与标准相比,启用FBC 的新工艺允许每次运行的总产品产量增加 +154% mAb。总的来说,这项工作展示了一种创新的新方法,无需灌流细胞培养系统的复杂集成即可强化常用的 FB 操作。此外,由于 IH 工艺的简单性,可以将此应用与各种其它强化方法(例如高密度接种 FB)相结合。此外,由于 FBC 系统已经存在放大版本,已建立的过程应该可以完全放大到 2000 L 规模。然而,仍然需要进行生产规模(例如,2000 L)的概念验证,这将是未来研究的重点。总的来说,提出的工作开辟了几种新的可能性,来修改当前的 FB 工艺,以显著提高产品产量和生产率。
原文:L.N.Reger, M.Saballus, J.Matuszczyk, et al., Boosting Productivity for Advanced Biomanufacturing by Re-Using Viable Cells. Front. Bioeng. Biotechnol.,2023.






