质粒作为生物药物
近年来基因和细胞治疗行业的快速增长极大地增加了对质粒 DNA 的需求。质粒用于将编码治疗性蛋白质、RNA 或抗原的遗传信息或基因直接递送至患者的靶细胞(图 1A和表 1)。此外,质粒还用作载体来递送基因编辑系统的分子组件(例如,编辑酶、RNA向导),包括成簇规则间隔的短回文重复DNA序列(CRISPR)、锌指核酸酶(ZFN)和转录激活剂样效应核酸酶 (TALEN)。在此类体内用途中,适当的质粒与其它成分(例如佐剂、脂质等)组合以产生递送给患者的医药产品。在这些应用中,质粒是生物疗法,必须在现行良好生产规范 (cGMP) 下生产,并进行适当的监管、检测和控制。
质粒作为起始材料
除了作为生物制品的作用外,质粒在工程细胞产品(图 1Bi 和表 1)或其它生物制品(图 1Bii 和表 1)的生产中还作为复杂的起始材料发挥着支持作用。例如,在嵌合抗原受体 T 细胞 (CAR-T) 疗法、基因组编辑方法或间充质干细胞疗法的背景下,质粒被用作病毒载体的替代品,对从患者或捐献者体内提取的细胞进行基因修饰。第一个情况需要用质粒系统(例如编码CAR基因、转座酶等)转染患者的T细胞,目的是实现CAR的稳定基因转移、整合和表达。在第二种情况下,质粒用于递送 CRISPR、TALEN 或 ZFN 等基因编辑器的分子组件。无论哪种情况,质粒修饰的细胞都会被输回患者体内。最后,质粒还用于修饰间充质干细胞,例如增强其体内治疗功能。
病毒载体和 mRNA 的生产也需要质粒,它们可以单独用作生物制品(图 1Bii),也可以用作患者细胞离体修饰的试剂(图 1C 和表 1)。例如,许多腺相关病毒(AAV)和慢病毒(LV)载体是通过使用多个质粒瞬时转染生产细胞(例如人胚肾(HEK)293T细胞)来产生的。举个例子,AAV 颗粒的生产依赖于使用三种不同的质粒:一种 AAV 转移质粒,其两侧带有两个反向末端重复序列 (ITR) 的目的基因;一种含有 AAV 基因的质粒;以及一种编码腺病毒辅助基因的辅助质粒。同样,通过细胞瞬时转染来生产 LV 也需要使用三个或四个不同的质粒。然后可以将所得病毒载体施用于患者或用于离体转导细胞。
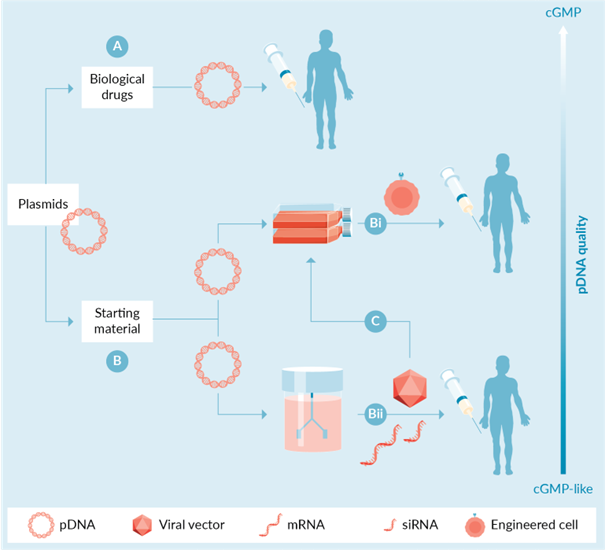
图1 质粒DNA在基因和细胞治疗中的直接和间接应用。质粒可用作 (A) 生物药物,例如作为 DNA 疫苗或作为体内非病毒基因治疗/编辑平台的组成部分,或作为 (B) 起始材料,如 (Bi) 细胞离体基因工程的起始材料(CAR-T 细胞、CRISPR 编辑的细胞等)或用于 (Bii) 病毒载体、mRNA 以及最终 RNA 生物制品的生产。后者可以单独用作生物制品 (Bii),或 (C) 作为患者细胞离体修饰的起始材料。
图2 制备质粒作为生产工程细胞产品和病毒载体的起始材料。以浅红色突出显示的生产活动应遵循 cGMP 原则,而以深红色突出显示的生产活动应遵守完整的 cGMP。
新冠病毒危机引发的mRNA疫苗的出现,也为质粒创造了新的用途和激增的需求。在 mRNA 技术背景下,质粒被广泛用于生产 mRNA 的体外转录 (IVT) 反应所需的模板。此类模板通常是通过纯化质粒的酶线性化或使用 PCR 扩增该质粒中的目的区域来产生的。IVT 产生的 mRNA 产品随后被进一步处理和纯化,直到可以转移给患者的阶段,例如在 mRNA 疫苗接种或基因组编辑的背景下(图 1Bii 和表 1)。此外,mRNA 产品可用于离体修饰或编辑细胞(图 1C 和表 1)。
人们还可以预见,质粒和 IVT 策略可能会在小 RNA 分子的生产中发挥更重要的作用,例如反义寡核苷酸、RNA 向导或 siRNA 产品中使用的双链 RNA。目前,固相化学合成可以生成长度长达 50-100 nt 的 RNA,由于其成本效益、自动化方案和非常短的合成周期,是大多数寡核苷酸药物合成的首选方法。尽管如此,IVT 广泛用于合成 RNA 分子以进行结构研究和基础 RNA 生物学(例如剪接、核糖开关、CRISPR、lncRNA)研究,在这种情况下,其可能成为一个有吸引力的替代方案。如果这一切实现,质粒很可能在小 RNA 生产中发挥关键作用,就像它们在 mRNA 疫苗、治疗药物和试剂中一样。
质粒级别
间接使用质粒 DNA 作为病毒载体或 mRNA 疫苗生产的起始材料需要生产大量材料。例如,需要超过1 kg的质粒 DNA 才能提供 10 亿剂 mRNA 疫苗。由于质粒不会出现在直接给予患者的最终药品中,而是用作其它起始物料、生物药物或细胞产品的 cGMP 生产的起始材料,因此不严格要求 cGMP 等级。然而,尽管并非所有 GMP 方面或 GMP 证书都是必需的,但在生产过程中仍应遵守 GMP 原则,因为起始原料最终可能会在药品成品中残留,并可能影响其质量、安全性和功效。最终,开发商需要进行适当的风险分析,以确定适合在 cGMP 下进一步生产药品的质粒 DNA 的质量标准。需要适当考虑的相关方面包括质量管理体系、文件、原材料、细胞库、生产、规格、检测、控制和储存等。因此,人们可以选择生产一种 cGMP-like/高质量的质粒 DNA,虽然不符合所有 cGMP 要求,但仍然符合许多监管建议。图2 强调了依赖于质粒起始材料的工程细胞产品和病毒载体的生产阶段,其中应采用 cGMP 和 cGMP 原则。
大规模质粒生产
尽管已经相当成熟,但大规模生产质粒 DNA 并非易事,生产商不断地被迫寻找在不影响质量的情况下提高生产率的方法。这种提高生产性能的压力部分源于这样一个事实:可用产能不足以及时响应与不断增长的质粒应用的开发相关的需求增长。
目前,质粒DNA的大规模生产仅依赖于一种平台宿主 - 大肠杆菌。这种偏好的合理性在于大肠杆菌能够在一系列条件下快速生长和分裂并提供高质粒 DNA 产量。此外,还有许多工具可支持大肠杆菌的分子和微生物工程,包括创建质粒载体和改良菌株。大肠杆菌的改良菌株可以生长到每升数百克的密度,每升培养物可产生高达 1-2 g 的质粒 DNA。人们还致力于开发改良的大肠杆菌菌株,这些菌株可以避免不稳定问题,例如处理含有 ITR 的质粒(例如在 AAV 转移质粒生产过程中使用的质粒)时所面临的不稳定问题。
提高生产过程中产生的质粒数量、简化监管审批并改善质粒生物学功能的一种方法是专注于 DNA 主链的工程设计。人们一直致力于生成更小、不含抗生素抗性基因、提高产量并提供高转基因表达的质粒和质粒系统(例如,微环、纳米质粒、微载体)。
从发酵结束时回收的大肠杆菌生物质中分离和纯化质粒是一项工程挑战,但大部分已得到解决,特别是在较小规模的情况下。质粒下游工艺中使用的一系列单元操作几乎不可避免地包括碱裂解、切向流过滤和层析步骤。使用不同的操作组合来处理具有残留量宿主杂质(基因组 DNA、RNA、蛋白质、脂多糖等)的质粒 DNA,且符合监管要求。
尚未得到满意解决的关键问题包括碱裂解的重现性差、层析中缺乏载量和亚型选择性以及工艺过程中由于剪切导致的超螺旋亚型损失。当处理非常大的质粒时,使用 0.22 µm 过滤器进行最终的除菌过滤也可能很麻烦。
一旦生产出来,应严格表征从每批获得的大量纯化质粒。用作起始材料的质粒的放行规格基本上将重点关注与生产作为生物药物的质粒时所涵盖的属性相同的属性。这意味着必须制定同一性(例如序列、同质性)、效力(例如浓度、同质性)和纯度(例如宿主杂质、生物负荷、残留卡那霉素)的测定以及相应的验收标准。
总结
大规模生产质粒的需求在过去几年中激增,不仅是因为质粒生物药物(例如用于 DNA 疫苗接种、体内基因治疗和基因编辑的药物)的发展,而且主要是因为它们在目前许多基因和细胞治疗产品的生产中的支持作用,包括病毒载体、病毒载体疫苗、mRNA疫苗、微环/微载体/纳米质粒和工程细胞。
除了目前的用途之外,可以预见的是,质粒可能会在 IVT 生产小 RNA 分子(例如反义寡核苷酸、RNA 向导、siRNA 产品)中发挥重要作用。虽然一开始人们可能会质疑 IVT 是否能够与成熟的寡核苷酸化学合成相竞争,但朝这一方向发展的一个驱动因素可能来自一个意想不到的领域:农业。具体来说,基于通过 RNAi 在植物病原体和其它害虫中诱导基因沉默的新型农药工具的开发正在推动开发具有成本效益的方法来大量生产大量 dsRNA。鉴于化学合成很可能不适合实现 siRNA 所需的大规模和低成本生产,IVT 正在成为这种情况下的替代方案。
展望质粒生产方面,可以预见一些发展将促进或完全改变当今质粒的生产方式。例如,虽然目前大肠杆菌作为质粒生产宿主的表现看起来是无与伦比的,但人们可能会想,对质粒的高需求是否能证明寻找一种具有更适合生产特征的细菌宿主是合理的。革兰氏阳性菌作为质粒生产宿主是有利的,因为它们缺乏脂多糖,脂多糖是从大肠杆菌中分离质粒时最麻烦的杂质之一。正如重组蛋白生产中出现了大肠杆菌以外的生产宿主一样,可能还有其它宿主等待被发现并发展成质粒生产者。
质粒主链的工程也可能对该领域产生影响。此外,人们应该关注激进的创新,例如使用最小的合成结构,例如“狗骨”和哑铃形 DNA 载体,它们是通过酶法生产的。然而,尽管这些代表了该领域的重要进步,但质粒在未来被淘汰的可能性很小。此外,小环、微载体和其它最小化载体的生产仍然依赖于质粒。
一次性技术、过程分析技术、自动化、数字化和连续生产是可能改变未来质粒生产方式的行业趋势。例如,在后一种情况下,设计稳健且能够持续递送完整质粒的连续细胞裂解过程是另一个需要寻求的进步。
总之,质粒目前在许多基因和细胞治疗产品的开发和生产中发挥的核心作用,充分证明了为提高其有效性和生产而大幅增加研发努力和投资的合理性。
原文:D.Prazeres, The supporting role of plasmids in gene & cell therapy. Cell & Gene Therapy Insights 2023; 9(5), 755–762.






