近年来,腺相关病毒 (AAV) 作为基因和细胞治疗载体的使用显著增加。因此,概念验证和临床试验期间所需的 AAV 载体数量也有所增加。AAV 血清型 6 (AAV6) 因其在转导不同细胞类型方面的效率而得到充分证明,并已成功用于基因和细胞治疗方案。然而,据估计,将转基因有效递送至单个细胞所需的载体数量为 10^6 VG (病毒基因组)。总体而言,这意味着需要大规模生产 AAV6。基于悬浮细胞的平台目前仅限于低细胞密度生产,阻碍了该生产工艺提高产量的潜力。在这里,我们研究了在更高细胞密度下,提高 AAV6 产量的方案。通过瞬时转染 HEK293SF 细胞进行生产。当以细胞为基础提供质粒 DNA 时,可以在中等细胞密度下进行生产,而不会影响细胞特异性滴度或颗粒功能,从而使滴度高于 10^10 VG/mL。就 VG/cell而言,在高细胞密度生产中,培养基添加减轻了细胞密度效应。另一方面,细胞特异性功能滴度没有得到维持,需要进一步研究以了解观察到的局限性。此处报告的中等细胞密度生产方法为大规模工艺操作奠定了基础,有可能解决当前 AAV 生产中的载体短缺问题。
腺相关病毒 (AAV) 是一种小的、25 nm宽、二十面体、无囊膜的病毒,具有 4.7 kb长的单链 DNA 基因组,属于细小病毒科。AAV 是非致病性和复制缺陷型,这取决于与辅助病毒(如腺病毒或单纯疱疹病毒)的共同感染。AAV 于 1960 年代首次从腺病毒库中发现,最近已成为治疗疾病的关键基因递送载体。Glybera 是欧洲药品管理局于 2012 年批准的第一个基于 AAV 的基因治疗药物。美国食品和药物管理局 (FDA) 于 2017 年批准了基于 AAV 的基因治疗药物 Luxturna,并于 2019 年批准了 Zolgesma。
迄今为止,基于系统发育分析,已鉴定出 13 种不同的血清型和 100 多种 AAV 变体。由于衣壳蛋白的异质性,每种血清型都表现出不同的趋向性以及转导不同细胞类型的能力。血清型 6 具有广泛的靶细胞,已显示可成功转导中枢神经系统、人前列腺癌、乳腺癌和肝癌细胞、黑素细胞、骨骼肌、心脏、肺和眼部的细胞。最近,AAV6 因其转导淋巴细胞的能力及其用于生成嵌合抗原受体 T 细胞的用途而受到欢迎。
行业正在研究的治疗性 AAV 应用的数量正在稳步增加,有超过 300 项已完成或正在进行的临床试验。这些应用需要大量 AAV 载体来验证临床前动物研究和临床试验。报告的靶向给药剂量最高可达 7.5 x 10^15 VG,全身给药最高可达 1.5 x 10^17 VG。这种对病毒载体数量的巨大需求意味着有必要改进当前的生产方法。对于 AAV 血清型 6 尤其如此,它在 T 细胞转导期间需要高达 10^6 VG/cell。重组 AAV 是通过用目的基因 (GOI) 替换病毒基因 Rep 和 Cap 而产生的。哺乳动物细胞瞬时转染一个 GOI 盒,GOI 盒两侧是反向末端重复序列,一个携带 Rep 和 Cap 功能的质粒,以及编码辅助功能的第三个质粒。瞬时转染通常使用具有成本效益的阳离子聚合物 - 聚乙烯亚胺 (PEI) 完成。然而,对于超过 10^15 VG 的 AAV 生产规模,贴壁细胞培养被认为是不可行的,这使得它们不适合这些病毒载体的后期临床试验和商业应用。2006 年有研究首次描述了使用悬浮 HEK293 细胞生产 AAV 载体的方案。尽管在优化生产方面做出了许多努力,但 AAV 载体的大规模生产被认为是其作为基因治疗和细胞治疗的病毒载体而实施的瓶颈,主要是因为目前基于 HEK293 的生产是在低细胞密度条件下完成的。将病毒载体的生产限制在低细胞密度条件下,阻碍了这种生产工艺得到强化的潜力。另一方面,在较高细胞密度下生产病毒载体往往会受到广泛报道的细胞密度效应 (CDE) 的限制,这会导致转染和生产力下降。在本研究中,我们证明了通过瞬时转染生产 AAV 血清型 6 且不局限于低细胞密度培养的方案。
详细试验操作和结果,请参考原文。
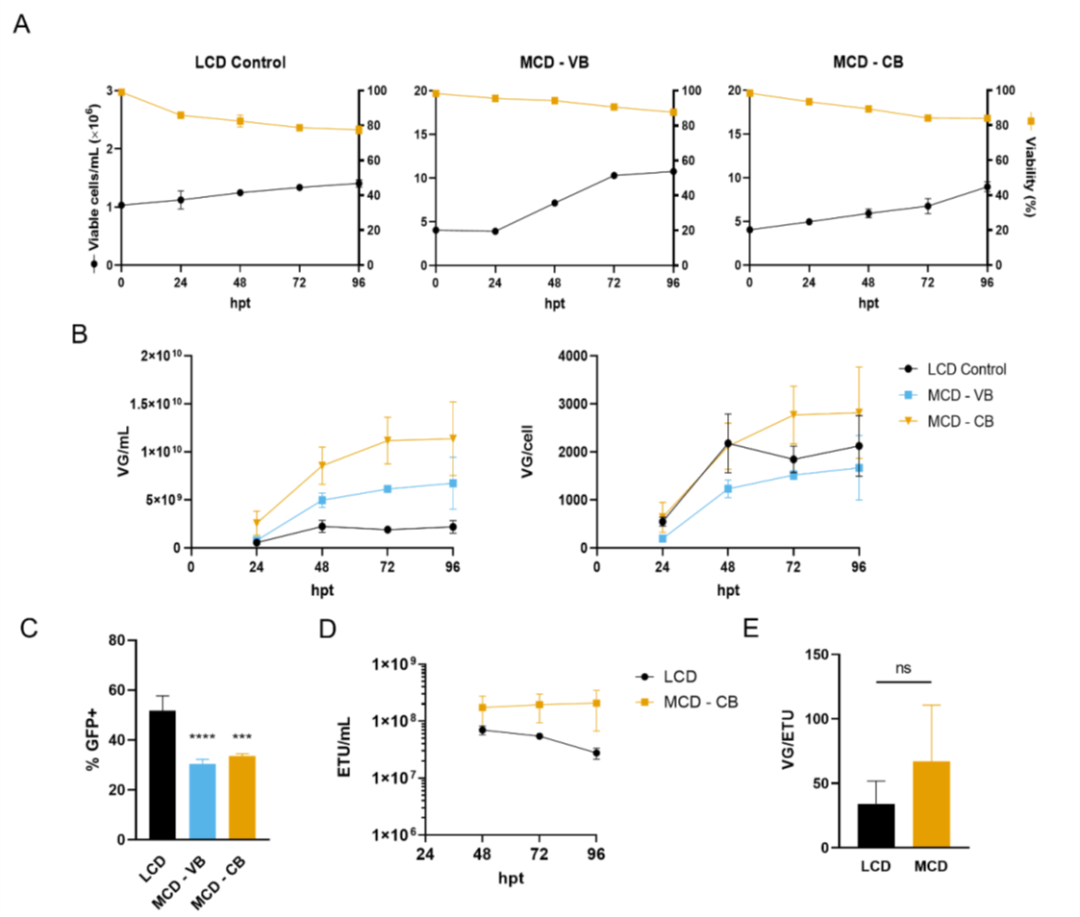
图2. 在中等细胞密度条件下,通过三质粒转染,生产AAV6。
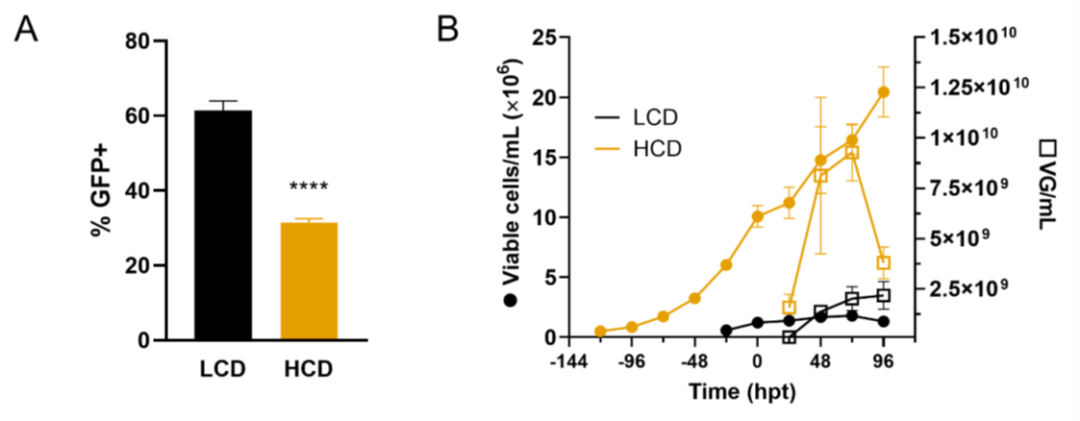
图3. 在高细胞密度条件下,通过三质粒转染,生产AAV6。
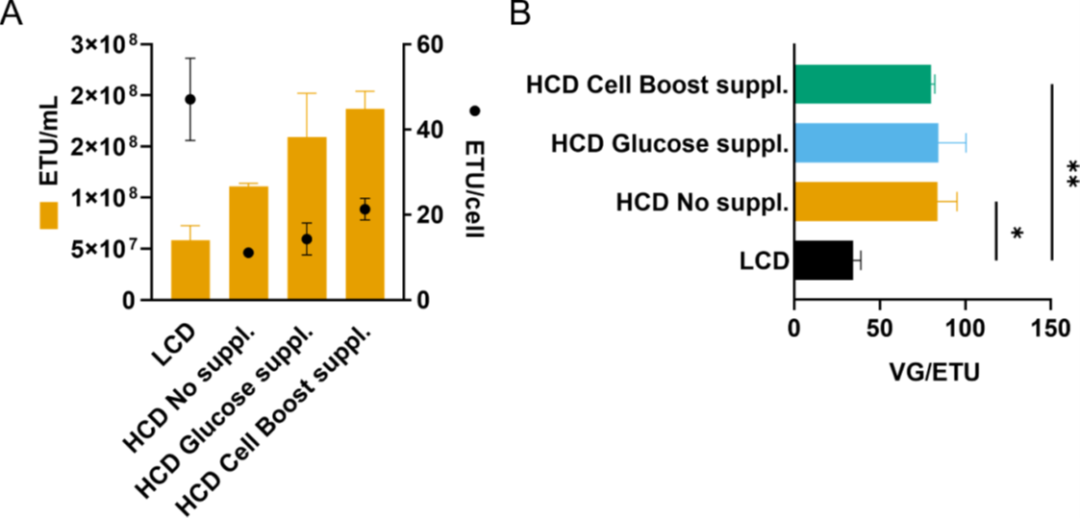
图6. 在不同细胞密度条件下,AAV6的生产。
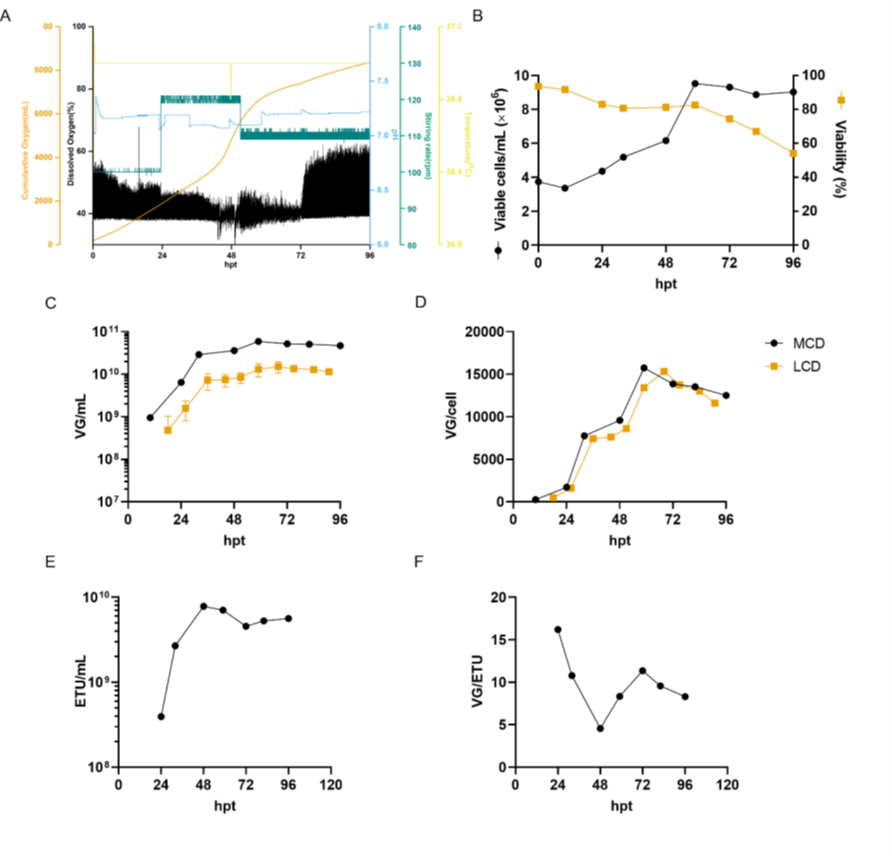
图7. 在中等细胞密度下,AAV6的生物反应器生产。
讨论
在图 1 中,我们观察到当转染时的细胞密度从 1 增加到 2 x 106 cell/mL时,质粒 DNA 可用性在维持 VG 滴度方面起着重要作用。在低细胞密度瞬时转染中,质粒 DNA 通常以体积为基础进行递送。与我们的研究一样。Grieger、Soltys 和 Samulski 也观察到当细胞密度和质粒浓度加倍时,生产过程中的滴度增加。对于 4 x 106 cells/mL(中等细胞密度,MCD)的生产,还观察到需要更高的质粒 DNA 浓度。转染时细胞数量增加 4 倍导致病毒滴度 (VG/mL) 几乎呈线性增加(图 2B)。此外,在 MCD 生产过程中保持了细胞特异性生产率,质粒 DNA 浓度保持在每个细胞的基础上(图 2B)。获得了 1,500 至 3,000 VG/cell的产率,与 Chahal、Schulze、Tran、Montes 和 Kamen 报道的产率相似。还观察到功能性颗粒 (ETU) 滴度的提高。以细胞为基础递送质粒 DNA 的 MCD 生产的功能性滴度保持不变(图 2D),与 96 hpt 的 LCD 对照相比,差异高达 3.9 倍。在 LCD 上,转导单元略有减少,但含有基因组的颗粒没有减少,这可以用病毒载体功能的丧失来解释。AAV 载体是热稳定性的,但当维持在 37°C 且 pH 值降低时,它们的转导效率会降低。由于氨和乳酸等代谢物的积累,将培养延长至 96 hpt 可降低细胞内和细胞外 pH 值。
VG/ETU 比率衡量病毒功能,显示能够转导靶细胞的含有基因组的病毒的比例。在 48 hpt 时,MCD 生产的平均 VG/ETU 比率为 67.1(图 2E)。尽管该值高于文献中报道的值,但与我们的 LCD 对照组没有统计学上的显著差异。如图 7 所示,中等细胞密度的 AAV6 生产在 3 L 生物反应器中成功进行。将细胞以 4 x 10^6 cells/mL 的所需细胞密度接种到含有新鲜培养基的生物反应器中,以防止耗竭的培养基产生不利影响。在更大规模上,这可以通过使用切向流深层过滤 (TFDF) 等作为细胞截留装置的培养基置换策略来实现。与之前报道的类似规模化生产相比,这种生物反应器生产分别导致 VG/mL 和 VG/cell滴度增加 30 倍和 7.5 倍。令人惊讶的是,生物反应器上的病毒载体产率比小规模卫星培养高约 10 倍。同样,LCD 生物反应器生产也显示出比小规模实验更高的产率。生物反应器中产率的提高可能与更好地调节培养条件有关,例如溶氧和 pH 值。同样,没有观察到功能性滴度的损失,转染后 48 小时达到最大值 7.8 x 10^9 ETU/mL,VG/ETU 比率为 4.6(图 7D 和 E)。这些结果表明比以前的报告有所改进。
当生产在 1 x 10^6 cells/mL 以外的细胞密度下进行时,转染效率(通过转染后 24 小时的转基因表达测量)降低至约 30%,不同细胞密度的情况相似(图 1B、图 2C、和图 3A)。然而,表达转基因的细胞百分比与生产效率没有直接关联。其他研究小组在通过瞬时转染 HEK293SF 悬浮细胞产生病毒样颗粒的工艺中也观察到了同样的现象。Hildinger、Baldi、Stettler 和 Wurm 得出结论,转染效率的降低是由基于体积的 DNA 供应造成的。然而,在我们的研究中增加质粒 DNA 可用性并没有显著提高转导效率(图 1B、图 2C 和图 3A),这是通过检测三种质粒之一的产物来衡量的,这证实了之前的发现。据报道,能量需求增加会发生在较高的细胞密度下,并允许从转染中恢复,这是一种已知具有细胞毒性的事件。在类似灌流模式的生产工艺中,转染效率没有提高,即使补充了培养基(图 5B)也是如此。在较高的葡萄糖浓度下转染效率甚至更低。Lavado-García、Jorge、Cervera、Vázquez 和 Godia 部分解释了低转染效率是由于参与脂质生物合成和细胞内蛋白质核转运的途径下调所致。转染步骤本身是 AAV 载体生产中的一个已知瓶颈。我们小组最近的一项研究表明,尽管转导效率很高,但产生病毒颗粒的细胞比例低至 7%。
最近,报道了采用培养基置换策略在高细胞密度下提高 AAV8 产量。相反,细胞密度效应在我们的高细胞密度生产工艺中得到证实(图 3B 和 5)。 CDE 是指在高细胞密度下由于细胞特异性生产力降低而导致的产量下降。先前已经记录了使用其它生产系统(例如昆虫细胞)生产 AAV 时的这种效果。在生产过程中,25% 到 30% 的 AVV6 载体会释放到上清液中。由于高细胞密度以及提高振荡速度以适当为生物反应器供氧,因此细胞可能处于增加的纯应力下,并且可能已将更多载体释放到上清液中,这些载体在培养基置换期间被去除。这可以解释在 HCD 生产中病毒滴度在 96 hpt 时突然下降(图 3B),这是意料之外的,因为 AAV 载体被认为在很宽的温度范围内非常稳定。然而,同样的下降,补充培养基时未观察到 (图 5C)。
细胞密度效应被认为主要是由于低浓度营养物或抑制性代谢物积累引起的代谢限制所致。在 HCD 的生产工艺中,采用了类似灌流的模式来提供足够的营养,以支持高细胞密度并去除抑制性代谢物;然而,所选择的条件不足以防止 CDE(图 3)。尽管每天完全置换培养基,但在 HCD 时葡萄糖水平显著下降。出于这个原因,基础培养基 HyCell TransFx-H 含有约 6 g/L 的葡萄糖,并添加了葡萄糖或 Cells Boost 5。添加的量取决于细胞特异性葡萄糖消耗率,因此在任何给定时间都至少有 2 g/L 的葡萄糖可用,模仿在 LCD 产品中观察到的葡萄糖浓度。单独添加葡萄糖的培养基并不能恢复 AAV6 的细胞特异性生产力(图 5C)。CDE 得到缓解,并且仅当使用补充有 15% Cell Boost 5 的培养基时才能恢复细胞特异性生产力(VG/cell)(图 5C),这表明其它关键营养素限制了病毒载体生产。除了葡萄糖,Cell Boost 5 添加物的其它成分被认为有助于缓解 CDE。在使用 HEK293SF 细胞生产腺病毒载体时,Shen、Voyer、Tom 和 Kamen 强调所用培养基的组成对于支持 HCD 的高产率至关重要。然而,培养基和添加物的复杂性,例如 Cell Boost 5,它可以包含数百种不同浓度的不同成分,使对单个营养素对病毒载体生产的影响的理解变得复杂。优化细胞培养基,可以在生产AAV 载体时,提高滴度和载体质量,正如其它病毒载体中所见和所建议的那样。
如上所述,在培养基中添加 Cell Boost 5 可在含基因组颗粒方面减轻对细胞密度的影响;然而,对于功能性颗粒却没有观察到同样的情况。虽然补充培养基后功能性产量有所增加,但细胞特异性功能滴度(ETU/cell)并未完全保持,导致与 LCD 对照相比更高的 VG/ETU 比率(图 6)。一种可能的解释是病毒衣壳的错误组装,其化学计量比为 1:1:10 (VP1:VP2:VP3)。如果这个比例发生改变,AAV 递送转基因的功效就会降低。由于核定位信号,VP1 和 VP2 蛋白在转导中起着至关重要的作用,特别是在核转运中。VP1 的 N 末端还包含一个磷脂酶 A2 结构域,负责病毒从核内体中逃逸。我们的结果强调了通过测量生物活性载体评估病毒转导功效的重要性,作为优化 AAV 载体生产的一部分。尽管病毒载体的质量属性(包括功能滴度)是 FDA 推荐的效力测试的重要组成部分,但研究人员有时会忽略这种测量。
总之,我们证明可以在中等细胞密度下通过三质粒瞬时转染产生 AAV6,而不会损失细胞特异性生产力或功能滴度。为此,必须以细胞为基础提供质粒 DNA。我们的中等细胞密度产品达到了 10^10 VG/mL 粗裂解液滴度。与完善的生产方案相比,通过这种方法获得的产量显著增加。本研究中描述的用于 AAV 载体生产的中等细胞密度方法被证明在 3 L 生物反应器规模上是有效的。它可以用作大规模生产工艺的基础,可能有助于解决当前 AAV 生产中的载体短缺问题。当使用补充培养基进行类似灌流的操作时,细胞密度效应可以在更高的细胞密度下得到缓解,从而导致相似的细胞特异性生产率(VG/cell)。然而,细胞特异性功能生产率(ETU/cell)减少,突出了在生物工艺优化过程中评估病毒基因组和转导单元的重要性。需要进一步研究,以充分了解细胞密度效应如何导致功能滴度降低,以及如何完全缓解这种现象。
原文:P. Moco, X. Xu, A. Kamen, High-cell-density production of adeno-associated viral vector serotype 6 by triple transfection in suspension HEK293 cell cultures. 2023.






