二、基因编辑技术的应用领域
1.疾病模型
2.靶向基因治疗
3.动植物育种
4.微生物设计
5.基因诊断与核酸检测
三、基因编辑技术的关键问题
1.脱靶效应
2.效率问题
3.运输问题
4.免疫排斥
5.副作用
6.伦理问题
四、基因编辑技术国内外相关政策与规划
1.中国
2.美国
3.科研共同体及其他国家
五、基因编辑技术的临床应用
1.罕见病
2.神经退行性疾病
3.年龄相关性黄斑衰退(AMD)
4.1型糖尿病(T1D)
5.艾滋病(HIV)
6.肿瘤
二
基因编辑技术的应用领域
目前,基因编辑技术的开发及应用范围非常之广,其在基因功能研究、药物开发、疾病治疗以及作物育种等方面都有着重要意义和广阔的应用前景。
01
疾病模型
很多疾病的致病机制十分复杂,比如癌症,通常涉及多种抑癌基因或致癌基因的遗传改变。因此构建适合的疾病模型对探索疾病的发生和进展以及抗癌药物的筛选有着重要的意义。
对于已知致病基因的疾病,研究人员可以运用CRISPR-Cas9等基因编辑技术,构建对应的基因突变动物或细胞模型,从而进一步进行药物或其他治疗方式的研究;对于功能未知或者部分未知的基因,研究人员可以通过构建疾病模型从而进一步明确疾病与基因之间的关系。
目前,研究人员应用基因编辑技术,已经实现了多种疾病的体内和体外疾病模型的构建。其中在鼠科动物上,研究人员实现了多种疾病模型的构建,如利用CRISPR技术靶向Pten和p53(两种抑癌基因)构造的肝癌模型,以及诱导CD74-ROS1、EML4-ALK和KIF5B-RET融合导致的肺癌模型等。
另外,对于一些由多基因突变导致的人类复杂疾病,CRISPR-Cas9技术可以同时进行多基因编辑,如Zuckermann等通过在小鼠大脑中单基因敲除(Ptch1)和多基因敲除(Trp53,Pten,Nf1),成功构建了成神经管细胞瘤和成胶质细胞瘤疾病模型。
此外,研究人员还用CRISPR-Cas9技术在小鼠中构建了心肌病和心力衰竭模型。
02
靶向基因治疗
广义上的基因治疗是指在DNA水平上,通过特定的技术手段用正常的基因来替换或者补偿致病基因突变,从而达到治疗目的。常用的基因治疗方法包括用非病毒载体方法、慢病毒载体或腺病毒载体向体内注射正常基因,或者利用近几年崛起的基因编辑技术纠正致病突变等。
传统的基因治疗手段可将正常基因导入细胞,但致病突变依然存在,不能从根本上治愈疾病。而基因编辑技术可以对基因进行精准编辑,从而修复或修饰内源致病突变。因此,以CRISPR-Cas9系统为代表的基因编辑技术在临床治疗上具有广阔的应用前景。
03
动植物育种
应用CRISPR-Cas9等技术在农作物或动物基因中进行基因编辑,与传统杂交等育种方法相比,可以精确、快速培育出新品种。
在植物育种方面,研究者利用基因编辑技术可以加速作物培育过程或获得利于其生长的抗性。如在水稻中对OsEPSPS基因(编码与草甘膦具亲和能力的5-烯醇式丙酮酰莽草酸-3-磷酸合成酶)进行定点替换,可获得抗草甘膦除草剂的表型,以及通过基因敲除、改造启动子等方法加速水稻培育过程、获得抗旱和抗其他类型除草剂的农作物品种等。
在动物品系培养方面,研究者同样可以通过基因编辑技术得到具有优良性状的猪、牛、羊等家畜。如研究者利用ZFNs和CRISPR-Cas9技术通过MSTN基因敲除获得了高瘦肉率转基因猪。
04
微生物设计
基因编辑技术为工业微生物的改造与模式微生物设计提供了高效的工具,为生物燃料、化学品、新材料、医药产品、环境修复微生物等研发提供了新的选择。例如,中科院微生物研究所温廷益团队在2018年发展了一种CRISPR-Cas9辅助多重基因组编辑方法,包括多重基因敲除、多位点和多拷贝整合方法,为酵母的基因工程和合成生物学研究提供了一个有效的工具。
05
基因诊断与核酸检测
CRISPR系统具有用一条sgRNA靶向DNA或者RNA的特性,利用该特点研究者开发了一系列的工具用于检测样品中是否存在某种特定的核酸,从而实现即时检测病原体、基因分型和疾病监测等功能。
2018年,科学家首次证明了基于CRISPR的基因编辑技术在病毒核酸检测方面的重大应用潜力,两项代表性工作都来自麻省理工学院张锋团队,一项是利用CRISPR-Cas12a系统可以准确地识别人源样本中不同类型的HPV病毒;一项是利用基于CRISPR-Casl3a的SHERLOCK系统检测人源样本中的寨卡病毒,登革热病毒以及其他有害细菌。
2020年,张锋团队又开发出了利用基于CRISPR-Cas13的SHERLOCK系统快速检测新型冠状病毒。而国内首次批准利用CRISPR技术的新冠病毒检测试剂盒则是2020年12月,由杭州众测生物研发的新型冠状病毒2019-nCov核酸检测试剂盒(CRISPR免疫层析法)。
由于在IVD领域,相较于传统PCR技术而言,CRISPR技术具有诸多优势,如诊断特异性极好、技术操作简单、对仪器设备依赖性低、价格低廉以及结果可视化等,因此,家庭用CRISPR诊断试剂盒也是目前许多公司发展的方向。

CRISPR技术与传统PCR技术比较(来源:公开资料)
三
基因编辑技术的关键问题
01
脱靶效应
脱靶效应就是识别到非靶标基因也会进行基因编辑,虽然已经有基于CRISPR-Cas9技术的多种衍生改良技术的出现,例如为降低脱靶效率设计的CRISPR-Cas9-nickase基因编辑技术、CRISPR-Cas9-FokⅠ基因编辑系统和能与Cas9系统实现功能互补的CRISPR-Cas12a基因编辑技术,还有能实现对RNA进行基因编辑的Cas13a、Cas13b、Cas13d系统,这些技术降低了脱靶率并且提高了精准度,但是依旧无法完全解决这个问题。脱靶效应是目前制约基因编辑技术发展的一个重要因素,也是亟待解决的核心问题。
02
效率问题
研究表明CRISPR-Cas9技术进行HDR相比NHEJ的效率低,仅为3.5%到15.6%。有研究显示HDR依赖于sgRNA和Cas9的浓度,但是提高sgRNA和Cas9的浓度会增加脱靶效应。因此,平衡sgRNA和Cas9的浓度,提高HDR的效率也是需要解决的问题之一。
03
运输问题
目前病毒载体广泛应用于CRISPR-Cas9技术,包括腺病毒载体(AdVs)、整合酶缺陷型慢病毒载体(IDLVs)和重组腺相关病毒载体(rAAVs),这些病毒载体都不会整合入宿主DNA中。IDLVs载体容量较大,约10 kb,但是会持久表达Cas9,加强脱靶效应。AdVs和rAAVs具有低免疫原性和非致病性,缺点是容量较小,约4.5 kb,然而CRISPR-Cas9约为8–10 kb。有研究使用两个独立的rAVVs包装CRISPR-Cas9,但这种设计会影响CRISPR-Cas9技术的效率。
04
免疫排斥
CRISPR-Cas9技术来源于原核生物天然获得性免疫系统,人类本身不具有Cas9蛋白,并且存在Cas9抗体,在基因治疗的过程中,外源性的蛋白以及病毒载体的导入会使机体产生免疫排斥,这必然会让研究者考虑到安全性的问题。
05
副作用
2018年有报道称CRISPR-Cas9高效编辑的同时伴随着人类p53基因的功能抑制,然而p53基因是人体重要的抑癌基因,这会增加癌细胞的逃逸机会,或让基因编辑过的细胞成为潜在癌细胞。另外,在2018年7月还有研究团队通过第三代测序技术大范围的基因型鉴定,发现CRISPR-Cas9会导致靶点附近大段基因组片段的丢失,甚至还有DNA重排问题,但是这个问题仅在细胞中出现,胚胎水平还没有相应大片段丢失的报道。
05
伦理问题
目前,国内外对基因编辑的边界和红线都达成了共识,对胚胎发育阶段或生殖系细胞进行体外基因编辑的研究是被允许的,但绝不能用于生殖的目的,而且其研究的过程需要政府主管部门进行严格的监管,流程需要公开透明。
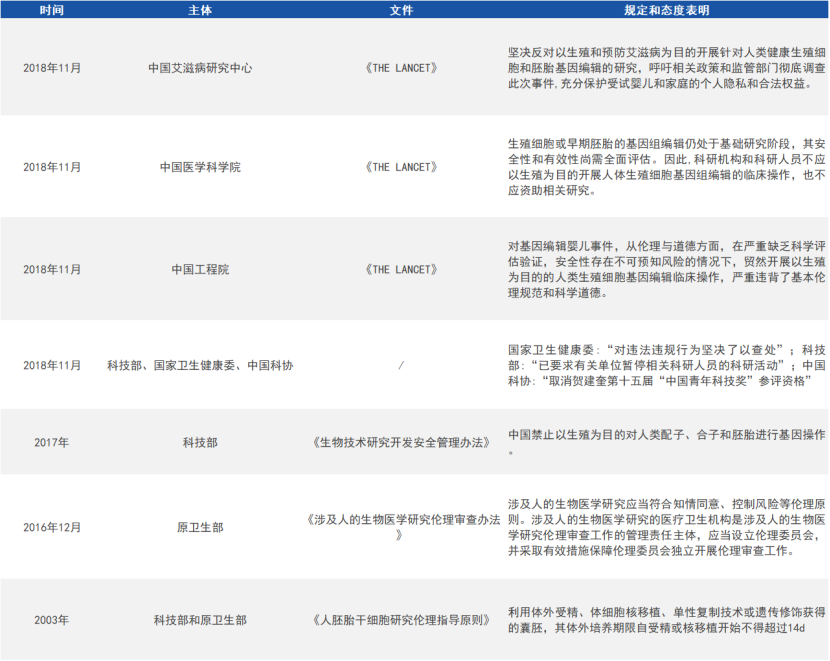
国内对基因编辑技术的伦理规范及态度声明(来源:参考资料1)
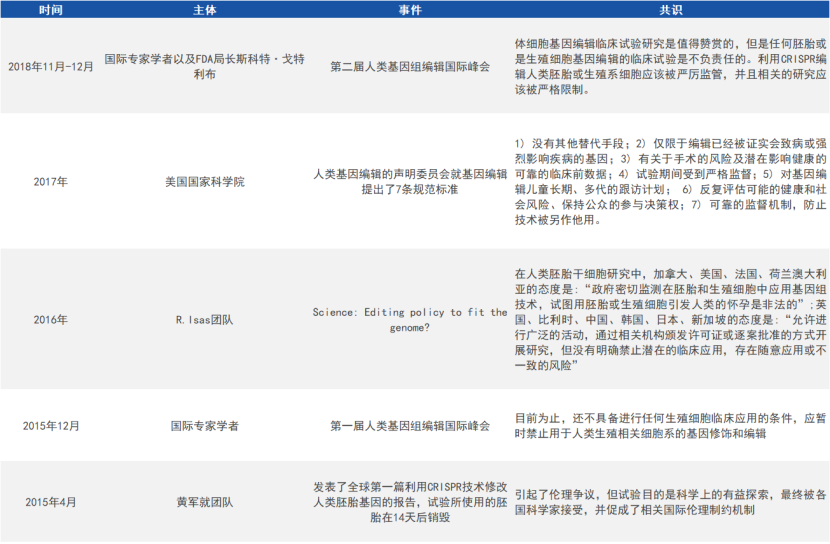
国外对基因编辑技术的伦理规范(来源:参考资料1)
四
基因编辑技术国内外相关政策与规划
作为一项变革性的新兴技术,基因编辑研究和临床试验是新鲜事物,各国都没有现成的监管经验,在技术监管和风险防控上均保持较高的谨慎态度。近年来,多国围绕人类基因编辑发布了一系列报告,初步构建了基因编辑政策框架。
1. 中国
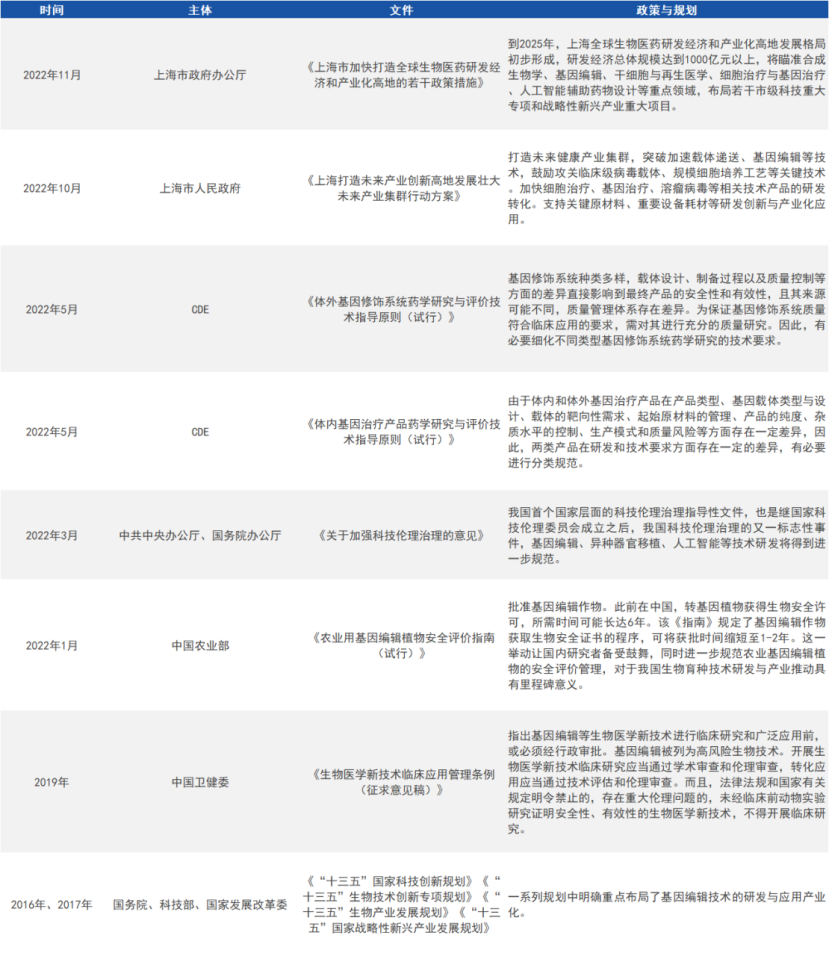
来源:公开资料,小编自制图
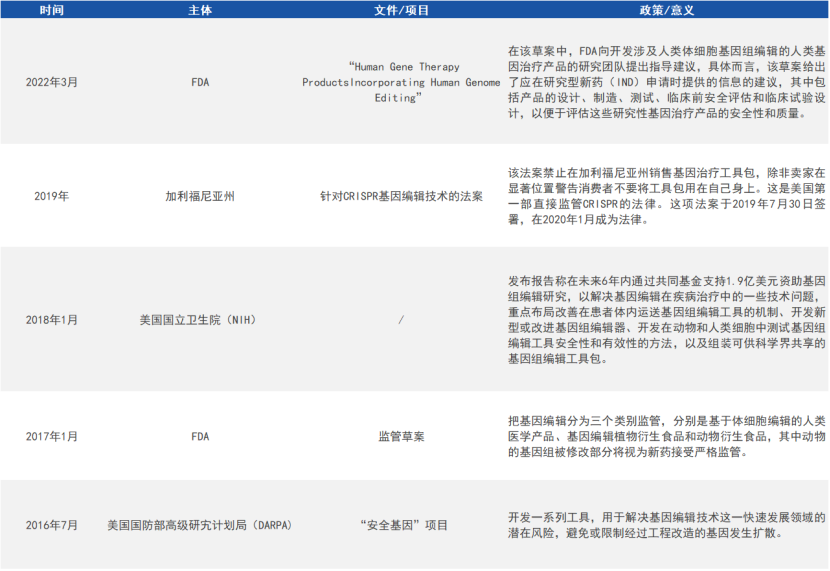
来源:公开资料,小编自制图

来源:公开资料,小编自制图
五
基因编辑技术的临床应用
近年来,不断涌现的研究成果证实了基因编辑在临床治疗中的广阔前景,如利用TALENs治疗杜氏肌营养不良(DMD)、HIV;ZFNs治疗帕金森(PD);TALENs或ZENs都有望治疗大疱性表皮松解疾病和α1-抗胰蛋白酶缺陷症;TALENs或CRISPR-Cas9治疗镰刀型细胞贫血症,CRISPR-Cas9治疗遗传酪氨酸血症、白内障等。
01
罕见病
罕见病又称为“孤儿病”,大多病情严重且无有效治疗办法。80%的罕见病由遗传变异所引起,多为单基因遗传病。单基因遗传罕见病结合精准医疗可更为轻易地识别患者,靶点明确,是基因疗法最具潜力的病种,如遗传性血液病、杜氏肌营养不良症(DMD)等。
1.1 遗传性血液病
在红细胞中,血红蛋白负责运输氧和二氧化碳,由两条类α珠蛋白链(α链或ξ链)和两条类β珠蛋白链(β链、γ链或ε链)各结合一个血红素组成。珠蛋白基因突变会引起血红蛋白病,包括血红蛋白变异体和地贫,前者受累于血红蛋白结构异常,后者则由于α链或类β链合成数量减少/缺失,致使另一条珠蛋白链含量相对过剩并沉积于红细胞膜,进而引发溶血,严重可导致胎儿流产和患儿死亡。根据减少/缺失的珠蛋白链的不同,地贫可分为α-地中海贫血(α-地贫)、β-地中海贫血(β-地贫)等。
血友病是由凝血因子基因突变导致相应凝血因子严重缺乏而引起的出血性疾病,其中血友病A和血友病B最常见且均为X连锁隐性遗传病,分别由于凝血因子VIII基因(factorVIII,FVIII)和凝血因子IX基因(factorIX,FIX)突变而引起。
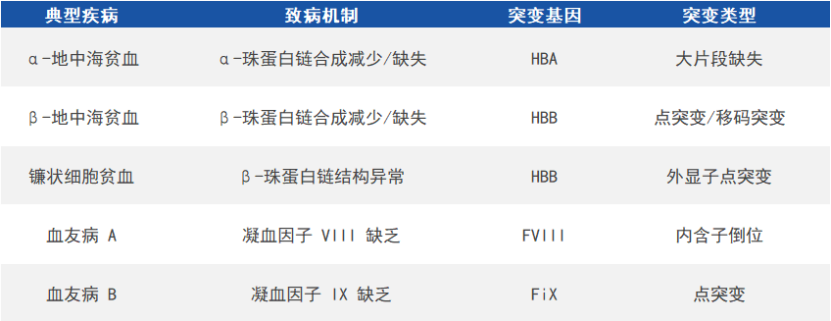
常见遗传性血液病(来源:参考资料8)
对于上述遗传性血液病,临床上主要采取长期规范输血、成分输血等方法进行对症治疗。这些短效的对症疗法无法根治遗传性血液病,且长期反复输血会导致铁沉积,还可能引发感染和过敏反应,甚至导致死亡。少部分患者可通过异体骨髓或造血干细胞移植获得长效/永久的治疗效果,但存在供体缺乏和免疫排斥等问题,且费用昂贵。随着现代基因编辑技术的进步,基因治疗成为具有巨大前景的治疗方案,有望根治遗传性血液病。
1.2 杜氏肌营养不良症(DMD)
DMD是X染色体p21.2上抗肌营养不良蛋白(dystrophin)基因突变引起的最常见和最严重的肌营养不良症,这种突变导致患者肌肉中缺少dystrophin,特征是进行性肌肉退化和萎缩,导致心肌病和呼吸衰竭而过早死亡。dystrophin是X染色体编码的最大基因,包含约260万个碱基和多达79个外显子,在人类已经发现了超过3000种不同的突变。该疾病是最常见的单基因遗传性疾病之一,也是如今大热的基因治疗领域中最受关注的疾病之一,因为其致病基因十分明确,有且只有一个——dystrophin。
02
神经退行性疾病
神经退行性疾病是机体神经元结构或功能逐渐丧失而引发的一类疾病,目前由于病因尚不明确并无有效治疗手段,且严重威胁着患者的生活质量。基因疗法可以将外源正常基因导入靶细胞,以纠正或补偿因基因缺陷和异常引起的神经退行性疾病,如脊髓性肌萎缩症(SMA)、帕金森(PD)等。
2.1 脊髓性肌萎缩症(SMA)
SMA是一种罕见的遗传性神经肌肉疾病,以脊髓和下脑干中运动神经元的丢失为特征,从而导致严重的、进行性肌肉萎缩和无力。最终,SMA患者可能丧失行走能力,并且难以完成呼吸和吞咽等基本生活功能,需要重大的医疗干预和护理帮助。如果不进行治疗,大多数患有最严重类型SMA的婴儿在没有呼吸干预的情况下,无法活到两岁。
SMA由运动神经元存活(SMN)基因丧失功能突变致病,人的SMN在每条5号染色体上均有2个高度同源且编码相同蛋白的拷贝,即端粒端的SMN1和着丝粒端的SMN2,两者只相差5个碱基,其中编码序列仅相差1个碱基,即7号外显子的第6个碱基C/T(840C/T)。由于C的改变,使SMN2产生了选择性剪切,转录产物中90%缺少7号外显子,翻译成截短且不稳定的SMN蛋白。
临床上绝大部分SMA患者是由SMN1基因大片段缺失或微小突变导致,而几乎全部SMA病人都含有至少一个SMN2拷贝,因此SMN2一直是SMA治疗的理想靶标。
2.2 帕金森(PD)
帕金森病是世界上第二常见的神经退行性疾病,目前没有中止疾病进展的有效治疗手段。编码α突触核蛋白的SNCA基因上的突变是治疗帕金森病的重要靶点之一。而且,越来越多的证据显示,α突触核蛋白水平的升高与帕金森病的发病有因果性关系。SCNA基因调控失常的患者α突触核蛋白的表达水平可提高200%,将SCNA的mRNA和蛋白表达降低25~50%可能就足以将α突触核蛋白的表达水平恢复正常。
Seelos Therapeutics公司的创新表观遗传学基因编辑疗法SLS-004,通过调节DNA甲基化来调控编码α突触核蛋白的SNCA基因的表达。SLS-004使用CRISPR-dCas9引导的DNA甲基转移酶3A(DNMT3A),利用慢病毒在脑内递送,在SNCA基因内含子1的特定位置提高DNA甲基化,从而精准地降低SNCA的表达。此前在体外实验中,SLS-004可导致α突触核蛋白水平降低~40%。
03
年龄相关性黄斑衰退(AMD)
AMD是导致成人失明的主要原因,脉络膜新血管形成(CNV)是其主要病理学特征,血管生成因子如VEGFA基因的高表达是造成病变的主要原因。
Kim等将预先设计好的Cas9核糖核蛋白(RNP)导入成年小鼠眼中,使视网膜色素上皮中VEGFA基因失活;并且在AMD的小鼠模型中发现cas9RNPs有效地减少了脉络膜新血管生成的面积。该研究表明CRISPR-Cas9技术有可能用于非遗传性退行性眼部疾病的局部治疗。
04
1型糖尿病(T1D)
T1D是自身免疫性疾病,是一种因体内胰岛素分泌不足,或人体无法有效地利用胰岛素而导致的慢性病。胰岛素是胰腺细胞分泌的一种调节血糖的荷尔蒙,主要参与调节血糖水平。
T1D患者免疫系统攻击并摧毁机体正常产胰岛素的胰岛β细胞,机体因胰岛素缺乏不能清除多余葡萄糖维持机体正常血糖水平,血糖升高,患者终生需要外源性胰岛素治疗。
基因编辑技术公司CRISPR Therapeutics和再生医学公司ViaCyte合作开展的VCTX210 治疗1型糖尿病的Ⅰ期临床试验正在进行中,目前已经完成首位患者给药。VCTX210利用CRISPR技术敲除与T细胞供给相关的基因对干细胞进行基因编辑,分化出胰腺细胞移植入患者体内,使其逃避患者免疫系统的识别,重塑胰岛细胞的正常分泌过程。
05
艾滋病(HIV)
艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
第一次在人类中应用靶向核酸酶是利用ZFNs技术编辑CCR5基因抵抗HIV。研究者从HIV病人中提取T细胞,用ZFNs技术干扰T细胞中CCR5基因,由于CCR5基因是大部分HIV菌株尤其是早期感染菌株的辅助受体,干扰CCR5基因的表达可以抗HIV感染,表明基因编辑技术可能成为艾滋病治疗的新方向。
06
肿瘤
肿瘤发生是一个复杂的过程,涉及多基因和多阶段的变化,包括原癌基因激活、抑癌基因失活,以及微缺失、微重复、重排和染色体结构异常等。免疫疗法是目前肿瘤治疗的主要方式之一,其利用具有抗肿瘤功能的单克隆抗体或者供体T细胞,靶向自身免疫系统。在肿瘤的演变过程中,会出现免疫逃逸现象,即机体免疫系统无法识别肿瘤细胞特异性抗原,使其逃过免疫监视。基因编辑与免疫疗法相结合,可重新恢复对肿瘤细胞的免疫监视功能,以清除肿瘤细胞,该方法在白血病、淋巴瘤和部分实体瘤中有巨大的发展前景。
人工改造的具有嵌合抗原受体的T细胞(CAR-Tcells)具有肿瘤细胞特异性抗原嵌合结构域,可激活T细胞,实现对肿瘤细胞的杀伤作用。Ren等使用CRISPR-Cas9系统同时破坏多个基因位点,产生的TCR和HLA-I缺陷的CAR-T细胞可作为通用的CAR-T细胞,用于免疫治疗;除了产生通用的CAR-T细胞,基因编辑技术也可通过敲除编码T细胞抑制受体或信号分子的基因如PD-1和CTLA4,用于产生增强型CAR-T细胞。
2016年,四川大学华西医院卢铀团队开展了CRISPR基因编辑技术的临床实验,从转移性非小细胞肺癌患者中分离出T细胞,并使用CRISPR-Cas9技术敲除细胞中的PD-1基因,在体外扩增到一定量后再重新输回患者体内,达到杀死肿瘤细胞的目的。这是世界首例基因编辑细胞人体注射。2020年,该临床试验结果公布,该结果证实了CRISPR-Cas9基因编辑的T细胞临床应用是安全可行的。
随着测序技术的发展,越来越多与肿瘤发生发展相关的突变基因被鉴定出来。CRISPR-Cas9系统高效、特异的基因编辑功能,为直接靶向生物体内引发癌变的突变基因提供了可能。基于CRISPR-Cas9系统的个体化靶向治疗,在基因水平的肿瘤治疗中显示出的巨大潜力,也为肿瘤治疗提供了新方向。
六
小结
从1996年对ZFNs第一次进行体外验证到2012年CRISPR-Cas9技术的出现和以后的蓬勃发展,基因编辑技术发展迅速,编辑效率和精确性都在不断提高,应用领域也在不断拓宽。不仅可用于表达调控和基因功能的研究、细胞动物模型的构建、癌基因和药物靶点的筛选,而且在基因治疗中更是为单基因遗传病、癌症等疾病提供了新的治疗方法。
虽然目前这项技术在成熟应用之前仍然面临着递送系统、脱靶效应以及潜在的免疫反应等副作用的问题。但总体来看,基因编辑技术在临床应用、分子育种及合成生物学等产业发展潜力巨大,将会带来较高的社会价值与经济价值。该技术的临床转化和应用研究值得我们期待,这或将成为下一代转化疗法和治疗范例的关键,并促进个体化医疗的快速发展。
另外,对于目前基因编辑技术的关键问题,我们相信在未来多学科的交叉融合和科学家的共同合作下,也将会一一得到解决。






