AAV 是体内基因治疗的主要形式,有几种已批准的药物,数百项正在进行的 1 期、2 期和 3 期试验主要针对眼部、肝脏、肌肉或中枢神经系统适应症,但也有针对心血管和肺部疾病的新研究。这些产品使用一系列天然血清型(AAV2、AAV8、AAV9、AAV5、AAV6、AAV1、AAVrh10、AAVrh74)或越来越多地使用工程衣壳。转基因受各种启动子(CMV、CBA+CBh、CAG、普遍存在的、天然的或越来越多的组织特异性启动子)的控制。给药是全身性的(肌肉内或静脉内)或局部的(视网膜下、颅内、玻璃体内、冠状动脉内或关节内)。随着 AAV 形式的完善,产品范围的扩大,AAV 的工业规模可能会增长几个数量级,生产 AAV 的工艺也会得到改进。
过渡到悬浮
虽然 AAV 广泛用于临床前和临床开发,但其大规模生产仍然是一个挑战,受到低生产率、产品杂质(例如低完整:空衣壳比)以及由于一系列途径而导致的降解的困扰,导致产品性能不良(例如低感染性、毒性)。此外,关键工艺指标可能因血清型和 GOI 而有很大差异。
AAV 可以通过在贴壁或悬浮生物反应器中培养细胞来生产。
Thermo 的 Cell Factory 或 Corning 的 HyperStacks 等扁平多层系统类似于科研实验室中使用的培养板。放大它们是不切实际的,除非是非常小的、局部注射的 AAV 适应症。贴壁培养的另一个严重缺点是需要在细胞培养基中加入胎牛血清 (FBS),这会导致可变性、潜在的安全风险和未来的监管问题。
更先进、占地面积更小、可放大的固定床系统包括Pall 的 iCELLis、Univercells(比利时Charleroi)的 ScaleX 和 Esco Aster(新加坡)的 Tide Motion。固定床系统减少了切换到悬浮驯化细胞系的需要,并且由于减少了工艺优化的时间,可以提供更快的上市时间。
然而,对于更普遍的适应症和全身给药的 AAV,使用高达 3,000 L的一次性生物反应器进行悬浮培养是唯一实际可规模放大的解决方案。事实上,大多数 CGT 开发商现在都在使用悬浮系统,来自 Repligen(美国马萨诸塞州Waltham)的数据表明,“60% 的基因治疗公司已经从贴壁平台过渡到悬浮模式,30% 支持这两种平台,10 % 仍然致力于贴壁工艺”。BioProcess International 的一篇文章介绍了Takeda在 1,000 L一次性反应器中生产 AAV 的案例。
在搅拌罐生物反应器中进一步强化工艺和提高活细胞密度的一种方法是使用细胞截留装置。它们可用于补料分批或连续“灌流”模式。Cytovance Biologics(美国俄克拉荷马州Oklahoma City)报告了一项实验的数据,显示细胞密度提高了 10 倍(从约 10^6-10^7 cells/mL ),有趣的是,衣壳浓度超线性提高 100 倍(从 10^10– 10^12 capsids/mL)。Repligen 推广的切向流深层过滤(TFDF)技术,将切向流和深层过滤结合在一个一次性使用的封闭式过滤装置中。它可用于细胞截留和澄清。
改善三质粒转染
生产 AAV 最直接的方法是基于三质粒转染使用瞬时表达,如图 3A 所示。通常,三种质粒的摩尔比可能与 1:1:1 有很大差异,具体取决于工艺优化。这种方法行之有效、稳健且灵活;可以轻松切换 GOI 或血清型。它适用于悬浮培养中的化学成分确定、无血清、无蛋白质的培养基。一种很少使用的“无辅助”替代方案仅使用两种质粒,一种带有 GOI,另一种带有所有其它组件,包括辅助序列。
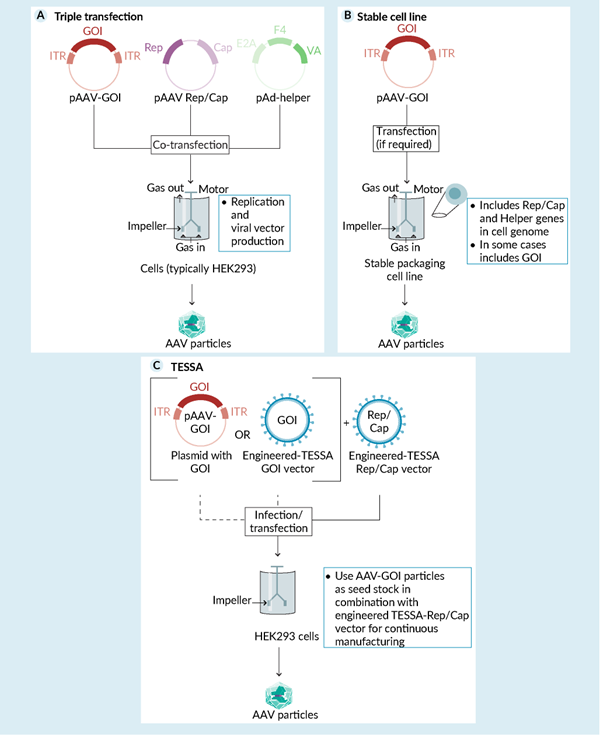
图 3. 制备 AAV 的方法。A) 使用三种质粒(或其它 DNA 形式)的三质粒转染非常灵活,可用于所有规模。B) 稳定细胞系可以提供更高的生产率,并降低悬浮培养的成本。C)TESSA 系统使用专门设计的腺病毒载体,针对AAV2 的早期结果显示出比无辅助系统高得多的感染性和产量。
瞬时表达的几种类型的改进工作正在进行中。首先,前文介绍的 Doggybone DNA 或纳米质粒 DNA 可以替代质粒。用于三质粒转染的 HEK293 细胞系在最高可实现细胞密度和倍增时间方面仍远远落后于优化的 CHO 细胞系,预计其会有进一步的改进。WuXi Apptec(中国上海)收购的OXGENE(英国牛津)是一家为 AAV 生产提供改进质粒的公司的例子。他们的包装质粒有一个由强 (CMV) 启动子调节的 Cap,而 Rep 由较弱的脑心肌炎病毒内部核糖体进入位点 (EMCV IRES) 调节。该公司的结果显示出更高的滴度(2-8 倍,取决于血清型)和更高的完整衣壳总比率。人们可以预见用于 AAV 生产的质粒会进一步改进。一个例子是经过重新配置、以避免污染双链 DNA 包装的质粒。P5 启动子中的一些序列最近已被证明可以表达(在小鼠中)。它们可能具有免疫原性,这是一个问题,尤其是在高剂量时。更糟糕的是,如果少量污染物 DNA 已整合到原癌基因附近,这可能会导致致癌事件。然而,在 RepCap 质粒的 P5 启动子中插入 DNA 间隔子可最大限度地减少污染物的存在。这一结果表明,生产工具的微小差异可能对产品产生潜在的严重影响。AAV -目的基因 (AAV-GOI) 质粒中的工程启动子可以帮助控制其强度、大小(考虑到 AAV 基因组大小有限,为 GOI 提供更多空间)或组织趋向性。这是 Circularis Technologies(美国加州奥克兰)提供的产品的一部分,其中涉及用于选择最佳序列的环状 RNA 和 DNA。该公司已被 Gingko Bioworks 收购,可以期待更多的合成生物学玩家为 CGT 的新生物工具的创造做出贡献。
最近推出的特殊转染试剂盒,包括Polyplus 的 FectoVIR-AAV 和 Mirus Bio(美国威斯康星州麦迪逊)的 TransIT-VirusGEN® SELECT,与标准聚乙烯亚胺 (PEI) 相比,可将 AAV 转染的产量提高约 5 倍。Thermo Fisher Scientific 最近推出了 Gibco CTS AAV-MAX Helper-Free AAV 生产系统,使已经使用其 AAV-MAX Helper-Free AAV 生产系统的研究人员能够轻松扩大到临床和商业规模。瞬时方法的一个缺点是依赖于多个质粒,这增加了成本。正如前文所述,一旦质粒市场当前的紧张局势得到解决,这种限制就不会大规模出现。然而,交货时间紧张导致一些 CDMO 和药物开发商开始实施内部质粒生产计划,以节省时间,并避免依赖外部供应。
稳定细胞系
另一种方法也需要较少或不需要质粒和转染试剂,它使用所谓的稳定 HEK293 细胞系,其在细胞基因组中包含部分(“包装”细胞系)或全部(“生产者”细胞系,其也包括 GOI)三质粒系统的组成成分,见图 3B。被 Cytiva 收购的CEVEC(德国科隆)提供这种悬浮驯化的稳定细胞系,并已非独家授权给罗氏、Biogen(美国马萨诸塞州剑桥)和 UCB(比利时布鲁塞尔)。另一个供应商是 Vigene(美国马萨诸塞州罗克维尔),Charles River Laboratories(美国马萨诸塞州威尔明顿)于 2021 年收购了这家公司。Oxford Biomedica(英国牛津)开发了一种双质粒系统,通过关闭生产细胞系中 GOI 的表达,提高产量和质量。载体生产中的转基因抑制 (TRiP) 系统涉及色氨酸 RNA 结合衰减蛋白 (TRAP)。
由于 TRAP 结合序列 (tbs) 插入载体基因组中 GOI 的上游,L-色氨酸过量,GOI mRNA 的翻译被阻断。为了生成优化的稳定细胞系,64X Bio(美国加州旧金山)正在利用一种专有的条形码技术,该技术涉及工程密码子和同源转移 RNA,以便以汇集的形式测量单个突变细胞中的病毒载体生产力。随着组学实验开始确定参与从贴壁细胞到悬浮细胞转变的关键基因,以及哺乳动物基因组工程和单细胞筛选技术的迅速改进,细胞系工程有望取得进一步进展。
稳定细胞系的一个好处是避免转染,这在大体积悬浮培养中可能具有挑战性。它还可以减少批次间的差异。然而,这种方法,尤其是涉及使用生产细胞系的方法,远不如使用三质粒转染灵活,而三质粒转染仍然是工业中最常用的方法,即使在较大规模上也是如此。其它问题包括更长的 GMP 稳定细胞系开发时间、IP 许可和自由操作 (FTO) 考虑因素。此外,病毒蛋白的潜在毒性会降低细胞的性能,需要验证培养中“稳定”细胞系的长期稳定性。
昆虫细胞和杆状病毒提供了一种替代方法,可以轻松地以高密度悬浮培养。供应商包括 Vigene 和 Thermo Fisher,后者还销售一种新的化学成分限定的 Gibco ExpiSf 昆虫细胞培养基。使用杆状病毒辅助病毒合成 AAV 的显著限制是需要避免辅助病毒污染 AAV 产品、辅助病毒的不稳定性,以及可能更关键的是,AAV 产品生物学特性改变的可能性,可能是由于翻译后修饰谱的差异。另一种比杆状病毒不太常见的替代方法是使用单纯疱疹病毒 (HSV)。
OXGENE 的 TESSA 系统
为了在避免这些限制和提高质量的同时,达到类似的产量,OXGENE 开发了一种“替代方法”(图 3C),该方法依赖于针对 AAV 生产优化的工程腺病毒 (Ad),而不会伴随 Ad 颗粒的积累,这将很难去除。TESSA 代表启用四环素的自沉默腺病毒,使用诱导型启动子。TESSA 腺病毒载体可以三种不同的方式使用。1) 使用两种工程化腺病毒:TESSA-GOI(编码包括目的基因)和 TESSA-RepCapX(编码 Rep 和 Cap 蛋白,TESSA 可用于所有常见血清型,并且可获得与 AAV2、6、8 和 9 相关的数据), 一种以高产率生产 rAAV2-GOI。2) 使用工程腺病毒和质粒:TESSA-RepCapX 和一个 GOI 质粒。3) 使用工程腺病毒和 AAV 种子库:TESSA-RepCapX 和 AAV2 种子库(尽管 Su 等人指出,如果在此过程中交换血清型,则存在低水平的 AAV2 污染物)。根据公司数据显示,当使用增强型绿色荧光蛋白 (EGFP) 作为模型基因时,与瞬时系统相比,TESSA 可使产量提高 30 倍。至关重要的是,根据体外感染性测定,转导效力比商业参考品提高了7 ~ 60倍,但AAV血清型有一些变异。体内感染性数据对于确认这些令人印象深刻的结果至关重要。TESSA 似乎是一种很有前途的、生产 AAV 的新方法。一个缺点是相对复杂(两种工程腺病毒)可能需要一些时间来构建,但考虑到 TESSA 系统的潜在好处,这可能是一项值得在临床前或早期临床阶段考虑的投资。另一个是新颖性以及缺乏与传统系统的兼容性,这可能会阻碍试图尽快改进其产品的开发人员的接受度。然而,如果通过体内实验证实各种衣壳和 GOI 具有较高的感染性数量,这可能是一个关键的区别,因其可以减少剂量、成本,并可能减少与大剂量 AAV 相关的毒性,这是一个有待监管机构审查的活跃话题。
有趣的是,该公司描述了一种“衣壳交换”策略,其中 rAAV2-GOI 与 TESSA-RepCapX 共同感染,其中 CapX 是目标衣壳的帽基因(例如,对于野生型,X=9). 这可能允许生产目前难以生产的血清型或工程衣壳,并拓宽 AAV 的实际生化空间。
AAV衣壳工程
几家新的基因治疗公司专注于开发专有的 AAV 衣壳工程平台。Capsida(美国加州千橡市)、Affinia(美国马萨诸塞州沃尔瑟姆)、Dyno Therapeutics(美国马萨诸塞州波士顿)和 Stride Bio(美国北卡罗来纳州达勒姆) 2021 年分别获得了约 1 亿美元的资金。Sirion(德国慕尼黑),被 Perkin Elmer(美国马萨诸塞州沃尔瑟姆)收购,并与赛诺菲(法国巴黎)就此项目达成了合作,Dyno Therapeutics和 AskBio 也提供工程 AAV 衣壳。Vector Builder,一家基因治疗 CDMO,去年宣布投资 5 亿美元在上海新建一座工厂,最近透露该公司将投资3000万美元建立一个大型的工程AAV衣壳库,其中包含来自非人灵长类动物(NHP)的生物分布数据。该库可供学术界进行非营利性研究,并授权给商业公司。Church lab也一直在探索基于机器学习 (ML) 的衣壳工程方法。所有这些工程工作的目标之一是组织趋向性,以提高效力并减少剂量和副作用。其它既定目标包括降低免疫原性,从而降低毒性,同时通过允许对先前在自然界中感染过野生型血清型而具有预先存在的体液免疫的患者进行给药,从而扩大可用药患者群体。
工程衣壳选择过程也有利于“可生产性”并推动更高的产量、纯度和/或感染性。众所周知,不同产品之间的 rAAV 产量和感染性差异很大,根据所使用的生产和纯化方法,看看工程衣壳可以带来多少改进将很有趣。
备注:其它病毒
上面针对 AAV 讨论的大多数改进(TESSA 除外,它依赖于腺病毒)适用于 LV 生产。专用质粒、细胞系和转染试剂已商业化。例如,iVexSol(美国马萨诸塞州波士顿)提供用于 LV 生产的稳定细胞系。大多数这些相同的方法都可以用来改进其它病毒载体的生产,如γ-逆转录病毒和腺病毒。自然界中还有更多病毒,其中一些可用于 CGT:Ring Therapeutics(美国马萨诸塞州剑桥)在 2021 年筹集了超过 1 亿美元用于开发指环病毒(anelloviruses),但它们是否适合生产仍不确定。
框 2 体积、规模和成本概述。
体积和产能需求
已安装的 CGT 产能
Bioprocess International 估计,目前的生物制药产能约为 1,700 万升,其中哺乳动物细胞约 1,200 万升,细菌约 500 万升,血液和血浆约 100 万升,植物细胞和酵母也有少量产能。CGT目前只占该规模的 1.2%,其中,约87,000 L 用于基因治疗和 约 122,000 L 用于细胞疗法。每剂细胞数量因细胞类型和细胞疗法的适应症而有很大差异;对于基于病毒载体的基因疗法,病毒剂量的变化范围更广。我们将介绍 AAV 的产能估计。
AAV 的产能需求
为局部注射而生产的 AAV,例如在眼科适应症中,只需要大约每剂 10^11 – 10^12 病毒基因组 (vg)(例如,Luxturna 的剂量是每只眼睛 1.5×10^11 vg)。对于每年有 1,000 名患者的小适应症,只需生产 10^14-10^15 vg AAV,不需要大量的产能。当 LV 用于转化细胞进行体外基因治疗时,观察到相同的情况。相比之下,为全身递送而生产的 AAV 目前每剂需要 10^15-10^16 vg,例如,对于Zolgensma,9公斤的患者需要10^15 治疗杜氏肌营养不良症 (DMD)需要4×10^15。如果目标人群较大,例如 10,000 名患者(对 DMD 的合理估计),那么需要生产相当数量的纯化 AAV,10^19–10^20 vg。最近的一份白皮书估计了为 DMD 生产 AAV 所需的产能:大约 80 个 3,000 L一次性生物反应器(每年 20 批次,约 40% 冗余),是针对这种单一适应症的已安装基因治疗产能的三倍!根据类似的假设,我们计算出大约需要五万个 40 层 CellFactory 系统,或者大约七百个 500 m2 iCELLis 固定床系统,这些都是不切实际的。重要的是,产量因血清型的不同而有很大差异,这些只是粗略估计。然而,这个例子说明了需要新技术来强化悬浮培养并提高 AAV 滴度和整体工艺产量。
临床试验物料需求
多位作者预计到 2026 年将进行约 10,000 项活跃的 CGT 临床试验,总共招募约 100,000 名患者。这意味着未来几年 CGT 生产量将急剧增加。它还带来了超越规模的新挑战:灵活性和速度。在为临床试验生产 CGT 产品时,生产成本通常是次要考虑因素,因为它主要由试验中的其它成本决定。重点是可以快速优化的灵活工艺,以减少在临床上推进候选产品以及在专利有效期间实现商业化的时间。展望未来,人们还需要能够有效且快速放大规模的工艺。考虑到试验中 CGT 候选产品的数量和多样性,最著名的 CGT 开发商和大多数 CDMO 也希望拥有一种可以根据管线的命运轻松、快速地从一个生产工艺重新分配到另一个生产工艺的能力。
COGS
补充表 2 提供了自体细胞疗法、质粒、AAV 和 LV 的 COGS 估计范围。产品的性质(例如 AAV 血清型,它对产量有很大影响)、生产模式(例如细胞疗法的集中式与分散式,质粒生产的内部与外包),当然,规模也会影响这些估计。药物成本和价格必须放在整体医疗成本的背景下考虑(见下文自体 CAR-T),而制药行业无疑是巨大且高利润的,但医药支出也不到整体医疗支出的 15%。然而,公众对某些价格的强烈抗议、来自监管机构的压力以及规模需求,同时能够为支持复杂而漫长的研发的投资者和公司提供有吸引力的投资回报,以及药物开发固有的高风险和失败率,意味着许多 CGT 模式实现工业化的目标必须是降低生产成本。
DNA
对于 GMP 质粒 DNA,小批量 GMP 质粒 DNA 的生产仍然很繁琐,COGS约为每克 20,000-50,000 美元,具体取决于序列复杂性。这部分是由于为小规模生产建立细胞系和工艺的成本。在产能不足的市场上,它们的售价约为 100,000 至 300,000 美元,该市场由 Aldevron 主导(2021 年被 Danaher 以 96 亿美元收购)。由于涉及序列,用于病毒载体的质粒 DNA (GMP 或“高质量”/“GMP 源”)的合成也非常复杂,这可能导致批次失败,并降低产量。通过放大发酵和下游工艺,更大规模的生产可以更具成本效益。一个 2,000 L 的发酵罐通常可以产生数千克的 DNA。事实上,Zydus(印度Ahmedabad)基于 pDNA 的 ZyCovD 分三剂,每剂 2 mg,售价 265 卢比(3.42 美元),COGS不会高于每克 1,000 美元。另一家 DNA 生产商 TouchLight Genetics 正在开发一种用于水产养殖的 DNA 疫苗,这表明尽管与细菌发酵相比规模经济不太明显,但其体内方法应该在规模上具有竞争力。因此,尽管目前产能紧张、价格高且交货期长,但我们发现 DNA 成本在未来不应成为大规模的大问题。成本和利润的分配将取决于治疗开发商的供应和生产链,他们可以在内部完成所有事情,包括 DNA,或者使用 CDMO,他们自己可以将质粒 DNA 等工作分包给另一层面的专业 CMO。我们也没有预见 RNA 的重大 DNA 成本问题,其通过体外转录从 DNA 产生涉及 10-30× 扩增。
AAV
对于 AAV,有研究人员使用Pall 的 iCELLis 系统或悬浮系统计算出 10^14 vg 剂量的优化总成本为 10,000-15,000 美元。对于局部给药的 AAV 适应症,该成本是可以接受的,但全身给药的适应症需要显著降低成本,因为后者将需要大约 15 倍的物料。我们预计这些降低将通过更好的上游和下游生物工艺以及改进的生物学(通过更好的组织靶向以及更高的感染性、以降低剂量需求的工程衣壳)的组合来实现。
自体CAR-T
对于自体 CAR-T,市售产品每次治疗的售价约为 50,0000 美元,据估计,COGS 约为 30,000-10,0000 美元。重要的是,在美国,对于Kymriah,输注后2个月的治疗费用高达65,000美元,与药物生产的成本相当,甚至高达两倍。这些费用包括“白细胞去除术、淋巴细胞耗竭化疗、tisagenlecleucel 输注/给药、住院和重症监护病房 (ICU) 入院、医疗专业人员就诊、实验室检测/程序以及不良事件 (AE) 的管理”。同样,除了工艺改进之外,生物学上更先进的药物可以以更小的剂量给药,副作用更小,而且可能不会导致淋巴细胞耗竭,这也有助于降低成本。值得注意的是,在中国这个最重要的潜在市场,生产和其它处理成本可能会低 2-3 倍。对于自体疗法,每个患者都需要单独生产,因此规模经济远不如放大 AAV 或质粒生产时明显,尽管并非不可能。关于细胞疗法生产的 LV 部分成本,Comisel 等人的研究表明,使用搅拌罐生物反应器 (SUB) 可以将每剂成本降低至约 2,000 美元(2,000 L SUB 生产 5,000 剂)。非病毒替代品则更便宜。






