免疫原性是物质(例如外来和/或潜在危险蛋白质)引起抗原特异性免疫反应的能力。然而,一些免疫反应可能是有害的,例如在自身免疫性疾病和对生物治疗的不良反应中。后一种情况可能损害生物药的安全性和有效性,并且,针对生物成分的、先前存在的免疫力可以阻止患者接受改变生活的治疗,而基因治疗也许是最显著的一种。
基因治疗旨在通过基因替换、添加、抑制或编辑,来靶向遗传性疾病的根本原因。通常,这种治疗是通过病毒载体提供的。目前体内基因递送的标准是腺相关病毒(AAV),该病毒于20世纪60年代在人类中检测到。AAV是应用最广泛的基因治疗载体,原因有几个。它可以转导宿主细胞并显示出稳健的长期转基因表达,但它在很大程度上无法整合到人类基因组中。AAV载体也非常适合对其载荷和衣壳进行基因工程,从而实现选择性趋向性,并提高在广泛的遗传疾病领域获得治疗成功的可能性。
尽管有这些优势,但挑战依然存在。最大的障碍之一是载体免疫原性。当使用高载体剂量时,已经发生了严重的问题,但有时这种剂量对于确保当前一次性治疗模式下的治疗效果又是必要的。给药时,载体由先天免疫受体检测,例如Toll样受体(TLR)。这种激活可引起炎症并触发抗原特异性T和B细胞的适应性免疫反应,产生中和抗体(NAb),从而阻止随后施用该载体。多达40%有可能受益于基因治疗的患者没有资格接受治疗,因为他们先前存在来自自然发生的AAV感染的NAb。此外,T细胞可以识别和消除AAV转导的细胞,降低治疗持久性并引起肝脏炎症。解决先前存在和新的免疫原性障碍对于为有大量未满足需求的患者释放拯救生命的疗法的全部潜力至关重要。
减轻 AAV 免疫原性的当前策略
AAV免疫原性的风险通常随着剂量而增加。即使在每公斤患者体重2×1012病毒基因组(vg)的中等剂量下,B型血友病患者也显示出与衣壳特异性T细胞表观相关的肝酶活性增加。然而,用低剂量的一次性治疗是有风险的。如果剂量太低,治疗将无效,患者接受基因治疗的机会将被浪费。抗 AAV NAb 和响应于 8 × 10^10 vg/kg 至 2 × 10^12 vg/kg 的低至中度载体剂量而形成的交叉反应性抗体可持续长达 15 年。
除一些血友病治疗外,大多数基因疗法的剂量更高,如用于肝脏疾病时为5×10^12 vg/kg或以上,用于神经肌肉疾病时为10^14 vg/kg或以上。1-3 ×10^14 vg/kg的剂量代表了巨大的衣壳负担。相比之下,成年人平均有大约370亿个细胞。因此,高载体剂量可导致肝毒性、血栓性微血管病 (TMA) 和其它不良及潜在致命事件。在应对潜在免疫反应的同时,施用有效剂量,需要基因治疗开发商进行微妙的平衡。
多个研究小组正在设计AAV衣壳和转基因盒,以提高转导效率,目标是降低载体剂量。可以对启动子和增强子进行修饰,以获得更大的效力,密码子优化可以帮助改善转基因表达。但是,这种方法也有其自身的风险。强效启动子和/或增强子与小鼠模型中肿瘤发生的风险增加有关。
转基因可以被设计成更大的活性。例如,基于人凝血因子IX的自然变体(称为Padua变体)的血友病治疗已被证明在相对较低的转基因表达水平下是有效的。然而,工程转基因也可以引发免疫反应,这可能会影响治疗效果和持久性。
AAV衣壳可以进行基因改造,以增强趋向性,提高转导效率,并降低免疫原性。实现后一个目标的一种方法是引入位点定向突变,以最大限度地减少抗体与衣壳表位的结合。AAV衣壳的定向进化可用于选择具有逃避抗AAV抗体能力的病毒。对免疫系统如何响应AAV的更多了解已经在指导衣壳工程。随着这些知识的增长,衣壳设计将得到进一步改善。
免疫抑制剂(如皮质类固醇)是预防与高载体剂量相关的强免疫反应的其它工具。临床试验产生了不同的结果,一些研究表明,免疫抑制剂的共同使用增强了转基因保留,而其它研究显示没有这种效果。对非人类灵长类动物(NHP)的研究表明,药物和AAV给药的时机至关重要。然而,即使时间严格控制,免疫抑制剂也会使患者暴露于其它潜在并发症,包括感染风险增加。随着我们对基于AAV的疗法的免疫原性机制的更多了解,广泛的免疫抑制可能会被通过靶向方法来调节对疗法本身的免疫反应所取代。
靶向免疫调节剂
将靶向免疫调节剂与AAV基因疗法一起使用是有希望的策略,目前正在开发多种方案。共同给药可以帮助减轻肝脏炎症,同时增强AAV转导,从而增强治疗的持久性。抑制T细胞反应和NAb形成也可以实现载体再次给药。
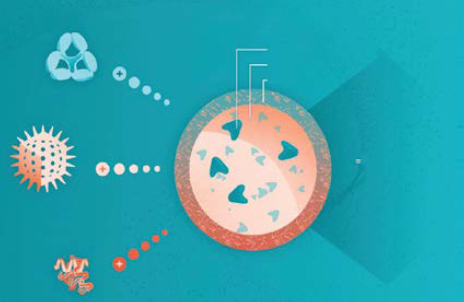
图1:病毒基因疗法 – 以及其它模式 - 与免疫调节剂(如ImmTOR耐受性纳米颗粒)共同给药可以提高治疗安全性和有效性。
一种这样的方法基于ImmTOR纳米颗粒(Selecta Biosciences),其利用雷帕霉素产生抗原特异性免疫耐受性(图1)。纳米颗粒被设计成在静脉内给药后积聚在脾脏和肝脏中。在那里,它们被抗原呈递细胞(APC)吸收,例如树突状细胞(DC),已知它们会触发T细胞的免疫原性和致死性反应。这些颗粒促进诱导致病性DC,其继续激活抗原特异性调节性T细胞。临床前研究已经证明了ImmTOR技术减轻肝脏炎症,增强转基因表达的能力,并通过抑制抗AAV抗体的形成来实现载体重新给药。在临床研究中,纳米颗粒在治疗后长达30天内减轻了针对共同配制的空AAV衣壳的抗AAV抗体的形成。NHP研究表明,每月三次给药的ImmTOR颗粒可以抑制NAb的形成至少90天
另一种方法是给予免疫球蛋白G(IgG)蛋白酶,以靶向去除抗AAV NAb。这种方法对于由于先前存在的抗病毒NAb而无法接受基于AAV的基因治疗的约40%的患者具有特别的希望。IgG蛋白酶是特异性切割人IgG的细菌酶,可能为不合格的患者打开治疗窗口。一种正在开发中的IgG蛋白酶,imlifidase,来自化脓性链球菌,这是一种常见的人类病原体。大多数人已经感染了化脓性链球菌,并且已有针对它的抗体。另一个例子是源自非人类病原体的IdeXork IgG蛋白酶。该酶特异性且有效地切割人IgG,并显示出与人血清的低交叉反应性。
通过结合减轻免疫原性的方法,我们正在将基于AAV的基因疗法的治疗范式从“一次给药即完成”(one and done)转变为“低剂量且慢性治疗”(low and slow)。这种转变可以为有需要的患者释放AAV基因疗法的全部潜力。






