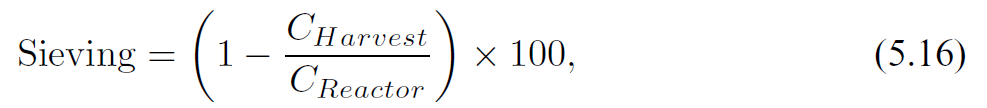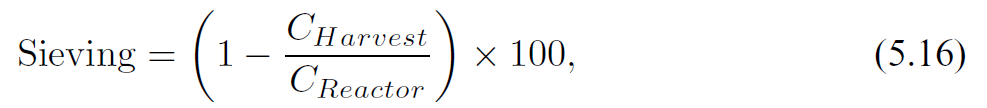细胞截留装置的规模放大
2022-12-06 14:21:30
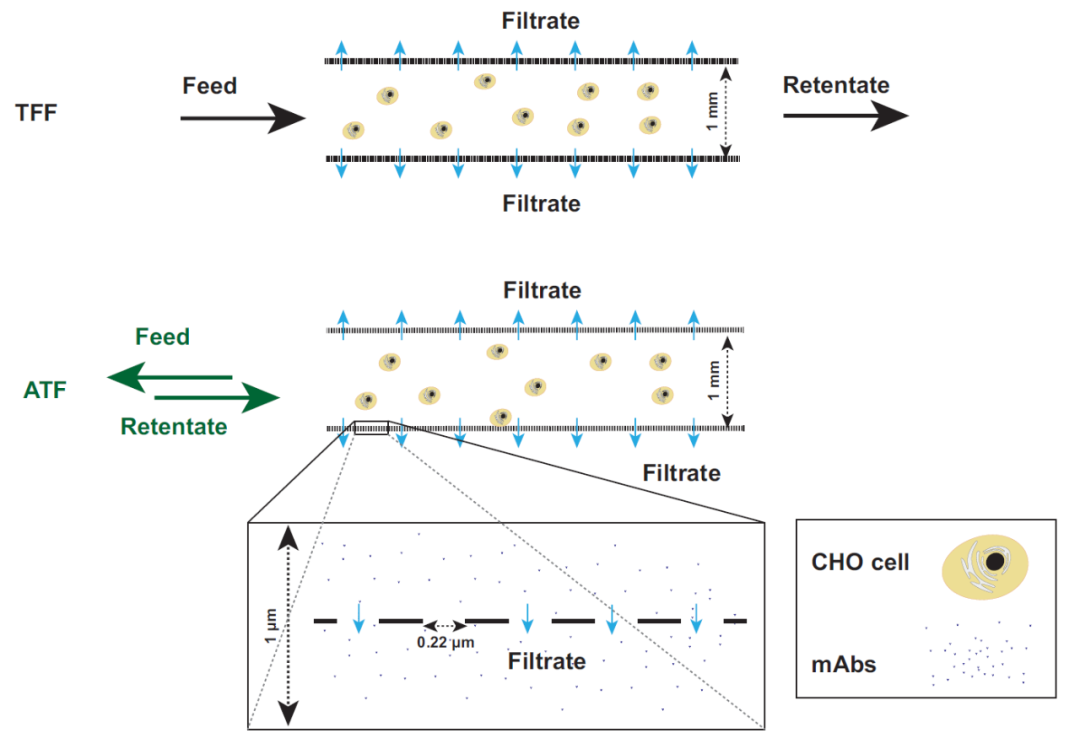
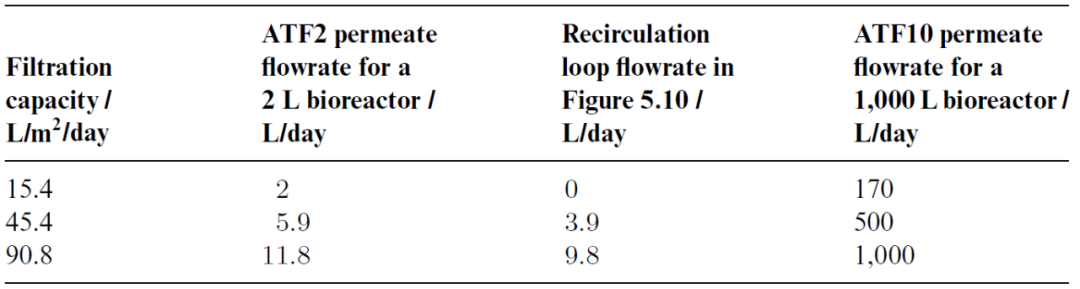
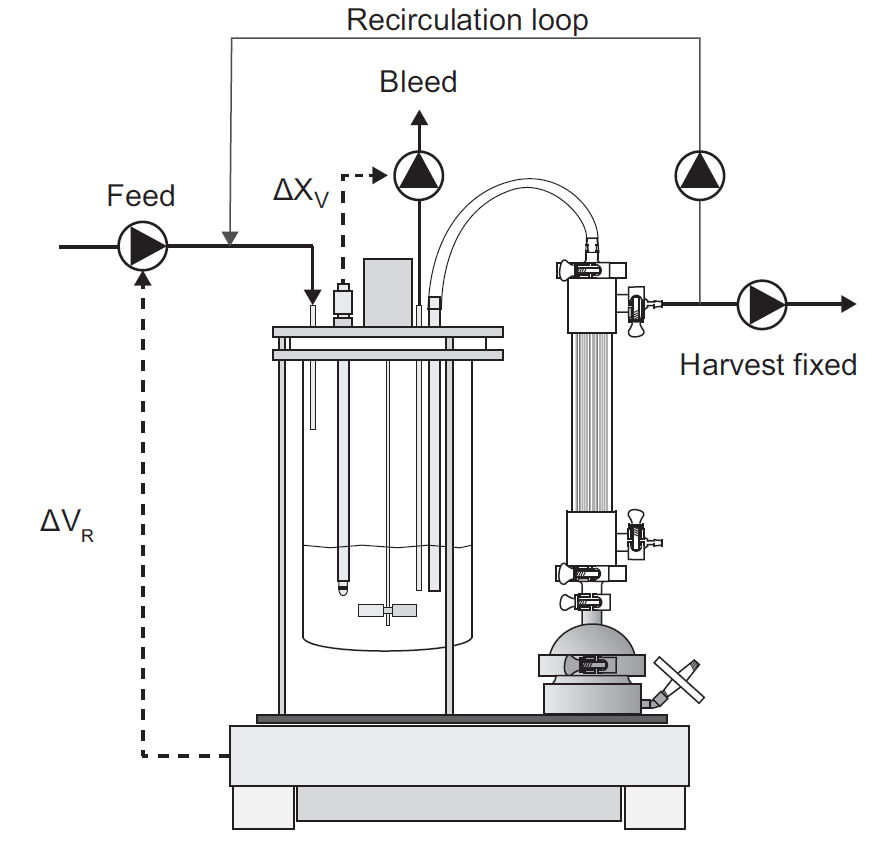
稳健且可放大的细胞截留装置一直是长期限制灌流工艺大规模应用的主要技术难题。今天,主要基于切向过滤的商业化解决方案已可用于实验室和大规模工艺。这是首选的分离技术,因为它可提供完整的细胞截留。此外,主要的技术挑战之一是复杂的混合物(如细胞培养物)导致的膜污染,而切向流可减轻这种不良影响。最近的技术创新主要在于过滤器设计,无论是在其形状还是在其操作模式上。例如,过滤器可以设计为平板膜包或中空纤维,以尽可能提高单位体积的接触表面积。液流循环可以像 TFF 中那样是恒定单向的,也可以是交替使的 - 就像ATF 中那样以恒定频率定期反转其方向(图 5.9)。接下来,我们将讨论这两种过滤技术的一些规模放大注意事项。图 5.9 以TFF 和 ATF 过滤模式运行的中空纤维示意图。过滤器是相同的,但液流方向要么是单向且恒定的 (TFF),要么以规定频率反转方向 (ATF)。蓝色箭头所示的过滤方向垂直于纤维内部的液流。膜表面的放大图将 mAb 的尺寸(假设为 10 nm)与膜孔进行比较。哺乳动物细胞直径通常在 10 - 20 μm之间,此处没有按比例表示。为了将灌流培养从实验室放大到生产规模,必须仔细控制一些关键参数。例如,膜材料和孔径(如聚砜或聚醚砜,孔径 0.22 μm)必须相同。在规模放大时要控制的两个主要参数 -即基本保持恒定 - 是细胞培养物在过滤装置中的停留时间以及以单位膜表面积单位时间滤液体积表示的特异性过滤能力。第一个是由于过滤装置中的环境不受控制,因此氧气和营养物浓度、pH 甚至温度可能会发生变化,而常规控制措施无法干预或纠正这种变化。危险在于会产生一些影响细胞活性的条件,例如溶氧完全耗尽,因此需要控制细胞在过滤装置中的停留时间。第二个参数与膜的过滤能力限制有关,这在灌流培养等高细胞密度下尤其受到挑战。此外,还应考虑过滤回路中细胞所承受的额外剪切应力。表 5.1 配备 ATF2 装置(过滤表面积 0.13 m2)以1 RV/day灌流速率操作的2 L 生物反应器和配备ATF10装置(11 m2)以不同灌流速率操作的1,000 L 生物反应器的比较。第三列报告了图 5.10 中所示具备相同的过滤能力所需的循环回路流速。图 5.10 带有循环回路的灌流生物反应器设置,可在不影响灌流速率的情况下人为地增加通过膜的滤液通量。表 5.1 中描述了如何使用这种通量的示例。商业化 ATF 系统可用于不同的生物反应器规模,从几升到数千升,灌流速率可以 1 RV/day为起始条件而进行调整。可以通过添加过滤单元并并行运行来提高灌流量。每种规模的过滤单元的设计,包括泵头,都是标准化的,制造商通常会提供规模放大的指南。要在商业化规模上实施 ATF,应控制以下参数:过滤能力由单位时间内滤液(收获)体积流量与膜总表面积之比给出。由于 ATF 的标准化设计,这通常在实验室规模上明显过大,因为单位膜表面积的总滤液流量通常非常低。在可代表生产条件的小规模下测试过滤能力的一种选择是使用再循环回路,将多余的收获体积泵回生物反应器而不影响灌流速率,如图 5.10 所示。表 5.1 说明了这一概念的应用,该设置是配备了 ATF2 装置的 2 L 生物反应器,过滤表面积为 0.13 m2,并以 1 RV/day的灌流速率运行。如果我们想再现表格第1列中列出的相同过滤能力值,例如在配备 过滤表面积为 11 m2的ATF10 装置的 1,000 L 生物反应器中,以不同的灌流速率运行(表中的最后1列),我们需要分别应用表第2列和第3列中列出的滤液和外部回路流量。在规模放大之前测试此参数时,应考虑与大规模条件下相同的持续时间以及单位表面积的滤液总量。在稳态下运行的任何几何形状的罐中,平均停留时间可以计算为罐体积与入口(或出口)体积流量之间的比率。对于 ATF,这取决于交替循环频率和体积置换比,此处定义为设备内的置换体积(等于泵头体积(图5.11))与总 ATF 体积之间的比率。该比率通常接近 1,因为泵头体积明显高于中空纤维和连接管(从不为空)的体积,因此占总体积的大部分。相应的,对于 ATF 单元,旨在在跨规模放大期间保持恒定的平均停留时间可由以下公式得出: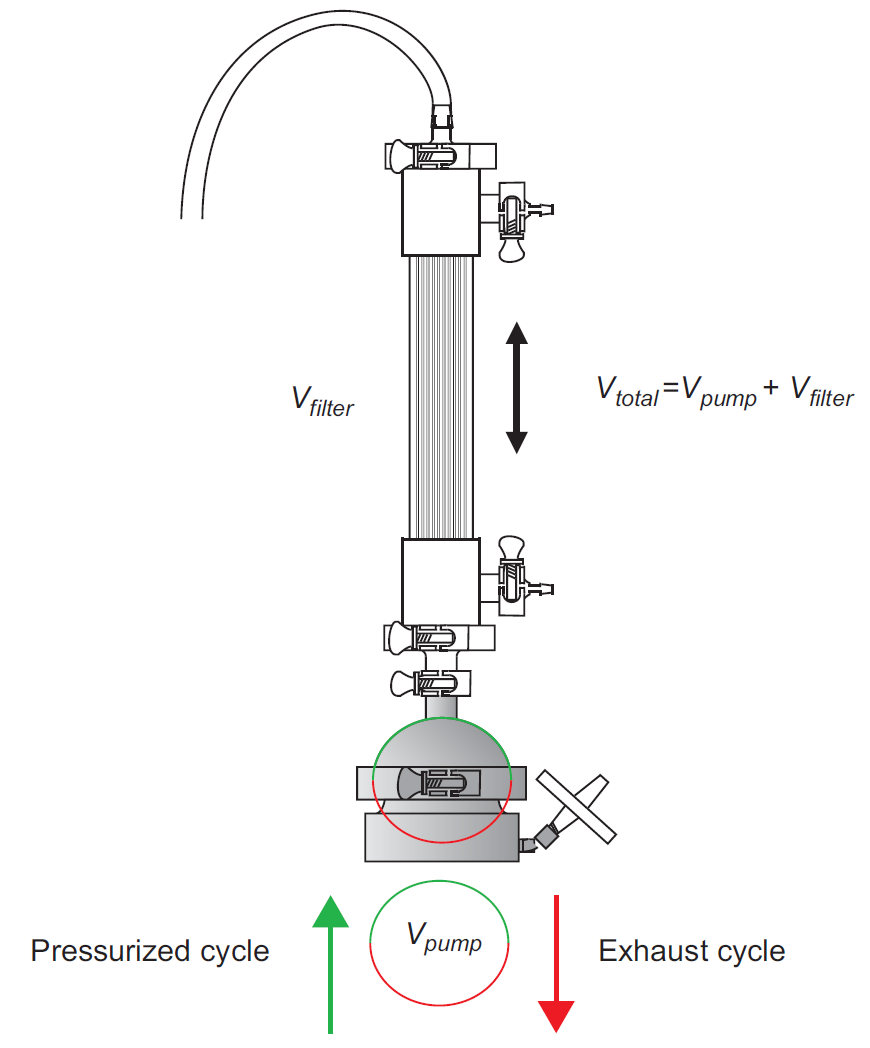
图5.11 实验室规模ATF装置示意图,显示了加压循环 (当液体被推回生物反应器)和排气循环(当液体被吸入过滤装置)期间膜的位置。停留时间的计算考虑了泵的容积与总容积的比值,如式(5.15)所示。剪切应力主要取决于纤维内部的交替流速,应在所有规模条件下保持恒定。当然,这与泵的特异性剪切率有关。在 ATF 装置运行期间,滤液流向可能会改变;这被称为反冲,其中一些滤液回到中空纤维内。这对过滤器操作具有有益的影响,因为它有助于通过减少污染而保持膜的清洁度。滤液流向和流速取决于跨膜压力 (TMP),即中空纤维膜回流和滤液两侧之间的压力差。在正常操作中,压力梯度向滤液侧降低,但当反向时,液流方向会改变,导致反冲。在 ATF 中,由于交替工作模式,回流液在每个循环中不断改变方向和速度,因此,TMP 沿中空纤维随时间变化。ATF中的循环速率越高,最大切向流速越大,TMP梯度也越大,反冲越强。由于 ATF 的设计,如果滤液速率和 ATF 速率之间的比例保持恒定,则反冲是恒定的。因此,图 5.10 所示的外部循环回路也可用于改变 ATF 流速和滤液流速之间的比例,以复制生产条件。该比例与细胞通过截留装置的平均次数成正比,并且不应在不同规模上发生显著变化。这可能是小规模条件下最难模拟的参数,因为它往往非常大。由于对细胞性能来说是最差情况模拟,因此生产规模通常不受此参数的影响。一般来说,对于 ATF 装置的可靠放大,最可取的策略是保持中空纤维的长度不变,同时适当增加纤维的数量。这使得整个过滤组件的压降恒定,而这反过来又意味着恒定的液体流量、恒定的平均停留时间和恒定的剪切应力。另一方面,增加纤维长度(数量不变)会导致更高的背压,从而导致更大的剪切应力。Karst 等人在实验室规模证明了这种效果(2016 年)。商业化TFF 系统配备了一些用于控制循环和收获的装置,可用于实验室规模的生物反应器。在生产规模上,像 Millipore 的 ProstakTM 平板过滤器提供了具有足够过滤表面积的可能性,但没有提供循环系统。必须专门设计一个外部系统,包括所有必要的泵和控制系统来监测和控制循环回路。要在生产规模上实施 TFF,应控制以下参数:该参数应在规模放大之前以与生物反应器设计相同的持续时间和相同的单位表面积滤液量进行小规模测试。平均停留时间可以很容易地计算为过滤回路的总体积与循环单位体积流速之间的比例(图 5.13)。应通过避免循环回路中所有可能的压降源(如阀门、内径变化、管路转弯或其它因素)来尽可能降低剪切应力,从而降低泵必须提供给悬液的能量。在这方面,需要控制泵的类型、其几何形状和施加在悬液上的剪切应力 - 也就是说,在规模变化时保持不变。这是 Bacchin 等人(2006) 描述的经验概念,表明临界滤液流速,超过该流速会发生不可逆的污染,并且设备不能再运行。临界通量对应于系统由于污染而变得不稳定的跨膜压力,如 Raghunath 等人(2013)详细描述的。任何低于此临界值的通量值都不会影响 TMP,并且污染是可逆的。在切向流过滤中,临界通量受切向流速的影响,该速度取决于逐步增加并测量相应的 TMP 值,如图 5.12 所示。TMP 随着时间开始急剧增加时的通量值反映了污染的出现,并被视为临界通量(Bacchin 等人 2006,Beier & Jonsson 2009)。该参数在高灌流速率操作中可能会受到限制,例如在 N-1 应用中通常使用的那些条件。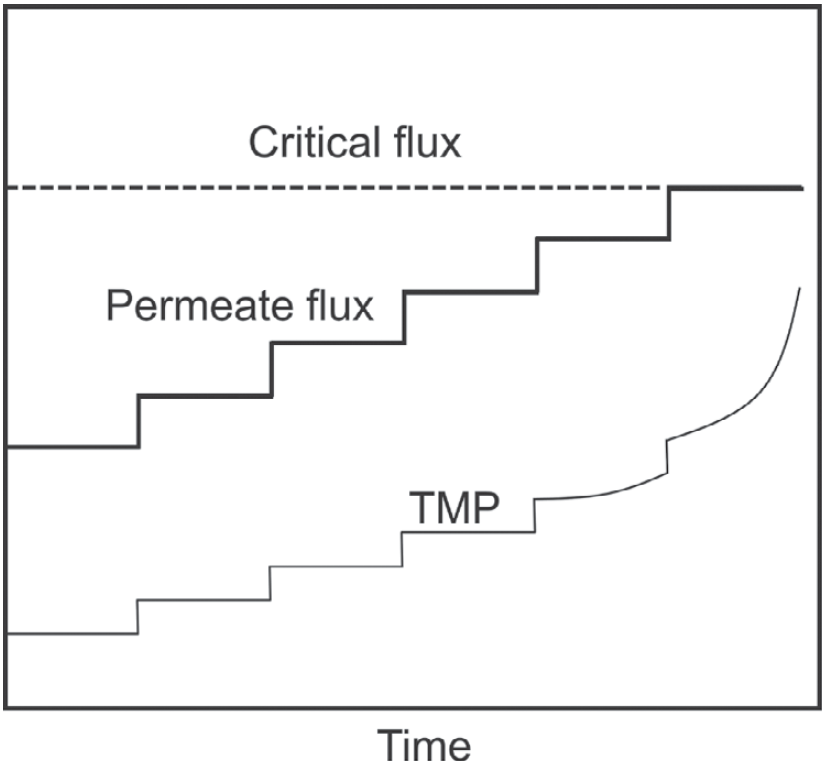
图 5.12 定义临界通量的实验程序。滤液通量逐步增加,并监测相应的 TMP 增加。当 TMP 不再稳定并由于不可逆的污染而剧烈增加时,达到临界通量。该比例代表细胞进入过滤装置的次数,之前介绍的 ATF 单元的相同考虑也适用于TFF。考虑到市场上没有可用的标准设备,TFF 装置的实施可能需要额外的预防措施,以确保前面描述的所有参数都在可行的操作范围内。必须特别注意循环回路的配置,以避免可能影响整个灌流系统性能的不希望的剪切应力或压力梯度。出于同样的原因,与 ATF 对应系统相比,这些系统为特定工艺的设计提供了更大的灵活性。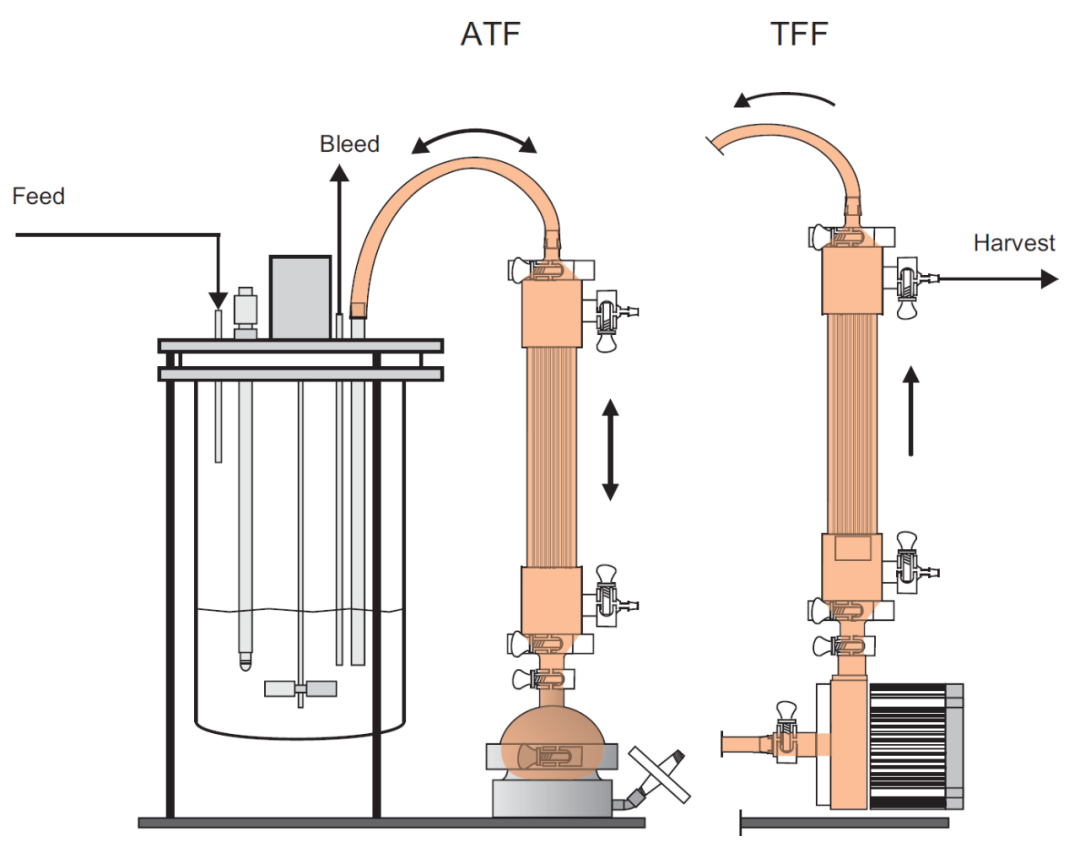
图 5.13 实验室 ATF 和 TFF 过滤组件的示意图:橙色表示在计算平均停留时间时要考虑的体积,在 ATF 的情况下它会发生变化,如图 5.10 所述。对于 TFF,这包括进出生物反应器的所有管路。操作细胞截留装置时可能会出现不同类型的故障,主要是由于待过滤的悬液的复杂性,在灌流生物反应器中,悬液浓度会特别高且粘稠。膜污染和堵塞是主要问题,悬液含有大/小分子、疏水性和亲水性化合物、细胞和细胞碎片等。另一方面,也有可能由于一些传质困难,特别是在存在部分污染的情况下,一些目标蛋白也被截留在反应器内。这种不受欢迎的事件在文献中被称为筛分,量化计算如下: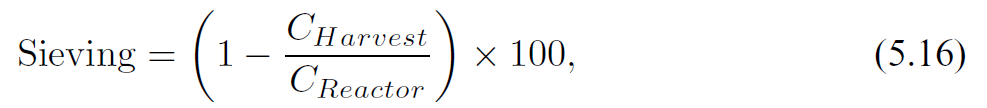
其中,CHARvest 代表收获液中的蛋白质浓度,CReactor代表生物反应器内的蛋白质浓度。如果两者相等,则不发生目的蛋白截留,筛分效应为零。污染和筛分可能是规模放大中的严重问题,导致操作时间或细胞密度受到限制。目前还无法对这些过程进行充分的定量解释,实验报告并不总是连贯的。一般认为,ATF 中的典型交替流动会在过滤膜上产生反冲,有助于防止在较长时间的操作中出现污染。Karst等人(2016) 在类似条件下使用无轴承离心泵对 TFF 和 ATF 装置进行了表征和比较,结果表明使用 TFF 时产物截留率高达 50%,而使用 ATF 时则没有。Clincke等人(2013b) 测试了这两个系统在波浪式培养系统中的局限性,使用 TFF 系统获得的最高细胞密度约为 210 × 106 cells/mL,尽管这种密度无法维持更长时间。而使用 ATF,达到的最高细胞密度仅为 130 × 106 cells/mL,因为高粘度限制了 ATF 泵的液体置换能力。这里提到的两项研究表明,这两种系统都有不同的优点和局限性,但尚未完全理解。如果在给定工艺的较长操作过程中无法防止污染或筛分,可以连接多个过滤单元以并行使用它们或在必要时作为备用。这些策略确实是可行的,但必须注意不要增加污染风险。第 5.8 节中介绍的一次性预灭菌设备提供了一个有趣的替代方案。原文:Perfusion Cell Culture Processes for Biopharmaceuticals Process Development, Design, and Scale-up , pp. 100 - 137