来源:倚锋资本
分子胶和PROTAC日渐成熟、LYTAC等新技术层出不穷,蛋白降解技术为新药研发提供了不同于传统小分子抑制剂的新思路。随着PROTAC头部公司Arvinas进入关键临床阶段,越来越多的目光聚集到蛋白降解这个充满潜力的领域。
目前,针对蛋白降解的技术路径众多,但大多处于早期开发阶段。通过降解特定蛋白将过往“不可成药”的靶点重新开发,新兴的蛋白降解技术究竟是点石成金还是空中楼阁?
倚锋资本将通过盘点各类蛋白降解路径、梳理行业发展历程,带大家一览蛋白降解行业的前沿进展和关注重点。
蛋白质是复杂的生物大分子,根据DNA携带的遗传信息编码合成。蛋白质是生物体中的必要组成部分,细胞产生数以万计不同的蛋白质,这些蛋白质负责在生命活动中发挥结构、调节、功能等不同的作用。
在健康的细胞中,特定数量的蛋白质在特定的时间以特定的方式折叠,形成特定的三维复合结构发挥作用。但这种平衡可能被各种打破——细胞压力、基因突变、转录或翻译错误等事件会导致蛋白质在细胞的过表达、生产速度异常、折叠错误或突变,当蛋白质过表达或突变时,就会导致各类疾病。
近年,基因组学的进展陆续发现了特定蛋白质在与众多疾病的发生有关。例如,雄性激素受体(AR)的过度表达与前列腺癌相关;雌激素受体(ER)的过度表达与乳腺癌相关;错误折叠或聚集的蛋白质在大脑中异常沉积与神经退行性疾病相关;Tau蛋白在神经内聚集与阿尔兹海默症相关……
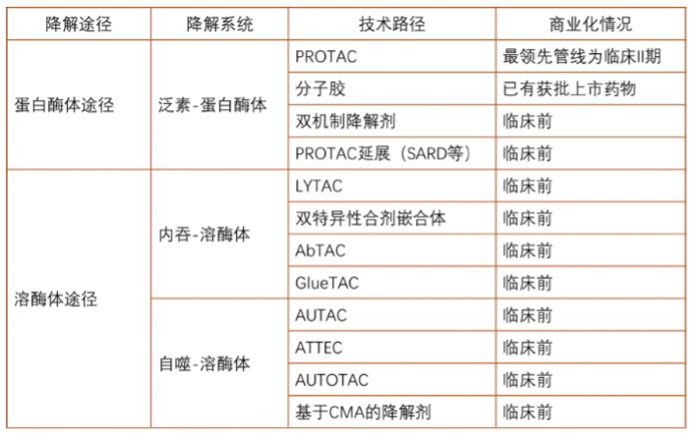
通常情况下,当人体内出现了不被需要的异常蛋白质——发生错误或完成了使命,它们就会被降解。人体内天然存在两大蛋白降解(Targeted Protein Degration,TPD)途径:1)蛋白酶体途径,2)溶酶体途径。在过去20多年中,我们见证了蛋白酶体降解途径的诞生和繁荣,尤其是分子胶和PROTAC技术发展最快。在过去5年中,溶酶体降解途径出现了很多新的技术并以飞快的速度发展,包括LYTAC、GlueTAC、CHAMP等。
图源:动脉网
1.1 蛋白酶体途径(TPD via Proteasomal)
在典型的泛素-蛋白酶体系统(UPS)中,泛素通过E1-E2-E3酶的级联作用与目标蛋白结合。E1与E2相互作用,并将泛素分子转移到E2。E2与E3结合的底物相互作用,将泛素分子转移到底物上。这些过程的重复导致底物的多泛素化,底物随后被26S蛋白体降解。由于E3连接酶负责识别底物,其家族数量大大超过E1和E2。
通过泛素-蛋白酶体系统(UPS)的蛋白质降解
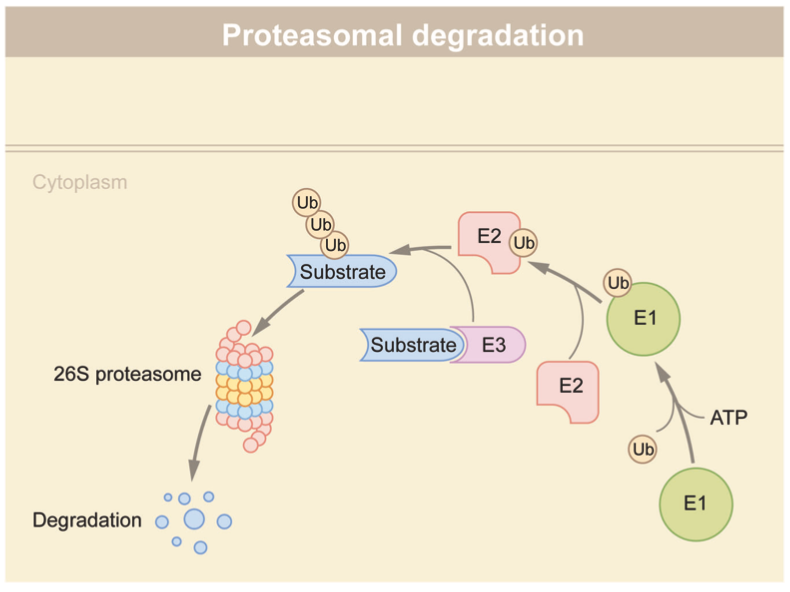
资料来源:Targeted protein degradation: mechanisms, strategies and application
PROTAC及其延展
PROTAC是一类双功能分子,一端是结合靶蛋白(Protein of Interest,POI)的配体,另一端是结合泛素连接酶E3的配体,两个配体通过柔性连接子(linker)相连。PROTAC分子进入细胞后,一端结合靶蛋白,另一端结合泛素连接酶E3,形成POI-PROTAC-E3三元复合物。该三元复合物能够进一步促进泛素蛋白从E3连接酶复合物转移至目标蛋白的表面,随后产生多泛素化作用,使目标蛋白降解。POI-PROTAC-E3的三个部分能够互相排列组合,具备多种可能性,可以通过建立PROTAC库进行结构设计,但设计难度较大。
近年还出现了许多基于PROTAC的技术,包括选择性雄激素受体降解器(SARD)、TF-PROTAC、Daul-PROTAC、选择性雌激素受体降解器(SERD)……
代表公司:Arvinas,Amphista,Kymera,Dunad
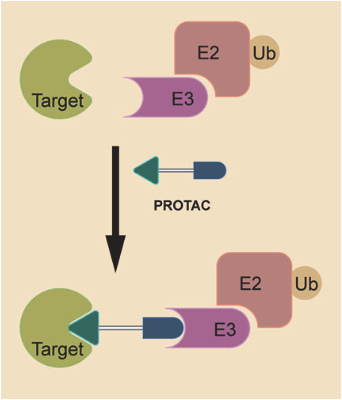
资料来源:Targeted protein degradation: mechanisms, strategies and application
分子胶
分子胶是一类诱导接近的小分子,可以诱导泛素连接酶E3与POI之间的相互作用,从而达到诱导靶蛋白泛素化降解的目的。分子胶可以调节各种生物过程,如转录、染色质调节、蛋白质折叠、定位和降解。沙利度胺类抗癌药物是分子胶的典型代表,这类药物可以重定向E3泛素连接酶CRBN,从而使转录因子IKZF1和IK ZF3等多聚泛素化并被降解。
相对于PROTACs来说,分子胶的分子量较小、化学结构简单、细胞渗透性高,因此具备更好的成药性和口服生物利用度。但是,目前已经发现的分子胶都是基于偶然,分子胶的设计需要基于广泛的理化研究,尚缺乏系统的设计策略。
沙利度胺1998年上市,2008年销售额5亿美金,用于治疗多发性骨髓瘤、全身性红斑狼疮等。来那度胺2005年上市,2020年销售额121亿美金,用于治疗多发性骨髓瘤。泊马度胺2013年上市,2020年销售额30亿美金,用于治疗多发性骨髓瘤。
代表公司:C4,Monte Rosa,标新生物
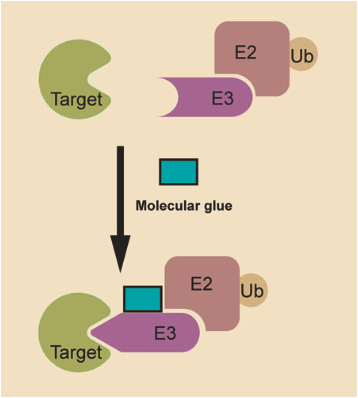
资料来源:Targeted protein degradation: mechanisms, strategies and application
双机制降解剂
治疗复杂的疾病通常需要针对多个靶点。有研究报道了一种双机制降解小分子GBD-9,能够同时靶向BTK酪氨酸激酶和翻译终止因子GSPT1。GBD-9拥有PROTAC和分子胶的双重特征,可以通过调节linker的长度来平衡PROTAC和分子胶的活性。GBD-9已经在多种肿瘤细胞系中显示出优越的抗增殖作用,期待进一步研究。
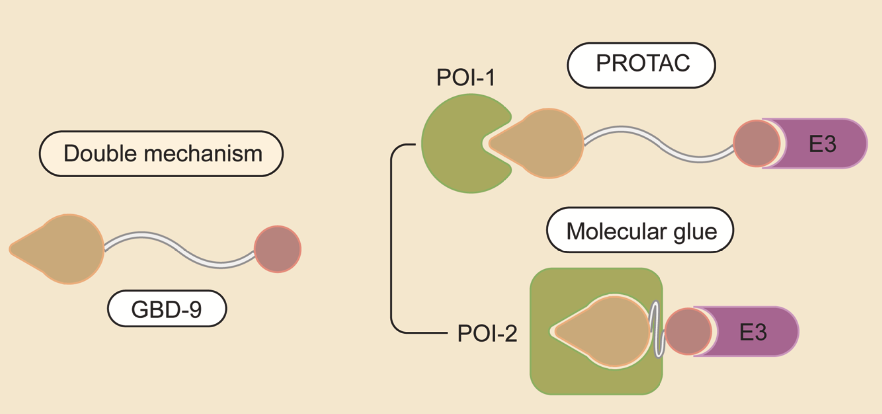
资料来源:Targeted protein degradation: mechanisms, strategies and application
1.2 溶酶体途径(TPD via Lysosomal)
蛋白质通过三种不同的溶酶体途径进行降解,(1)内吞作用:细胞表面蛋白经过内吞作用到达内体。它们可以被溶酶体降解,或被运送到质膜或其他细胞器进行回收。(2)吞噬作用:细胞吞噬大的细胞外颗粒,如入侵的病原体和死细胞,然后由溶酶体降解。(3)自噬作用:错误折叠或聚集的蛋白质、受损的细胞器和细胞内病原体,由自噬-溶酶体途径清除。有三种不同形式的自噬:巨自噬、微自噬和伴侣介导的自噬(CMA)。巨自噬过程中,自噬体的双膜囊泡将受损的蛋白质/细胞器传递至溶酶体进行降解,通常文献中提到的自噬指的是巨自噬。微自噬也通过囊泡将物质输送到溶酶体,溶酶体膜内陷,降解方式直接。伴侣介导的自噬不使用囊泡,这种自噬方式具有高度选择性。
随着对内吞-溶酶体和自噬体-溶酶体降解途径的深入研究,近年来出现了一些通过溶酶体途径的蛋白降解策略。基于蛋白酶体途径的蛋白降解主要降解某些细胞内的异常蛋白,而基于溶酶体途径的蛋白降解可以清除受损的多余细胞器、膜结合蛋白以及胞外蛋白,可能拥有更广泛的应用前景。
通过溶酶体系统的蛋白质降解
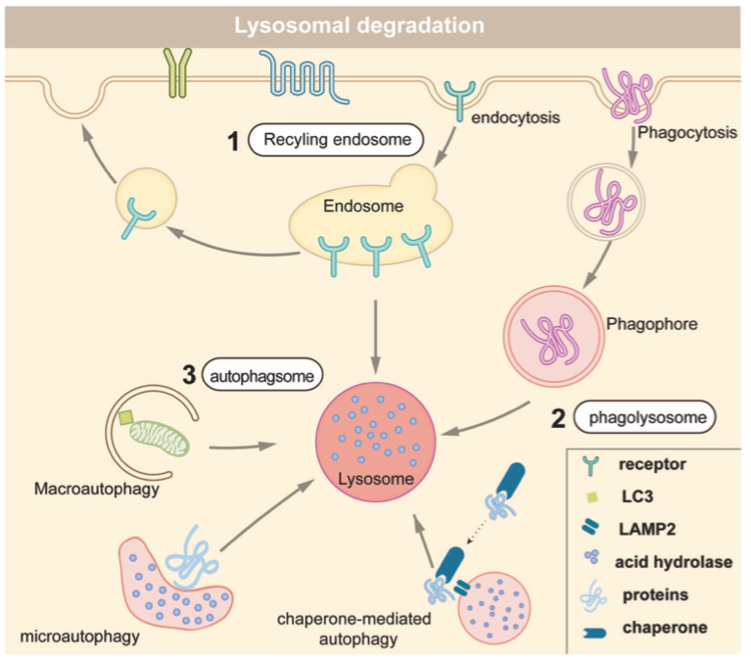
资料来源:Targeted protein degradation: mechanisms, strategies and application
溶酶体依赖的蛋白质降解策略汇总
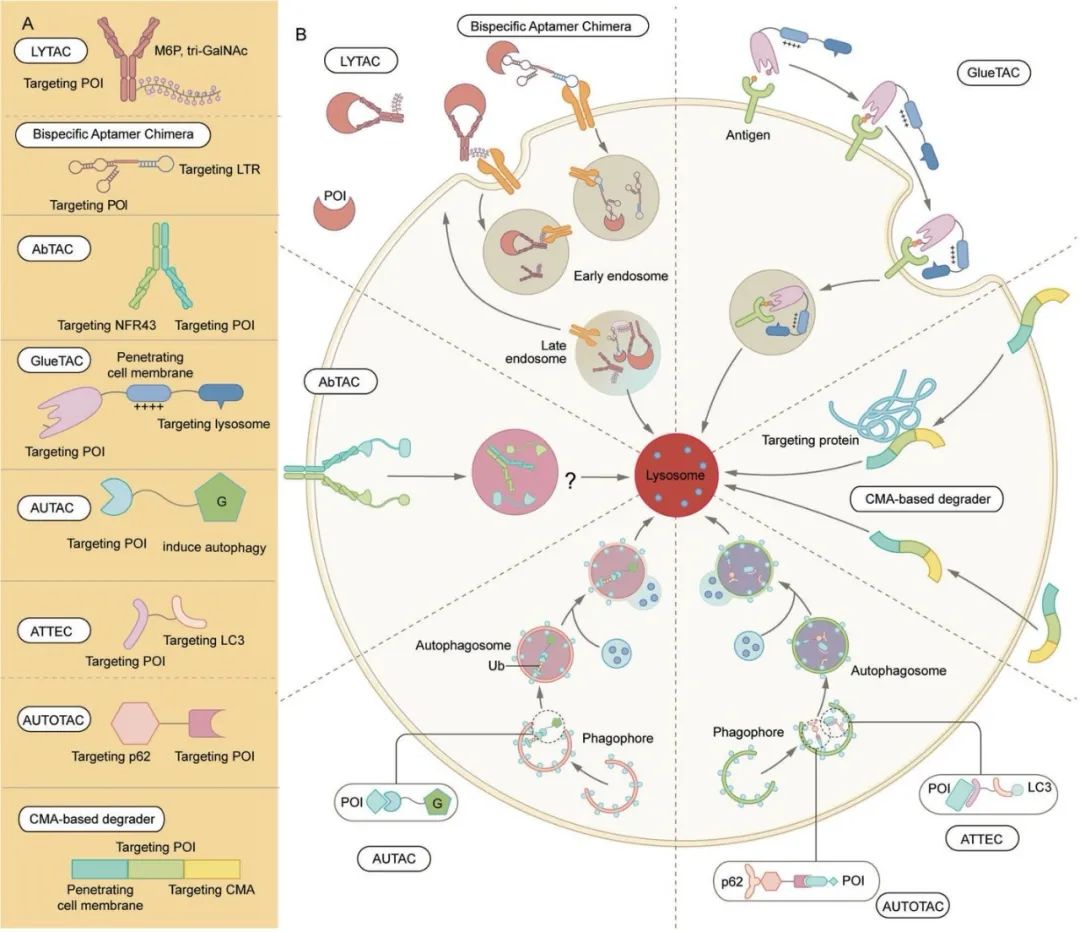
资料来源:Targeted protein degradation: mechanisms, strategies and application
LYTAC及类似技术
LYTAC是一类双功能分子,一端是结合POI的小分子或抗体,另一端是结合溶酶体靶向受体(LTR)的配体,这两个结合域通过linker连接。在质膜上形成的LTR–LYTAC–POI三元复合物会被细胞膜“吞没”,形成一个运输囊泡。囊泡会将复合物运输到溶酶体中,靶蛋白被降解。
LYTAC及类似技术的LTR目前只包括CI-MPR(细胞表面跨膜受体CI-M6PR,在多种细胞中广泛表达)和ASGPR(去唾液酸糖蛋白受体,一种肝脏特异性LTR),随着LYTAC技术逐渐崭露头角,有必要寻找更多新的LTR。
相比PROTAC降解细胞内蛋白,LYTAC主要用于降解胞外和膜结合蛋白(约占编码蛋白的40%)。由于很多治疗靶点(如生长因子、疾病相关受体、细胞因子)其实属于胞外分泌蛋白和膜相关蛋白,LYTAC技术作为能够扩大可降解蛋白质范围的有效工具,成为PROTAC的补充,治疗前景非常令人期待。
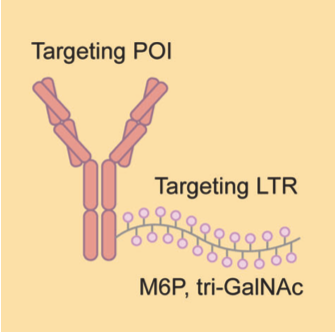
资料来源:Targeted protein degradation: mechanisms, strategies and application
双特异性合剂嵌合体
与LYTAC有些相似,双特异性合剂嵌合体利用DNA适配体来靶向POI和LTR。第一个双特异性合剂嵌合体名为A1-L-A2,其中A1和A2特异性的与LTR(CI-MPR)和POI结合,由linker DNA连接。双特异性合剂嵌合体可以将膜蛋白载到溶酶体中进行降解。
相比于LYTAC采用小分子或抗体,核酸诱导体制备更简单、合成更精确、稳定性也更高,具备一定的优势。
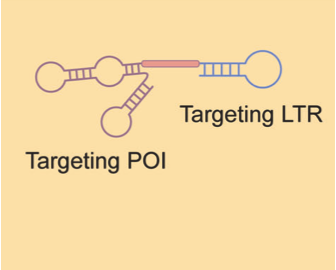
资料来源:Targeted protein degradation: mechanisms, strategies and application
AbTAC
AbTAC(Antibody-based PROTAC)是一种基于抗体的PROTAC,利用重组双特异性抗体一臂靶向细胞表面的POI,另一臂靶向膜蛋白结合E3连接酶(例如RNF43)。虽然与PROTAC同名,但实际上AbTAC与LYTAC的关系更为密切。AbTAC分子招募膜蛋白和膜蛋白结合E3连接酶,形成复合物,通过内吞-溶酶体途径诱导膜蛋白和细胞外蛋白降解。
但是,AbTAC的作用机制尚不清楚,尤其是POI的细胞内区域是否在内吞前就已经泛素化尚不清晰。此外,RNF43是否能像CI-MPR和ASGPR一样被回收、重新利用尚不清楚。
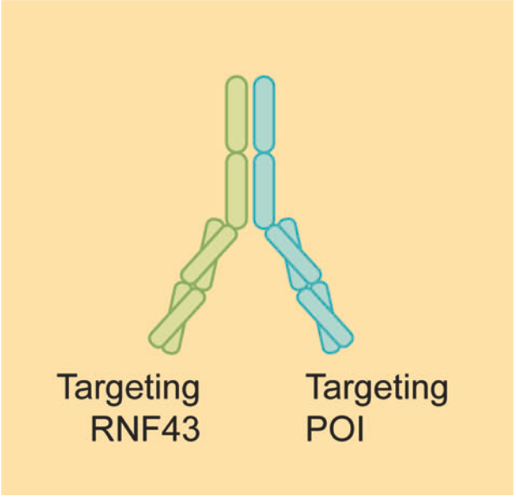
资料来源:Targeted protein degradation: mechanisms, strategies and application
GluTAC
GlueTAC利用溶酶体分拣序列(LSS)促进溶酶体降解,主要通过三种技术降解细胞表面蛋白,1)采用纳米抗体取代传统抗体,以促进细胞渗透,2)在纳米抗体和抗原之间引入共价相互作用,以克服相对较低的结合亲和力,尽量减少脱靶效应,3)使细胞穿透肽和溶酶体分拣序列(CPP-LSS)与纳米抗体结合,促进内吞-溶酶体降解。有研究开发了针对PD-L1的GlueTAC分子,该分子与FDA批准的针对PD-L1的抗体Atezolizumab相比,能更有效地降低细胞中的PD-L1水平并抑制免疫缺陷小鼠的肿瘤生长。
GlueTAC的前景令人期待,但也面临一些挑战,1)安全性:在纳米抗体中引入了非自然的氨基酸,并在纳米抗体和抗原之间形成共价键,2)纳米抗体没有重链,不能与FcRn结合,需要确定半衰期。
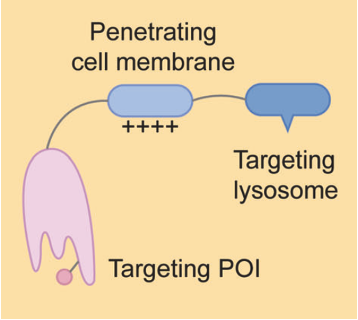
资料来源:Targeted protein degradation: mechanisms, strategies and application
AUTAC
AUTAC分子由三部分组成:一个基于环磷酸鸟苷(cGMP)的降解标签、一个用于结合POI或细胞器的小分子配体、一个linker。Nucleotide 8-nitro-cGMP是细胞中介导自噬体的重要信号分子。不同于PROTAC分子诱导K48链接的多聚泛素和蛋白酶体系统介导的降解,AUTAC分子触发K63链接的多聚泛素和自噬-溶酶体系统介导的降解。
除了细胞质蛋白,细胞器如线粒体也可以通过AUTAC降解,去除功能受损的细胞器可能改善某些疾病,但还需要进一步的研究和验证。
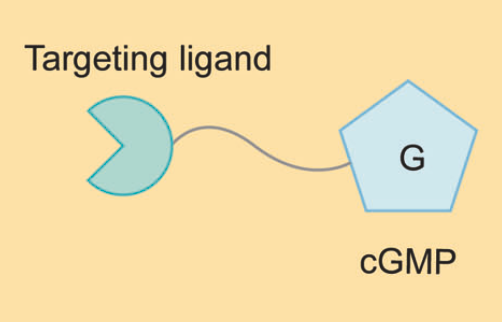
资料来源:Targeted protein degradation: mechanisms, strategies and application
ATTEC
ATTEC分子一端与自噬过程中的关键蛋白LC3结合,另一端与POI结合,从而将POI拴在自噬体上,通过自噬-溶酶体系统进行降解。已有研究发现,ATTEC分子可以识别突变的亨廷顿蛋白(可能是通过识别突变体蛋白中扩展的多谷氨酰胺的构象,将其与野生型蛋白区分开来),为治疗亨廷顿病及其他类似的多基因疾病提供了新的可能性。
除了更广泛的致病蛋白,ATTEC还可以降解脂滴、病原体等非蛋白大分子物质,突破了靶向降解技术的适用范围,将开启更广阔的应用。
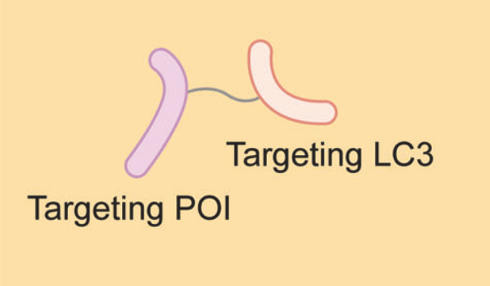
资料来源:Targeted protein degradation: mechanisms, strategies and application
AUTOTAC
AUTOTAC分子一端与POI结合,另一端通过自噬靶标配体(ATL)与自噬运载配体(p62)结合,通过linker链接,形成三元复合物并通过构象变化将无活性的p62激活为自噬相融形式,从而使POI通过自噬-溶酶体系统降解。
AUTOTAC不仅可以介导单体蛋白的靶向降解,还以介导易聚集蛋白的定向降解。此外,AUTOTAC还可以特异性地降解错误折叠的突变体蛋白,不需要靶蛋白的泛素化,也不需要p62介导的对靶蛋白上泛素链的识别以使其持续降解。不同于PROTAC中E3连接酶与底物严格的特异性,AUTOTAC采用的p62兼容性更强,对于linker的长度也没有严格的要求,普适性可能比PROTAC更强。
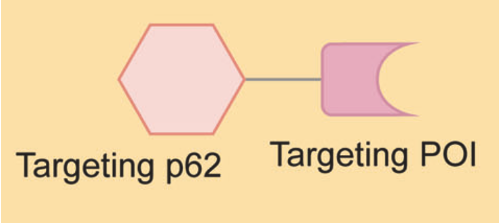
资料来源:Targeted protein degradation: mechanisms, strategies and application
基于CMA的降解剂
基于伴侣蛋白介导的自噬(chaperone-mediated autophagy ,CMA)的降解剂由三个部分组成:一端是细胞膜穿透肽,一端与POI结合,另一端靶向CMA。在CMA中,POI被伴侣蛋白选择,并直接转位穿过溶酶体膜进行降解(不需要形成自噬体)。
伴侣蛋白参与一半以上的哺乳动物蛋白的折叠,在某些情况下识别错误折叠的蛋白质。伴侣蛋白包含许多不同的家族,如热休克蛋白90(HSP90)家族、HSP60家族、HSP70家族等,每个家族都以不同的方式帮助蛋白质折叠。例如,HSP90可以标记错误折叠的蛋白质并进行降解,防止它们干扰细胞的正常功能,从而促进蛋白质的正确折叠。HSP90通过直接与许多不同的E3泛素连接酶相互作用(E3选择性更强),辅助蛋白质降解完成。
CMA在不同的组织(肝脏、肾脏、大脑)和所研究的几乎所有细胞类型的培养物中都有活性,在调控细胞代谢方面很重要。

资料来源:Targeted protein degradation: mechanisms, strategies and application
2.1 行业发展
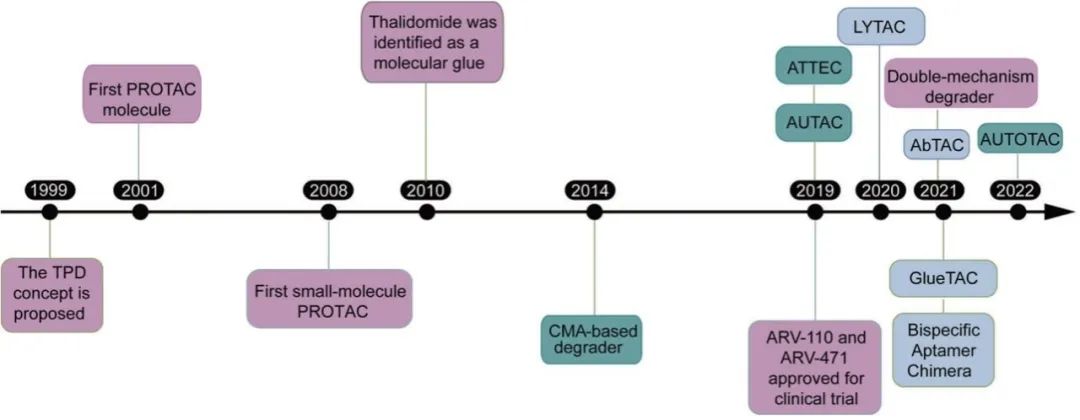
资料来源:Targeted protein degradation: mechanisms, strategies and application
2000年左右,科学家揭示了细胞是如何清理异常蛋白质的,即泛素调节的蛋白质降解过程。此后,该机制开始被用来降解诱发疾病的蛋白。
2001年,来自耶鲁大学的Craig Crews教授课题组首次提出PROTAC概念。
2004年,三位学者因为发现了泛素介导的蛋白质降解被授予诺贝尔化学奖:Aaron Ciechanover(以色列理工学院,以色列)、Avram Hershko(以色列理工学院,以色列)、Irwin Rose(加州大学尔湾分校,美国)。
2008年,Craig Crews教授课题组发布了进一步研究,首个小分子PROTAC就此诞生。
2013 年,Craig Crews 教授创办了 Arvinas,成为PROTAC领域的标杆公司。
2015年,Jay Bradner、Alessio Ciulli 和 Craig Crews 的实验室开发了改进的PROTAC分子 ,蛋白降解技术引起了广泛的注意。
2019年,首个PROTAC分子(ARV-110)进入临床测试,随后ARV-471也批准进入临床,为靶向ER和AR的PROTAC提供了临床概念验证。此后PROTAC领域飞速发展,各类蛋白降解技术遍地开花,多家公司披露了临床前和早期临床项目。
2020 年,浙江大学侯廷军教授课题组建立了首个公开的线上 PROTACs 数据库(PROTAC-DB)。截至 2021 年 4 月,该数据库包含 200 多个靶点,共有 2258 个 PROTACs,275 个蛋白配体,68 个 E3 配体和 1099 个连接子。
2022年,中国发布《“十四五”医药工业发展规划》重点提出PROTAC是关键的创新技术发展方向,将包括PROTAC靶向蛋白降解技术在内的前沿核心技术和药物列为重点发展对象。
早期,PROTAC其实是“生物PROTAC”,是含有E3连接酶的肽配体。α肽的小分子模拟物的发现为完全基于小分子结构的PROTAC的合理设计打开了大门。
随着发展,E3连接酶Cereblon(CRBN)被确定为沙利度胺及其类似物的靶点(免疫调节性亚胺类药物,IMids)。这些药物联合CRBN针对IKAROS家族锌指1(IKZF1)和IKZF3降解,现在被认为是分子胶的先驱。
目前,PROTAC已经发展到完全合成的、设计合理的小分子。人类基因组包括 E1 酶家族的两个成员,大约 40 个 E2 ,已知的E3连接酶有632种,但被开发应用的仅有不足20种,公开上临床的以CRBN和VHL为主,常用的还包括MDM2、IAP、DCAF15、DCAF16、RNF114。
随着技术的不断发展,靶向蛋白降解作为一种治疗性小分子范型具有广阔的应用前景。
2.2 标杆企业 - Arvinas
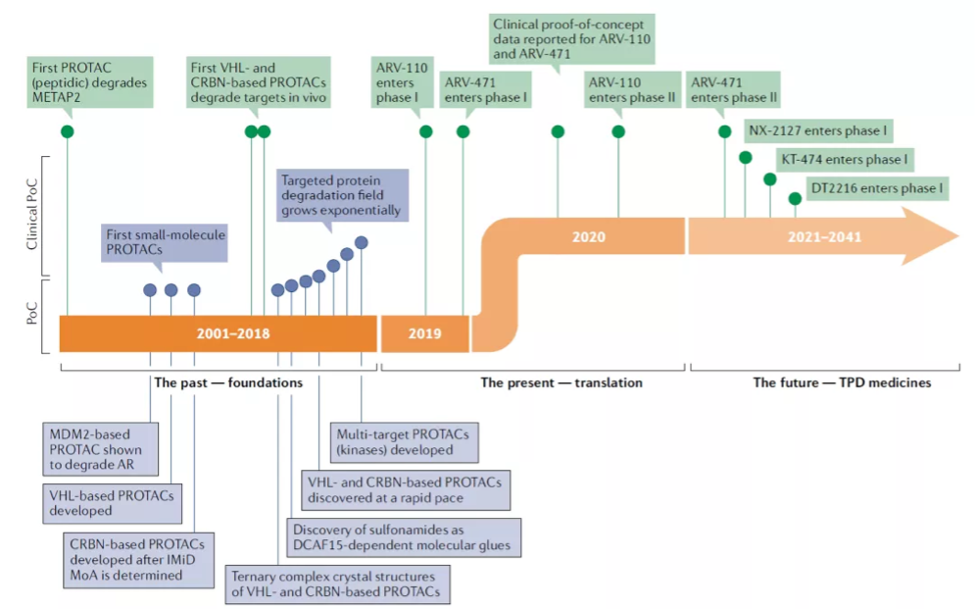
PROTAC发展时间线
资料来源:PROTAC targeted protein degraders: the past is prologue
Arvinas 2018年上市时点管线进展

资料来源:Arvinas Form S-1
Arvinas 2021年年末时点管线进展
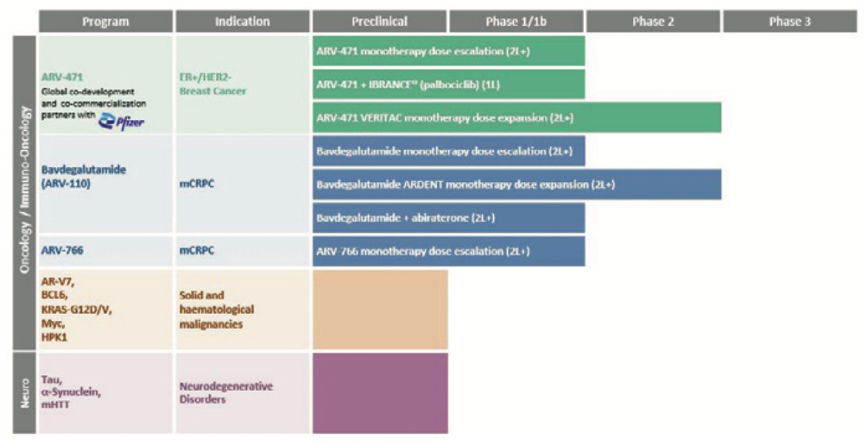
展资料来源:Arvinas 2021 Annual Report
创始人Craig Crews在2001年首次提出了PROTAC的概念,并于2013年成立了Arvinas。2019年首个PROTAC分子ARV-110进入临床测试,随后ARV-471也批准进入临床,为靶向ER和AR的PROTAC提供了临床概念验证,自此成为行业标杆。目前,ARV-110已经完成I/II期临床研究,结果良好,2022年底计划开启III期临床;ARV-471正处于临床II期研究。
Arvinas在2018年9月于纳斯达克上市,市值约8亿美金。Arvinas,以及C4、Kymera、Nutrix四家蛋白降解领域头部公司,上市时点均无临床资产。截止到2022年7月,Arvinas的市值大约在26.5亿美金。根据Arvinas 2021年年报,公司自成立以来尚未盈利,目前营收主要通过研究合作和许可协议产生,且未来几年预计也将通过该途径获得收入。截至2021年、2020年和2019年12月31日的年度,净亏损总额为1.91亿美元,1.193亿美元和7030万美元。
作为蛋白降解的标杆企业,Arvinas在设计、优化和开发PROTAC靶向蛋白降解剂时关注以下关键特征:有效性、选择性、可递送性和多元性。Arvinas已经利用这些关键特征成功地靶向和降解了广泛的蛋白质类别,包括核蛋白、转录因子、表观遗传调节剂、膜蛋白、细胞膜蛋白和高分子量神经蛋白聚集物等。
有效性
1)反复诱导:Arvinas的PROTAC能够反复诱导蛋白质的泛素化和后续降解,因此所需浓度远低于传统小分子抑制剂,甚至在皮摩尔浓度下就可以观察到蛋白降解。这使PROTAC具有剂量低、药物暴露低、给药间隔短等优势,可能减轻毒性、降低耐受风险。此外,反复诱导机制或许能更完全、持久地使下游信号通路失活,减少旁路或下游通路激活。
2)弱结合,强降解:Arvinas的PROTAC不需要与目标蛋白有高强度的结合,仅通过形成三原复合物、快速泛化、反复诱导降解等动力学因素,就可以实现对目标蛋白的强降解。这与需要跟目标蛋白紧密结合、并通过持续占据蛋白活性位点才能发挥作用的传统小分子抑制剂形成对比。
选择性
被纳入PROTAC的配体选择性比单独的配体对目标蛋白的选择性更高,Arvinas通过最大限度地提高PROTAC对目标蛋白的选择性、减少与非目标蛋白的结合,以此减少脱靶效应和毒性。
可递送性
Arvinas的PROTAC可以通过口服、静脉注射、皮下注射、肝内注射等多种给药途径达到目标蛋白,某些PROTAC还能够穿透血脑屏障。与其他治疗方法(如基因药物)相比,口服给药可提供差异化、竞争性和商业优势,使治疗更加方便。此外,口服给药还能够避免与静脉或肌肉注射有关的不良事件的风险。
多元性
Arvinas的PROTAC尝试验证以往被认为是“不可成药”的蛋白质上的结合位点,通过利用配体结合非功能性的结合位点来降解靶蛋白。由于不需要配体本身的功能,而仅需要结合功能,PROTAC可能筛选出选择性低、亲和力弱或没有内在生物活性的配体用于开发药物。
2.3 商业合作
2015年4月,Arvinas与默沙东达成了4.3亿美元的协议(合作)。
2017年11月,Arvinas与Genetech(Roche)达成了6.5亿美元的合作。
2018年1月,Arvina与Pfizer达成了8.3亿美元的合作。
2018年4月,GSK与Kymera达成了协议(合作)。
2019年1月,Biogen与C4达成协议(合作),预付款4.15亿美元。
2019年6月,Giled与Nurix达成协议(合作),预付款4500万,里程碑费用23亿美元。
2019年6月,Bayer与Arvinas达成协议(合作),预付款1.1亿美元,里程碑付款6.85亿美元。
2019年,Roche与C4合作,共同开发针对癌症和其他适应症的蛋白降解剂产品,并且罗氏有权拥有全球权益,C4除了获得临床开发商业等里程碑收益外,还可以获得净销售额的中个位数到中十位数的分成。合作总价值高达9亿美元。
2020年5月,Roche与Vividion达成协议(许可),预付款1.35亿美元,里程碑费用数十亿。
2020年6月,Roche对与C4的合作做出调整,终止双方针对EGFR的共同开发协议,Roche将该项目的所有权归还C4。11月,消息正式对外披露,C4没有说明合作终止的原因。
2020年10月,C4成功IPO,曾和多家药企达成合作协议,包括与谷歌母公司 Alphabet 旗下的生命科学部门 Calico 共同开发针对癌症及衰老疾病的 PROTAC 产品,以及与 Biogen 共同开发针对神经系统疾病的 PROTAC 产品。
2020年7月,Sanofi与Kymera合作,联合开发针对免疫炎症疾病的蛋白降解剂产品,总价值高达21.5亿美元。
2020年8月,Kymera成功IPO。
2020年11月,Eli Lilly与Seed Therapeutics达成协议(合作&许可)共同研究开发一类通过靶向蛋白降解而发挥治疗作用的新化学实体,预付款1000万美金,里程碑付款7.9亿美金,Eli Lilly还对Seed Therapeutics进行了1000万美元的股权投资。
2021年7月,Pfizer与Arvinas达成协议(合作),共同开发并商业化ER PROTAC ARV-471,Arvinas获得6.5亿美元的预付款 & 高达14亿美元的里程碑付款,Pfizer还对Arvinas进行3.5亿美元的股权投资。
2021年8月,Eli Lilly与Lycia达成协议(许可),里程碑费用16亿美元。
2021年8月,Bayer与Vividion达成协议(并购),股权投资及预付款15亿美元,里程碑费用5亿美元。
2021年11月,Novartis与Dunad达成合作,开发口服生物可利用的共价和蛋白质降解小分子药物。
2021年12月,Pfizer与Ranok达成合作,将Ranok分子伴侣介导的靶向蛋白降解(CHAMP)技术应用于选定的癌症药物靶点(具体靶标未公开)。
2022年5月,BMS和Merck分别与英国生物制药公司Amphista Therapeutics达成12.5亿、10亿美金的合作,都将利用公司专有的Eclipsys平台开发新一代蛋白降解疗法。是继2018年、2021年Pfizer与Arvinas合作之后蛋白降解剂领域的又一次大额合作。
3.1 优势&挑战
优势
1)PROTAC等蛋白降解剂能够靶向支架蛋白等复杂蛋白,大大扩展了“可成药”蛋白的范围;
2)PROTAC能够降解细胞内蛋白,LYTAC、AUTAC等蛋白降解剂能够降解细胞膜蛋白、细胞外蛋白、细胞器等,ATTEC还能够降解非蛋白大分子物质,应用范围广;
3)蛋白降解剂能够清除致病蛋白,从而抑制非酶活功能、彻底消除致病蛋白所有功能,降低耐药性;
4)PROTAC等蛋白降解剂具备一定的催化作用,可以反复诱导降解,在低剂量下就有较好的降解效果,从而降低毒副作用;
5)PROTAC等蛋白降解剂通过配体与靶蛋白稳定结合,提高对目标蛋白的选择性;
6)PROTAC具有传统小分子药物的优势,包括组织分布广泛、给药途径多种、开发途径成熟、生产链条配套等。
挑战
1)蛋白降解剂三联体分子量较大(通常在700-1200Da),不符合小分子药类药五原则,因此限制了其溶解性、药代动力学和生物利用度,透膜性和口服利用度较差;
2)需要对靶点有充分的理解,选择适合降解的靶蛋白,明确靶蛋白在正常细胞中的表达率以及蛋白降解剂对正常组织的毒性;
3)需要明确蛋白降解剂的构效关系、结合位点、作用机制和对靶蛋白的降解率,合理设计、筛选、合成蛋白降解剂;
4)多数蛋白降解技术尚处于临床前阶段,且缺乏高等物种实验数据。
3.2 行业布局
国外
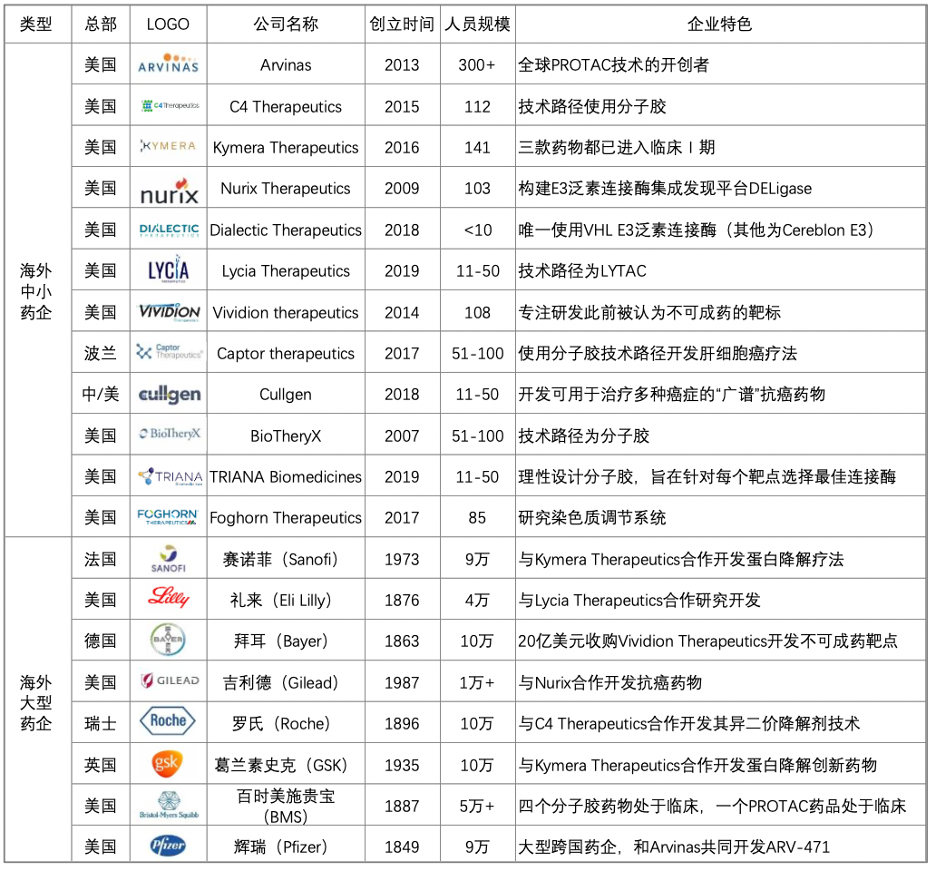
图源:动脉网
国内
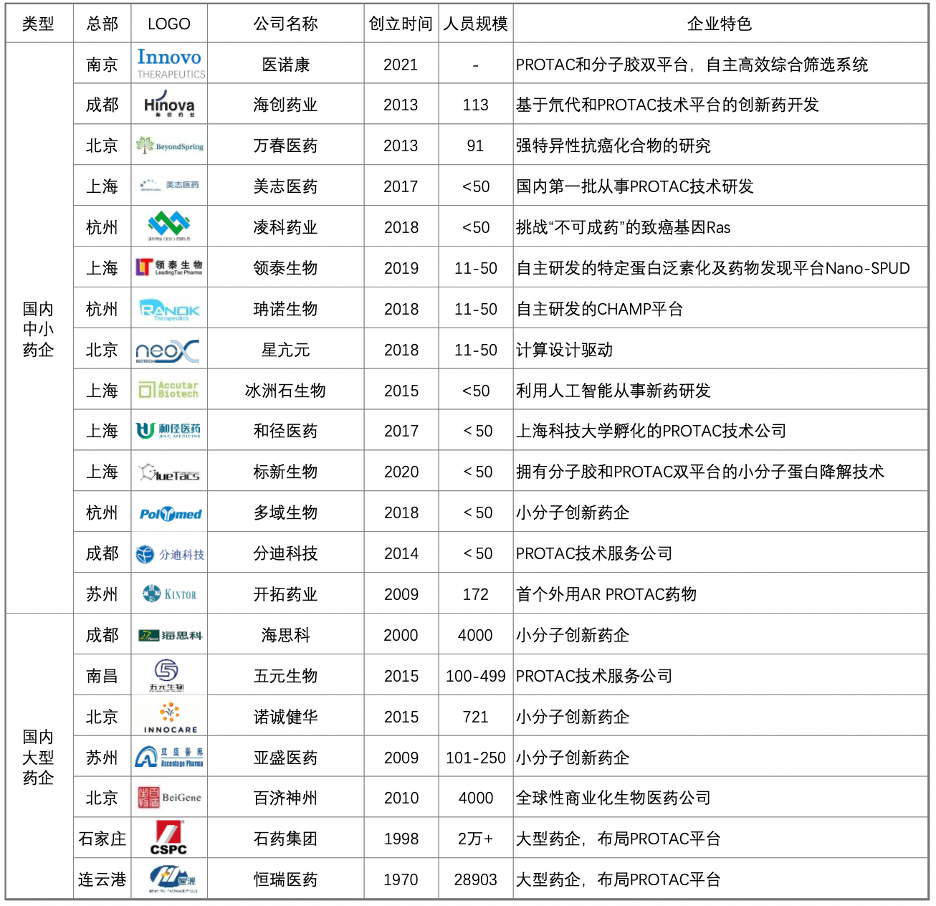
图源:动脉网
3.3 技术平台分析
Arvinas – PROTAC®Discovery Engine
Arvinas基于对蛋白降解近20年的研发经验、技术和知识产权搭建了药物发现平台PROTAC Discover Engine,药物开发主要分为三个阶段:
1)选择E3连接酶并识别配体
目前已知的E3连接酶有超过600种,Arvinas拥有自主专利的E3连接酶库,熟悉各类E3连接酶在肿瘤、中枢神经系统等组织中的分布,在匹配E3连接酶和配体方面有丰富的经验。Arvinas还拥有顶尖的高通量DNA编码库(DEL)筛选能力,能够通过高通量筛选、实验室定向结合、算法虚拟筛选、亲和力验证等方法筛选出新的E3连接酶配体,或者已知能与靶蛋白结合但临床研发受到限制的E3连接酶配体。
2)快速设计合理的PROTAC
PROTAC由靶蛋白(POI)、连接子(linker)、E3连接酶配体三个部分组成,三联体的三个部分能够互相排列组合,具备众多可能性。Arvinas对于POI、linker、E3连接酶配体如何形成三联体有深入的研究,并且能够利用分子结构和生化信息准确预测靶蛋白上能够被标记为泛素的赖氨酸残基。
Linker的选择对于提高PROTAC的功能和选择性都至关重要,能够调节PROTAC的透膜性、水溶性、选择性、代谢稳定性等。Arvinas拥有自主专利的linker库,并且在linker的选择和改进方面也有独特的技术优势(ANGLE)。
Arvinas采用基于三联体结构的计算模型和设计算法,以此来快速地识别有效的三联体。此外,Arvinas还拥有蛋白组学的能力,能够准确地了解靶蛋白的特性,并不断优化PROTAC随遇靶蛋白的选择性。
3)提高PROTAC的成药性
传统的小分子药物发现中常用的优化参数并不适用于PROTAC,Arvinas总结了自主知识产权的PROTAC成药规则,并将其应用于药物开发。基于这些规则,Arvinas研发的PROTAC具有良好的口服生物利用度,有些甚至能穿透血脑屏障。此外,Arvinas对于PROTAC在体内的PK/PD和疗效关系也积累了深入的认知。
Amphista– Eclipsys™
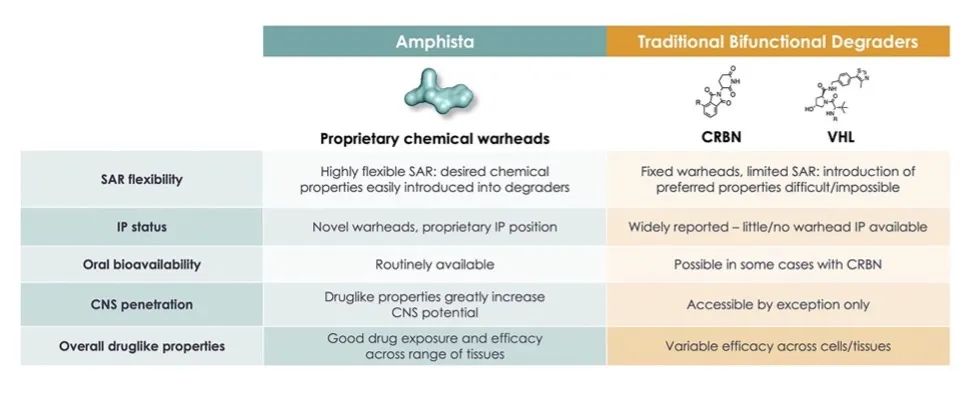
资料来源:Amphista官网
Amphista搭建了自有专利的Eclipsys靶向蛋白降解平台,通该药物发现引擎深入研究蛋白降解的发生机制,突破现有PROTAC的限制并开发新一代的蛋白降解剂,主要关注三个方向:
1)扩大蛋白降解剂的应用范围
Amphista对肿瘤、免疫、中枢神经系统以及其他疾病的发生机制有深入的研究,针对目标疾病设计蛋白降解剂,定向降解细胞核、细胞膜、酶、表观遗传因子等疾病相关的致病蛋白。
2)降低肿瘤耐药性
Amphista关注肿瘤生长所必需的蛋白,这类蛋白的功能改变会影响肿瘤的生长,因此肿瘤不会轻易使其发生突变。通过降解这类肿瘤生长必需的蛋白质,Amphista开发的蛋白降解剂可以更加持久地减少肿瘤抗性、降低耐药性。
3)改善药物特性
Amphista通过自主制定开发策略,形成了更好的成药规则,能够提高蛋白降解药物的组织渗透率、口服生物利用度等特性,还能够使药物进入中枢神经系统,针对各类难治疾病提出了解决方案,并有潜力成为Best-in-Class。
4.1 技术端
适合降解的靶点类型
1)现有技术路径“难以成药”的靶点,如MYC、RAS、STAT3;
2)对现有疗法产生耐药性的靶点,如BTK、TRK;
3)过度表达、聚集、突变的靶点,如AR、ER;
4)传统小分子抑制剂难作用的支架蛋白,如IRAK4、BRD9。
E3连接酶及配体
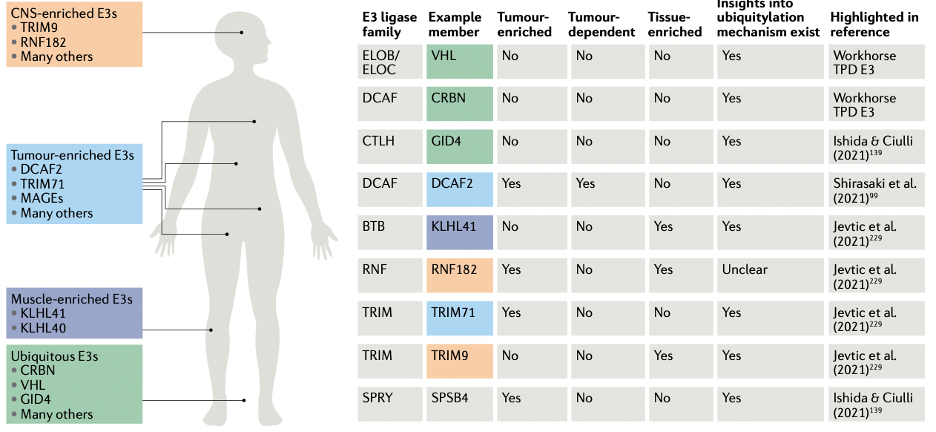
资料来源:PROTAC targeted protein degraders: the past is prologue

图源:动脉网
目前,已知的E3连接酶有超过600种,但被开发应用的仅有不足20种,公开上临床的以CRBN和VHL为主,常用的还包括IAP、MDM2、DCAF15、DCAF16、RNF114。常见E3连接酶的配体通常为小分子抑制剂,研究者会对抑制剂做一定的结构衍生,使用优化后的抑制剂作为配体并申请相关专利。
CRBN:沙利度胺能够与E3连接酶CUL4–RBX1–DDB1–CRBN(CRL4CRBN)的亚基CRBN结合,来那度胺(沙利度胺衍生物)可以诱导降解IKZF1和IKZF3。CRBN主要采用度胺类衍生物作为配体,基于CRBN配体开发的PROTAC成药性较好,因此成为目前最常用的配体。
VHL:VHL是E3连接酶CUL2-RBX1-ElonginB-ElonginC-VHL(CRL2VHL)复合物的一部分,VHL复合物的共晶体结构揭示VHL能与HIF1α中的羟基脯氨酸残基产生相互作用。早期VHL主要采用短肽配体,但肽类固有缺陷会限制PROTAC的进一步应用,因此需要开发非肽类VHL配体,目前常用拟肽化合物。
主流的CRBN和VHL优点明显,但同时也显现出一些问题:
1)两者都属于无组织特异性的E3连接酶,可能导致全身性的脱靶和毒副作用;
2)两者都属于肿瘤生长的非必需蛋白,基于两者的PROTAC小分子药物容易产生耐药。
建立E3连接酶及配体库并扩展该工具库对于高效开发新的E3连接酶和配体至关重要。
口服生物制剂和血脑屏障渗透剂
通过优化蛋白降解剂的化学结构、生物活性、理化性质形成不同于传统小分子抑制剂的成药规则,对于降解能力(DC50、Dmax、Western Blotting…)、结合亲和力(Kd、Ki、IC50、EC50…)、细胞活性(IC50、EC50、GI50、ED50、GR50…)等参数总结规律,以此提高蛋白降解剂的成药性和生物利用度。
肿瘤以外的适应症
除肿瘤以外,适合采用蛋白降解剂治疗的疾病方向主要有炎症免疫、神经疾病和神经退行性疾病、抗病毒。对于疾病发病机制的深入研究和理解、明确关键致病蛋白对于研发针对特定适应症的蛋白降解剂很重要。
分子胶和PROTAC以外的技术路径
除了发展相对成熟的分子胶和PROTAC,新的蛋白降解技术也层出不穷,包括前文提到的PROTAC衍生技术、LYTAC、ATTEC、AUTAC、GlueTAC等。主要关注蛋白降解的路径、作用机制以及靶蛋白的种类,同时关注新技术的临床验证情况。
技术平台和产品的专利布局
基于过往经验形成蛋白降解药物开发原则,并搭建能够高效开发三联体的技术平台格外重要。近年来,cryo-EM分析、计算机辅助设计和AI蛋白质建模等方法快速发展,可以辅助实现蛋白降解剂的快速定向开发。参考Arvinas的PROTAC®Discovery Engine和Amphist的Eclipsys™平台。
4.2 临床端
药代动力学和药效学特性
由于PROTAC以催化模式发挥作用,传统方法无法准确评估PROTAC的药代动力学和药效学(PK/PD)特性。尽管PROTAC有大量的体外和啮齿动物PK数据可用,但更高的物种和人类PK数据稀缺。构建更高物种的动物实验数据库有助于构建蛋白降解剂的PK/PD评价体系,可以更好地预测体内药。
Arvinas头部管线
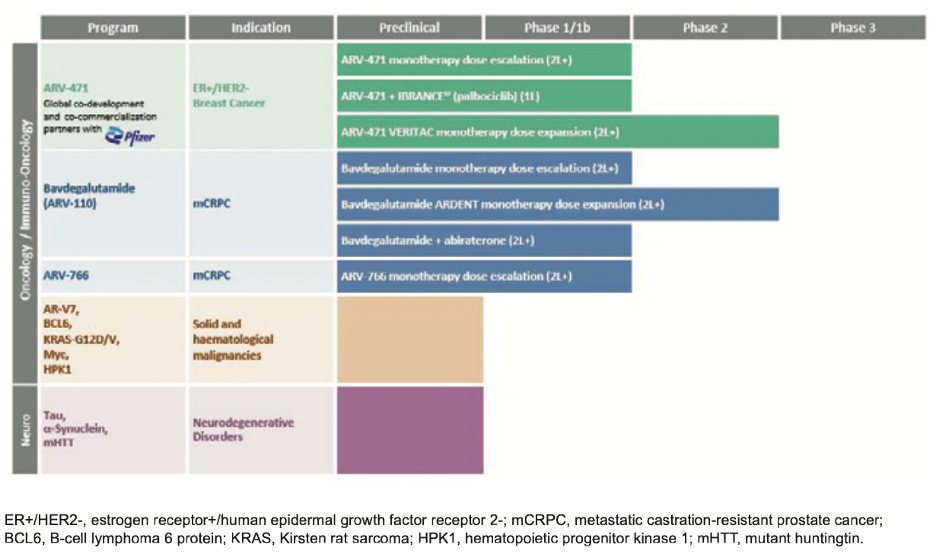
资料来源:Arvinas 2021 Annual Report
ARV-110

资料来源:PROTAC targeted protein degraders: the past is prologue

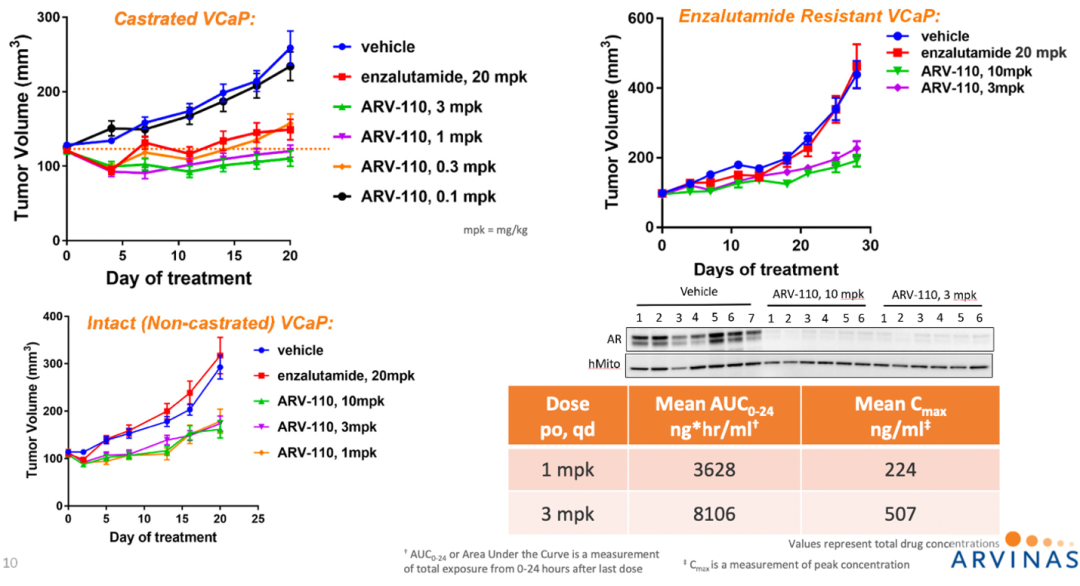
资料来源:Moving PROTAC Protein Degraders from the Laboratory to the Clinic
2019年,ARV-110获批进入临床用于治疗mCRPC(快速通道),临床前数据如上。
2022年2月,Arvinas公布了Bavdegalutamide(ARV-110,口服AR PROTAC)的I/II期临床试验结果。这些临床试验数据显示在人体中ARV-110剂量达420mg(II期起始剂量)时耐受性良好。ARV-110在治疗携带AR T878X 和/或 H875Y (T878X = T878A 或 T878S) 突变的转移性去低势抗性前列腺癌(mCRPC)患者中,展现有力的抗肿瘤活性和临床益处。这些结果也显示出,在没有携带AR T878X/H875Y 突变的肿瘤患者中,通过使用ARV-110后也会出现PSA的指标下降以及出现肿瘤缩小的现象。
基于这一积极结果,Arvinas计划2022底前启动一项关键性临床试验,评估ARV-110治疗mCRPC患者的效果。Arvinas已经与FDA沟通加速审批ARV-110,如果临床进展顺利,III期临床以2-3年时间预估,全球首款PROTAC药物获将在2025年左右实现商业化落地。
ARV-471
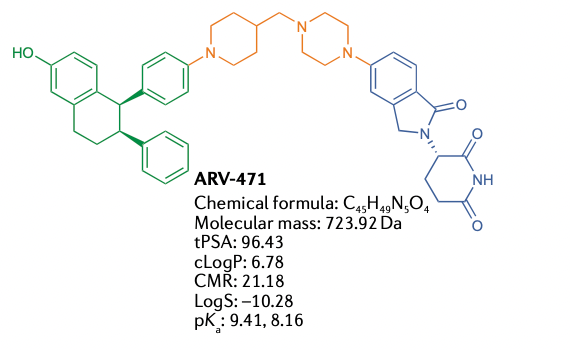
资料来源:PROTAC targeted protein degraders: the past is prologue
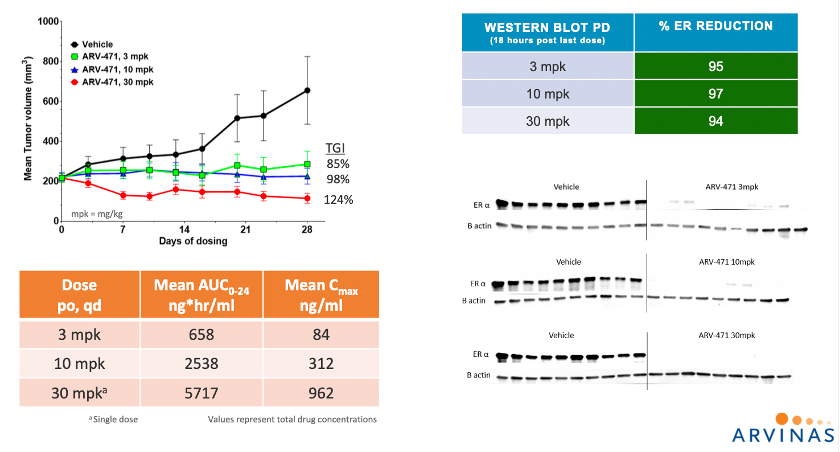
资料来源:Moving PROTAC Protein Degraders from the Laboratory to the Clinic
2019年,ARV-471获批进入临床用于治疗局部晚期或转移性ER阳性/HER2阴性乳腺癌患者,临床前数据如上。
2021年12月,Arvinas公布了ARV-471(口服ER PROTAC)的临床I期试验结果。临床结果显示ARV-471口服安全性高,在人体内剂量达700mg(评估最高剂量)时耐受性良好,在 CDK4/6 抑制剂预处理的患者中显示出抗肿瘤活性。
目前,ARV-471正在开展单药以及与帕博西尼(全球首个CDK4/6抑制剂)联合治疗局部晚期或转移性ER阳性/HER2阴性乳腺癌患者的II期临床。2022年,Arvinas还计划启动转移性乳腺癌治疗的III期临床,包括单一疗法和联合疗法,一项与依维莫司(mTOR抑制剂)联合治疗 2L/3L 转移性乳腺癌的 I b期临床,以及一项针对早期乳腺癌的II期辅助疗法临床。持续关注ARV-471的临床进展及结果。
蛋白降解领域发展潜力巨大。近两年,PROTAC标杆公司Arvinas正处于临床关键阶段,ARV-110和ARV-471的II/III期临床结果会很大程度上影响同业的发展策略。目前,国内进入临床阶段的蛋白降解剂管线屈指可数,且均处于临床早期,需要对于降解的技术路径做深入研究,并对临床前数据做出判断。
参考文献:
[1] 蛋白降解《小分子创新药发展》报告,蛋壳研究院
[2] Zhao L, Zhao J, Zhong K, Tong A, Jia D. Targeted protein degradation: mechanisms, strategies and application. Signal Transduct Target Ther. 2022;7(1):113. Published 2022 Apr 4. doi:10.1038/s41392-022-00966-4
[3] Miao Y, Gao Q, Mao M, Zhang C, Yang L, Yang Y, Han D. Bispecific Aptamer Chimeras Enable Targeted Protein Degradation on Cell Membranes. Angew Chem Int Ed Engl. 2021 May 10;60(20):11267-11271. doi: 10.1002/anie.202102170. Epub 2021 Apr 7. PMID: 33634555.
[4] Ji CH, Kim HY, Lee MJ, Heo AJ, Park DY, Lim S, Shin S, Ganipisetti S, Yang WS, Jung CA, Kim KY, Jeong EH, Park SH, Bin Kim S, Lee SJ, Na JE, Kang JI, Chi HM, Kim HT, Kim YK, Kim BY, Kwon YT. The AUTOTAC chemical biology platform for targeted protein degradation via the autophagy-lysosome system. Nat Commun. 2022 Feb 16;13(1):904. doi: 10.1038/s41467-022-28520-4. Erratum in: Nat Commun. 2022 Apr 12;13(1):2108. PMID: 35173167; PMCID: PMC8850458.
[5] Békés M, Langley DR, Crews CM. PROTAC targeted protein degraders: the past is prologue. Nat Rev Drug Discov. 2022 Mar;21(3):181-200. doi: 10.1038/s41573-021-00371-6. Epub 2022 Jan 18. PMID: 35042991; PMCID: PMC8765495.
[6] Bricelj A, Steinebach C, Kuchta R, Gütschow M, SosičI. E3 Ligase Ligands in Successful PROTACs: An Overview of Syntheses and Linker Attachment Points. Front Chem. 2021 Jul 5;9:707317. doi: 10.3389/fchem.2021.707317. PMID: 34291038; PMCID: PMC8287636.
[7] Bemis TA, La Clair JJ, Burkart MD. Unraveling the Role of Linker Design in Proteolysis Targeting Chimeras. J Med Chem. 2021 Jun 24;64(12):8042-8052. doi: 10.1021/acs.jmedchem.1c00482. Epub 2021 Jun 9. PMID: 34106704.
[8] Arvinas Form S-1(2018)
[9] Arvinas 2nd Annual Targeted Protein Degradation Summit:Moving PROTAC Protein Degraders from the Laboratory to the Clinic(2019)
[10] Arinas Annual Report (2021)






