生产具有一致质量的重组腺相关病毒 (rAAV) 的上、下游工艺的优化取决于快速表征关键质量属性 (CQA) 的能力。在 rAAV 生产的背景下,病毒滴度、衣壳含量和聚体被确定为潜在的 CQA,影响 rAAV 介导的基因治疗产品的效力、纯度和安全性。尽管快速、高通量的方法开始被开发和商业化,检测这些属性的分析方法通常会因工艺开发的周转时间长或产量低而受到影响。这些方法尚未在学术或工业实践中得到很好的确立,支持性数据也很少。在这里,我们回顾了已建立和即将推出的 rAAV 质量属性定量检测分析方法。在评估每种方法时,我们强调 rAAV 快速在线表征的进展。此外,我们发现从传统方法过渡到新方法的一个关键挑战是后者缺乏学术和工业经验。这篇文献综述可作为选择针对质量属性的分析方法的指南,以在rAAV 介导的基因疗法的工艺开发过程中进行快速、高通量的过程表征。
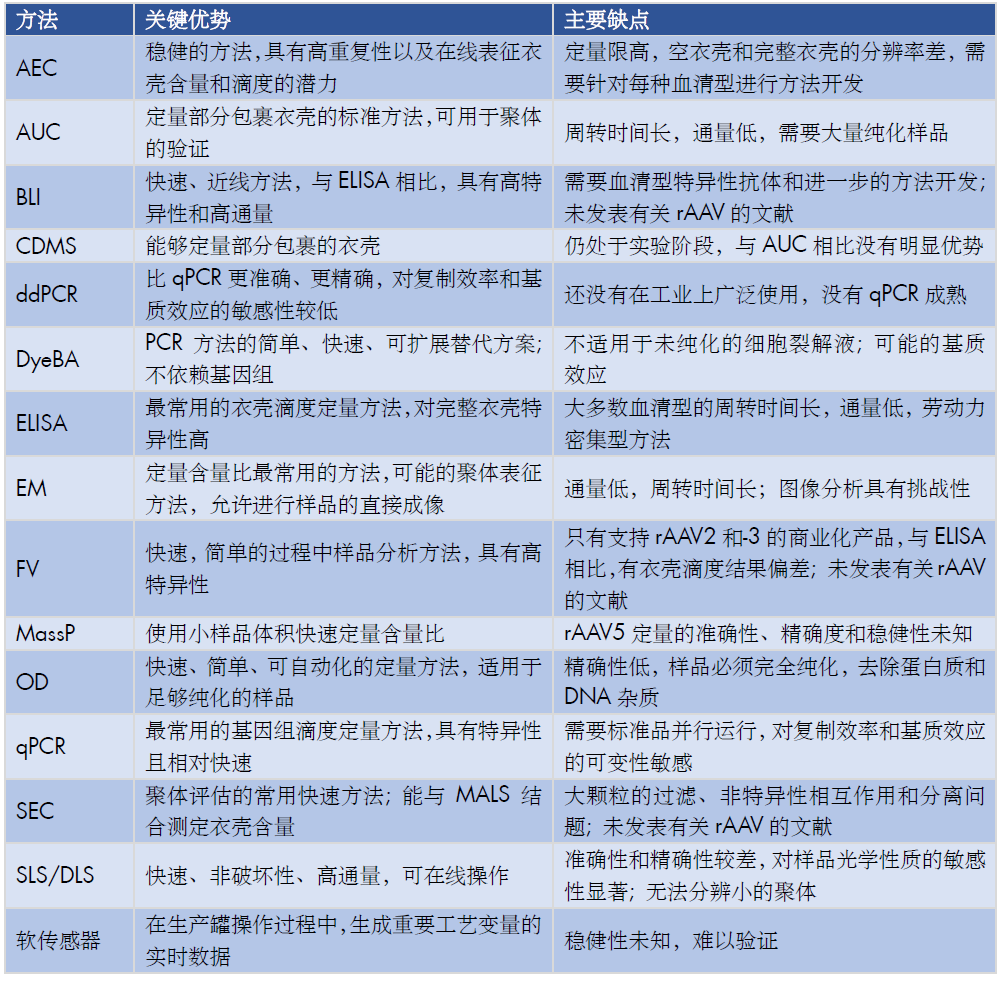
每种分析方法的主要优点和缺点
qPCR和 ddPCR
定量聚合酶链式反应 (qPCR) 和数字液滴 PCR (ddPCR) 在热循环仪中扩增期间或之后通过荧光(FS) 检测对 DNA 载体进行定量。由于它们的简单性、特异性和稳健性,它们是目前最广泛使用的基因组滴度定量方法。为了准确,这些方法需要对样品进行化学或酶处理,以消化未包裹的 DNA,并使衣壳蛋白变性以暴露包裹的 DNA。这些处理使它们能够耐受蛋白质或 DNA 杂质,并适用于未纯化的过程中样品。
qPCR是rAAV 参考标准材料 (RSM) 基因组滴定的标准程序,但大型多实验室研究显示其精确性低、重复性低,由变异系数 (CV) 表示,差至 >30% CV ,可重复性在 70%–100% CV。这种可变性的随机和系统来源,例如低复制效率或引物目标序列的选择,已经通过额外的 DNA 预处理和优化的引物被识别和缓解,从而提高可重复性至5%–20% CV 和中间精确性至15%–50% CV。与 qPCR 相比,ddPCR 不需要标准曲线并测量 PCR 循环的终点,对可变复制效率的敏感性较低。因此,ddPCR 比 qPCR 精确得多 – 可重复性为 2%–10% CV,中间精确性为 3% – 8% CV - 并且更能耐受基质效应和抑制剂。qPCR 和 ddPCR 都表现出2-4 个数量级的动态范围。当 AAV 中过大的转基因从末端截断时,qPCR 和 ddPCR 都不能准确地确定完整基因组的滴度,因为 PCR 复制周期只考虑扩增子本身的存在,即引物序列两侧的DNA。此外,由 qPCR 和 ddPCR 确定的基因组滴度可能不同,在开发或生产过程中从 qPCR 转换到 ddPCR 有点复杂。
ELISA
酶联免疫吸附分析 (ELISA) 通过与对组装的 rAAV 衣壳的构象表位特异的单克隆抗体所连接的酶催化底物反应的光度活性来定量衣壳滴度。在其最常见的三明治 ELISA 中,捕获抗体用于将 rAAV 衣壳固定在固体支持物上,而检测抗体帮助使用生物素偶联抗体和链霉抗生物素过氧化物酶催化生物素/链霉抗生物素过氧化物酶显色反应进行定量。该分析通常在纯化步骤后进行,但足够稳健且具有特异性,可用于具有中等基质效应和游离衣壳蛋白的样品,如细胞裂解液。ELISA 在分析前涉及多个耗时的孵育和洗涤步骤,总周转时间为 4-5 小时,或长达一个工作日。
三明治 ELISA 用于 AAV2 和AAV8 RSM 的表征,在多实验室研究中证明了可接受的精确性,可重复性为 10%–15% CV,可再现性约为 40% CV。特异性高,血清型之间几乎没有交叉反应性,并且针对血清型 rAAV1、2、3、5、6、8、9 和 rh.10 构象表位特异性的单克隆抗体有商业化产品。定量限约为每毫升 108衣壳颗粒 (cps),具体取决于血清型,线性范围限制在 1-2个数量级,因此建议对滴度未知的样品进行预先滴度评估。
针对基质效应的特异性和稳健性是 ELISA 的主要优势,但考虑到周转时间长、每 96 孔板仅 10 个样品的中等通量以及劳动密集型样品制备操作,在没有自动液体处理站的工艺开发环境中,用于衣壳滴度的常规定量检测具有挑战性。最近,针对血清型 2、8 和 9的试剂浓度的优化将单次检测的孵育时间缩短至总共 2.5 小时,且准确度和精确性相当。此外,基于 ELISA 的 rAAV 检测已成功转移到成熟的Gyrolab 系统,后者是一种基于自动化微流控平台的小型化 ELISA,有望缩短周转时间并将通量提高至每小时 96 个样品,同时将线性范围提高一个数量级。这些发展旨在减轻对工艺开发中 ELISA分析的一些担忧,但与传统 ELISA 相比,需要进一步的方法开发,来建立准确性和可靠性。
ELISA与qPCR 相结合,通过分别用 ELISA 和 qPCR (qPCR + ELISA) 定量衣壳和基因组滴度来估计给定 rAAV 样品的含量比。这种间接方法的准确度和精确性通常较低,因为它们取决于两种方法的累积可变性。尽管已经报道了 4%–24% CV 的可重复性,但仔细考虑误差累加(qPCR:5%–30% CV,ELISA:10%–15% CV,组合:11%–36% CV)以及数据准确性是通过这种方法对含量比进行常规估计所必需的。
TEM
透射电子显微镜 (TEM) 使用穿过薄样品的加速电子束创建具有纳米分辨率的图像,透射率取决于局部电子密度。它通常与负染色一起使用,其中重金属染色(通常是铀酸盐)增加对比度。对于 rAAV(直径约为 25 nm),样本图像中的染色、部分染色和未染色的衣壳分别代表空的、部分填充的和完整的衣壳,并通过手动视觉识别进行定量。它是在实验室环境中确定含量比的参考方法,但也被用于鉴定聚体、变形衣壳和非衣壳颗粒,例如宿主细胞碎片。尽管据报道 TEM 可用于未纯化的样品,但它通常仅用于纯化样品,因为细胞裂解液中存在的蛋白质和细胞碎片会干扰 TEM 图像中 rAAV 衣壳的准确识别。样品制备简单地包括样品在网格上的沉积和重金属染色。
TEM的精确性尚未得到全面评估。必须对数以千计的衣壳进行成像和分析以获得统计意义,单个图像的衣壳含量变化约 2%。然而,不可靠的结果很常见,并且已报告与正交方法(例如分析型超速离心法 (AUC))的一致性较差。准确度低通常是由于染色模糊、部分填充颗粒和染色不均匀造成的,导致衣壳识别对比度低和模糊不清。在这方面,最近低电压 TEM 的商业化可能是有希望的解决方案,因为自动图像分析将周转时间缩短到 6 小时左右,并使大量衣壳的分析标准化。TEM 在含量比、聚集和纯度分析方面的多功能性;其简单的样品制备;并且其对样品的直接目视检查在工艺开发环境中是有利的。然而,低通量和长周转限制了其作为常规分析方法的应用,并且必须研究其与正交方法的系统分歧。
除 TEM 外,冷冻电子显微镜 (cryo-EM) 被用于量化含量比并被验证作为放行检测分析。尽管一项研究发现 TEM 和冷冻 EM 之间测量的含量比没有显著差异,但据报道后者比前者更稳健,这是由于在 TEM 中普遍观察到细胞碎片的干扰和衣壳染色不均匀所致。
OD
光密度(OD;也称为紫外吸收)测量核酸和蛋白质在 260 nm 和 280 nm 处的吸光度,以根据特定于衣壳血清型的预定消光系数和其基因组的分子量来定量rAAV 样品的衣壳滴度和含量比。建议使用去污剂和加热使衣壳变性以暴露载体基因组,但在一些研究中不进行。这种检测方法并非仅针对 rAAV;因此,严格要求从样品中去除所有其它吸光性杂质,例如残留的核酸和蛋白质,以确保准确性。
OD的精确性与组合的 qPCR/ELISA 工作流程相当,报告的可重复性数据含量比为 15% CV,衣壳滴度为 22% CV。该方法仅限于高于 5 x 1011 vg/mL 的浓缩样品,需要纯化,并且可能需要对过程中样品进行浓缩,但速度快(约 15 分钟),适用于纯化的 rAAV。OD 的高定量限和小线性范围(通常大小为两个数量级)可以通过具有更短或可变光程的分光光度计来改善。OD 仪器简单,可实现自动化,理论上适用于在线过程测量,但在实践中,纯化和变性步骤限制了其在工艺开发中的应用。相反,OD 通常在基于衣壳物理分离的方法中用作检测器,例如阴离子交换层析法 (AEC) 或 AUC。
AUC
沉降速度 AUC 将经受离心力的样品的沉降曲线与分子量分布和颗粒大小联系起来。在单个实验中,AUC评估聚体的存在并定量空、部分包裹和完整衣壳的相对含量。AUC 与密度梯度超速离心不同,后者是 rAAV 下游工艺过程中用于纯化和富集完整衣壳的常用工艺,因为 AUC 使用紫外吸收或Raleigh干扰监测离心过程中的颗粒沉降。检测器的灵敏度和诱导密度梯度的风险将 AUC限制为不含残留杂质或赋形剂的纯化样品,因此需要事先将滴度调整到检测器的小线性范围 2 x 1012–5 x 1012 cp/mL内。
AUC对含量比的定量有两个优点:高度可重复,CV 仅为 2%,并且区分部分包裹的衣壳与空的和完整的衣壳。如果聚体的含量低于 3%–5%,AUC 通常不能定量,因此对典型聚体含量低于 1% 的 rAAV 样品进行分析具有挑战性(图 1)。这种高定量限制是由于其准确性差且可再现性低,聚体含量的标准偏差高达 ± 1% 左右,这是由于硬件组件的不正确匹配造成的。一般来说,AUC 需要 400–500 mL 的大样品量,以及 2 x 1012 – 5 x 1012 vg/mL 左右的高浓度,代表了在早期生产阶段不可回收物料的显著损失。通量限制为大约为6 h 内 7 个样品,在工艺开发中常规使用 AUC 具有挑战性。相反,它非常适合作为正交方法来验证分辨率较低、但更快速的方法。
AEC
AEC已被用于在带正电荷的固定相上分离几种血清型(1、2、5、6、8、9)的空衣壳和完整 rAAV 衣壳,基于由包裹的带负电荷的基因组引起的等电点差异。AEC 是在 rAAV 下游工艺过程中分离空衣壳和完整衣壳的最广泛使用的纯化工艺之一,可用于配备OD 或 FS 检测器的、验证友好型高效液相色谱 (HPLC)系统,以定量洗脱液中的含量比。空衣壳和完整衣壳之间的充分分离需要针对每种血清型开发和优化流动相条件,但迄今为止尚未实现完整颗粒和空颗粒以及部分包裹衣壳的基线分离。该方法适用于来自下游纯化工艺的样品,无需额外的样品纯化或制备。但是,对于原始收获物的定量灵敏度太低,UV 检测器线性范围的下限约为 1011 vg/mL。
AEC的准确性通过与 TEM 和 AUC 的比较来验证,并且已经报道了使用 UV 检测器的高重复性 (<1% –4% CV) 和中间精确性 (2% – 5% CV)。该方法的浓度范围受到检测器的灵敏度的限制,下限约为 1011vg/mL,与 OD 类似,但使用 FS 检测器将检测限降低一个数量级。如果样品浓度不是限制因素,那么这种方法的高通量和可再现性有利于在工艺开发中常规使用。鉴于 HPLC 系统的自动化和该方法的非破坏性,AEC 作为在线仪器也很有吸引力。
DLS
在动态光散射 (DLS) 中,样品的平均粒径通过测量其溶质随时间因布朗运动而散射的光的非定常强度来量化。DLS 量化聚体含量并估计纯化 rAAV 样品的衣壳滴度,无需事先进行样品制备,可在 <5 min内完成。
估计的衣壳滴度通常不准确,但与使用多角度 DLS 的 ELISA 相比有所改进。与显微镜相比,从 DLS 获得的粒度分布仅为半定量且分辨率低。该方法的总体精确性较低,使用多角度 DLS时,衣壳滴度的可重复性差为 45% CV,聚体含量的可重复性差为 85%。DLS 以批次模式运行,是一种具有高通量的非破坏性方法,通常与静态光散射 (SLS) 结合使用。
SLS
在 SLS 中,通常以多角度光散射 (MALS) 的形式实现,样品的平均颗粒分子量和大小通过测量其溶质由于Rayleigh散射而散射的光的时间稳定强度来量化。批次SLS 专门与 DLS 结合使用,与单独使用 DLS 相比,提高了 rAAV 样品衣壳滴度估计的准确性。尽管 SLS/DLS 的组合工作流程可以确定平均分子量,但聚体的存在会妨碍估计衣壳含量的准确性。SLS/DLS 不需要样品制备,大约 2 到 5 min即可产生结果,并且适用于 384 孔板。
SLS/DLS准确性和精确性的一个主要挑战仍然是必须事先知道的样品折射率的高灵敏度。由于空衣壳和完整衣壳样品之间的折射率差异,可靠性较差,如果折射率分配不正确,会导致高达33%的误差。SLS/DLS是一种快速、非破坏性的方法,具有巨大的通量以及在工艺开发中作为衣壳滴度和聚体低体积筛选工具的极大潜力。其分析时间短,动态范围大,可覆盖6个数量级,在常规过程监测中也很有吸引力。
MassP
在质量光度法 (MassP) 中,通过测量单个颗粒结合在玻璃表面上时散射的光,可以在单颗粒水平上量化颗粒的质量。MassP 的工作原理是使用部分反射器衰减来自照明源的反射光,同时收集来自目的颗粒的散射光。散射光和反射光之间的干涉对比可以通过校准程序与颗粒的质量相关联,同时应用于蛋白质和核酸 MassP 最近已被用于表征 rAAV5 的含量比,在 1012–1013 cp/mL 下使用低至1 mL 的样品,测量时间仅为几分钟。MassP 的周转时间短且样品需求量低,使其成为常规、实时过程监测 rAAV 含量比的有前途的工具。其稳健性,尤其是关于蛋白质/DNA 污染物和其它噪声源,以及性能特征,如其准确性和精确性,仍需要在未来针对rAAV 的表征进行确定。
SEC
尺寸排阻色谱 (SEC) 根据其流体动力学体积分离低于亚可见尺寸 (d < 100 nm) 的溶质。使用带有 UV、FS 或差示折光指数 (dRI)检测器的 HPLC 系统以量化洗脱物质,由于其简单性、通量和速度,是生物制药行业评估聚体的主要方法。对于 rAAV,SEC-FS 已成功量化了多种rAAV血清型纯化样品中小尺寸聚体和片段的含量。
基于 SEC 的自动化方法适用于近线应用,并具有作为工艺开发中聚体快速筛选工具的潜力。它们通常比正交方法(例如 AUC 或 DLS)更准确和精确,但大聚体的准确性受到 SEC 分离机制的限制:聚体的固定相过滤、聚体和柱筛板之间的非特异性相互作用以及由于流动相稀释导致的可逆的聚体解离很常见。这些限制必须使用正交方法(最重要的是 AUC)进行评估,以验证基于 SEC 的方法,但尚未发表全面的比较研究,以支持它们用于 rAAV 聚体。
MALS检测器现在通常与 UV、FS 或 dRI 串联使用,以确定和确认通过 SEC 分离的单个物质的分子量。使用这种配置,可以使用 SEC- UV-dRI-MALS对纯化样品的衣壳滴度和含量比进行定量,其基于单体峰的平均分子量和总浓度。这个组合包括聚体含量的定量,其结合的工作流因此可针对本文中讨论的所有产品属性。尽管很有前景,但这项技术必须克服与 SEC 相关的挑战,例如大聚体的准确性以及对样品光学特性的敏感性。此外,其高报告的定量限在纯化样品中约为 1013 cp/mL,使得该技术不适用于衣壳滴度通常为 1011-1014cp/mL 的过程中样品(图 2)。
FV
流动病毒测定法 (FV) 在微流体流动池中定量完整的载体衣壳和载体基因组,每个都用特定的荧光抗体标记。类似于流式细胞术 - 一种成熟的细胞计数分析方法,FV 通常用于病毒学中的病毒检测和定量。样品制备包括一个 30 min的标记步骤,该方法已成功应用于来自不同下游纯化步骤的未纯化样品。rAAV的应用目前仅限于对血清型 2 和 3 的衣壳滴度进行定量,因为 FV 取决于血清型特异性抗体的可用性,并且使用这种方法同时鉴定空衣壳和完整衣壳仅适用于大型囊膜病毒(即慢病毒)。
尽管标记方法相似,但 FV 产生的衣壳滴度与 rAAV2 参考材料的 ELISA 相比相差两个数量级,所以该方法的准确性受到质疑。据报道,rAAV2 和3 的重复性约为 5% CV,但在其它病毒的独立研究中通常为 10% – 30% CV。该方法的高通量和简单的样品制备有利于工艺开发,尤其是过程监测,但同行评审的文献中没有支持其定量 rAAV 时的准确性和精确性的数据。
CDMS
电荷检测质谱 (CDMS) 同时测量单个离子的电荷和质荷比,从而可以直接确定它们的质量。Pierson及其同事报告成功分辨了空的、部分包裹的和完整的衣壳,并使用 CDMS 对衣壳含量进行了量化。该方法准确且可重复(<2% CV)。与 AUC(唯一能够分辨部分包裹衣壳的方法)相比,CDMS 的周转时间较短,为 2 h,但仪器不太成熟,仍在开发中。尽管 CDMS 在短期内不太可能与 AUC 相媲美,以用于鉴定含有部分和片段基因组的衣壳亚群,但该技术最近已由 Megadalton Solutions 商业化,重点是改进针对 rAAV 的应用。
DyeBAs
使用来自基于染料的结合测定 (DyeBA) 的 FS 信号,可以从粗略纯化的样品中直接定量基因组滴度。该方法简单快速,既不需要特殊仪器,也不需要依赖基因组的探针,即可在 30 min至 3 h内产生结果。该方法精确,报告的重复性和中间精确性分别在 4% – 17% CV 和 7% – 16% CV 内。与基于 PCR 的方法类似,DyeBA 需要在样品制备过程中去除未包裹的 DNA 和衣壳裂解。然而,用这种方法分析的 rAAV 参考材料的基因组滴度与通过 qPCR 获得的结果显著不同,而与通过 ELISA 获得的衣壳滴度一致。
DyeBA所需的样品量低,仅为 1–10 mL,线性范围为 1010 – 1013vg/mL,涵盖了生产过程中预期的滴度范围(图 2),DyeBA对于工艺开发是一种有吸引力的方法。然而,该方法的准确性和稳健性仍需确定,尤其是对于已证明会干扰分析的常见基质成分。
BLI
生物层干涉仪 (BLI) 通过测量因分析物与固定在探针表面的特定抗体结合而引起的浸没探针光学厚度的变化,从而量化生物分子相互作用和分析物浓度。这种高通量、无标记的方法专门针对近线使用,提供可接受的精确度,既不需要样品纯化也不需要制备,并且已成功用于生物制药和疫苗的工艺开发。它最近被商业化,用于在成熟的 Octet 系统上量化 rAAV 衣壳滴度,支持 96 孔和 384 孔板。BLI 有望用于 rAAV 工艺开发,但目前尚无支持其在该应用中的准确性和精确性的文献来评估其准确性和稳健性。
软传感器
最近,报告了使用原位 FS 光谱和在线数字全息显微镜监测 rAAV 生产培养和预测细胞内和细胞外 rAAV 滴度以及其它工艺相关质量属性的研究。这些方法采用软传感器(回归模型或基于现有过程数据训练的神经网络形式的估计器)来处理传感器数据并实时预测过程变量。这些方法是目前文献中关于 rAAV 生产工艺实时过程分析技术的唯一报告,但对于此类基于软传感器的技术的常规使用,还需要大量验证。
其它方法
在本节中,我们将介绍一些已被报道用于rAAV或相关生物制品的表征方法,但由于对其检测性能的数据不足,我们将不进行彻底的讨论。毛细管等电聚焦技术根据衣壳等电点的差异来测定完整衣壳、部分包裹衣壳和空衣壳的含量。结果表明,该系统的分辨率优于AEC,但对rAAV的准确性和精确性的数据有限。
纳米颗粒示踪分析表征由于布朗运动引起的颗粒运动,如 DLS,但通过超显微镜直接观察颗粒。该方法旨在定量 rAAV 衣壳滴度和聚体,但除非使用金纳米颗粒来改善散射信号,否则灵敏度不足,从而引发对其准确性和精确性的担忧。
气相电泳迁移率分子分析,也称为电喷雾-微分迁移率分析,将单电荷粒子的电泳迁移率与其尺寸和分子量联系起来。该方法可快速量化各种小型无囊膜病毒,并以合理的准确性和精确性表征其完整性。尚未报道在 rAAV 表征中的使用,但衣壳滴度和含量比的定量是其可预见的潜在应用。
不对称流场-流分馏 (AF4) 是一种基于流体动力学体积在两个垂直流中分离颗粒的技术,已被用于代替 SEC 分离 rAAV 聚体,以使用MALS 进行分析。AF4-MALS 可以分辨和定量尺寸达微米的聚体,因此包括通常通过基于 SEC 的方法去除的大型聚体。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDSPAGE) 是一种广泛使用的方法,通过可视化衣壳蛋白和可能残留的蛋白质杂质来评估 rAAV 纯度,在分离后根据分子量进行蛋白质染色。衣壳滴度的半定量估计可以直接从SDS-PAGE 染色中测量,通过与银染凝胶的参考标准进行比较,并使用红外-FS 扫描对考马斯亮蓝染色的凝胶进行扫描。
其它方法尚未专门用于 rAAV,但由于现有的、可比的应用,仍然显示出作为 rAAV 分析工具的前景。首先,表面等离子共振,与BLI相似,通过测量传感器芯片的光学特性的变化来量化分析物的浓度,在这种情况下,偏振光引起的自由电子共振角的偏移,由分析物与表面的固定抗体结合引起。它可成功定量下游样品中的腺病毒,与 BLI 相比,低通量是其主要缺点。其次,使用悬浮微、纳米通道谐振器对粒子的质量进行测量已经被用于表征和定量重组蛋白中的聚体。最近在后一项技术上的改进 - 在单个纳米粒子水平上达到阿克精度 - 表明了通过悬浮纳米通道谐振器中的质量来表征rAAV的潜力。







