稳定性
高浓度单抗溶液的稳定性受到长和短距离相互作用的影响。在理想的稀释溶液中,长距离相互作用占主导地位,而随着蛋白质浓度的增加,短距离相互作用的影响越来越大。在给定的蛋白质溶液中,短距离和长距离相互作用的性质和强度受到蛋白质的氨基酸序列和分子结构以及溶液的pH值、离子强度和共溶质的影响。这些相互作用对分子稳定性和蛋白质相行为的影响可以进行分析,以评估目标分子的稳定性。
更高的熔点温度已经被发现与更高的长期稳定性有关。渗透第二维里系数也被用来解释不同的影响参数,但在某些情况下,并不适用于高浓度的蛋白质溶液。如上所述,在分子间距离较短的蛋白质间的局部相互作用可能在决定高浓度溶液的流变性能中起着关键作用。体积排阻色谱检测、电位和粘度检测、热稳定性检测以及流变检测可用于进行筛选研究。尽管有各种各样的检测选项,但长期稳定性很难预测,因为影响它的因素和相互作用非常多。因此,通常采用时间和成本较高的方法,即将制剂储存数月至数年,以建立稳定性趋势。
如上所述,蛋白质浓度越高,聚集几率越高,因为组成物质的距离越近,分子间的相互作用就越强,自我关联事件的频率也越高。这使得蛋白质稳定性研究和工艺条件(如温度和光照)对产品质量的影响的研究变得更加重要。抗体聚集受到内外因素的双重影响。内在因素包括单抗的一级序列和结构。外在因素是指环境或工艺条件,如pH值、离子强度、缓冲液成分、温度、机械应力和蛋白质浓度。
蛋白质的聚集依赖于具有聚集相容构象的种群,在这些构象中,聚集倾向性区域为溶剂暴露的。易于聚集的构象的浓度取决于物理化学参数,如蛋白质和离子浓度、pH值和温度。当蛋白质展开时,蛋白质上的疏水区域可能会暴露出来,这可能会促进分子间的相互作用,导致聚集。
在高蛋白质浓度下,在室温-室内光照(RTRL)条件下观察到聚集率增加。图4显示了制剂的药物底物的高分子量含量在室温与RTRL条件下保持时间的关系。缓解策略包括使用黄光、低/无紫外输出光(即发光二极管)以及在生产过程中基于时间的光暴露控制。
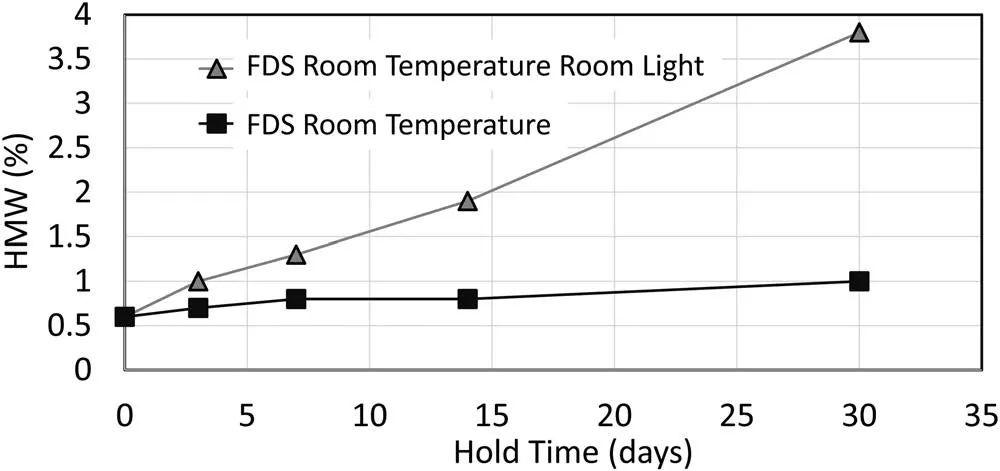
图4. 在150 g/L蛋白质浓度下,储存时间对制剂的药物底物高分子量含量的影响。数据显示为室温-室内光照和室温条件。
如上所述,可将赋形剂添加到制剂中,以提供稳定作用。这包括去污剂、蛋白质稳定剂和其它可以减少蛋白质-蛋白质相互作用的添加剂,从而使高蛋白质浓度的制剂具有良好的稳定性。通常添加聚山梨醇酯,以稳定蛋白质,防止界面诱导的聚集,并最大限度地减少蛋白质的表面吸附。然而,聚山梨醇酯易于经自氧化和水解而降解。PS80易于通过温度、光、氧化剂和金属而自氧化。PS80易于经 pH 值、温度和酶促途径水解。脂肪酶 LPL 和 LPLA2 是残留宿主细胞蛋白(HCP) ,其已被证明会增加 PS80 的降解。由于脂肪酶的潜在共浓缩,对于蛋白质浓度较高的溶液,PS80 降解的风险更大。在上游和/或下游工艺优化过程中,应优先考虑这些额外的考量因素,以确保去除此类有问题的HCP。
有多种策略可以缓解 PS80 的降解。可以优化 PS80的浓度,以确保在降解的情况下,仍处于适当的水平。在另一种方法中,可以在制剂中加入金属螯合剂,例如乙二胺四乙酸(EDTA)。由于脂肪酶的活性需要钙,钙螯合可能是减轻脂肪酶活性的有效策略。这可能会降低脂肪酶诱导的聚山梨醇酯降解为过氧化物酶的速度,从而也降低蛋白质中甲硫氨酸氧化的速度。PS80 降解也可以通过光保护和适当的温度控制来缓解。问题性脂肪酶可以在下游纯化过程中被靶向去除,或者通过细胞系工程在上游使用敲除方法去除。
表观属性
颜色、浊度和可见颗粒是生物药物底物和药品的外观属性。国际协调会议(ICH) 指南建议在放行规范 (ICH Q6A,1999) 中“对新药物底物的状态(例如,固体、液体)和颜色进行定性声明”。在低单抗浓度下,大多数制剂的产品呈现无色至淡黄色。然而,在高蛋白质浓度下,例如超过100 g/L,颜色变得更浓,溶液变得更趋乳白色。
由于产品颜色已被证明与蛋白质浓度相关,因此样品颜色可能是由抗体的共价结合翻译后修饰引起的。抗体颜色也可能受到细胞培养过程中的氧化或药物底物生产或储存过程中的光降解的影响。由制剂引起的外观变化可归因于特定赋形剂的降解,例如组氨酸的光降解或蛋白质的氧化降解,因为过氧化氢和金属阳离子的存在。样品颜色也与单抗酸性物质的富集有关。已有研究证明,使用螯合剂、抗氧化剂或自由基清除剂(如EDTA 或二亚乙基三胺五乙酸)可成功缓解降解酶的催化活性和氧化应激。另外,可以通过减少生产和储存过程中不必要的曝光,来减轻光诱导的降解。
乳光,溶液中的均匀雾度或浊度,可能是聚集的前兆,表明了产品稳定性或质量下降的趋势。临界乳光是一种光散射现象,发生在光散射非常显著的临界区域,底物在反射光下呈乳白色,在透射光下呈棕黑色。这种胶体光学性质受Rayleigh散射和/或Tyndall效应的影响,取决于分子-分子相互作用和距离。因此,制剂开发对于确定合适的溶液条件(如pH 值)至关重要。
浊度可能是由于临界乳光造成的,也可能是由于悬浮颗粒造成的。过滤通常可有效去除可见颗粒,但可能不会降低浊度。然而,颜色和浊度(由于临界乳光)在高蛋白质浓度下本质上就更强烈,不一定表示产品质量的问题。可以用基于仪器的方法(产生数值读数)代替基于视觉比较的颜色和浊度方法,以提高准确性和一致性。例如,UV-Vis光谱、反相色谱和质谱等先进的分析技术可用于鉴别产生颜色的物质(发色团)并量化它们的相对贡献。微流成像等技术已被用作量化颗粒和表征其形态的手段。
冻存、操作和运输
行业已经为药物或生物技术产品的处理和运输制定了标准稳定性测试指南。对于高浓度产品,下文将介绍一些额外的注意事项。
单抗药物底物通常以冷冻状态储存,这提供了几个好处。冷冻状态降低了与流动水相关的蛋白质分子变化,例如水解。它还降低了微生物生长的风险,并最大限度地减少了运输过程中的界面吸附和起泡,从而潜在地提高了蛋白质的稳定性。尽管有这些优势,冻融过程可能会对产品质量构成风险。应选择远低于玻璃转换温度的冷冻储存温度,以避免蛋白质在冷冻和非冷冻状态下连续循环。行业已经开发了冻融规模缩小模型,并被证实用于高达200 g/L 的单抗浓度范围。在冷冻和储存工艺的开发过程中,需要考虑的因素包括冰水界面蛋白质的变性、冷变性现象、低温浓缩、赋形剂行为和pH漂移。
在低温浓缩中,蛋白质和其它溶质以渐进的冻结前端浓缩,这会加剧自交联动力过程。由于初始浓度高、某些缓冲液的温度依赖性pH 以及进一步浓缩蛋白质/缓冲液/赋形剂并产生干燥效应的冰形成,低温浓缩将蛋白质推至溶解度极限。通过缩短冷冻时间可以最大限度地减少冷冻浓缩。然而,较短的冷冻时间会导致较小的冰晶,从而导致较大的冰-液界面。浓度依赖性自交联(如二聚体形成)可能是可逆的。减轻蛋白质寡聚化可以在解冻后立即混合,以尽量降低蛋白质低温浓缩的发展。虽然这可能有助于减少解冻影响,但在解冻后低温条件下的粘度可能仍然是一个工艺限制。
对于高浓度药物底物,每袋或每批货物的价值都会增加。在低温下,应考虑药物底物包装中使用的聚合物的脆性。一次性使用塑料袋容易破损。这使得容器完整性变得更加重要,因为由于损失的产品质量更大,给定体积的内容物的损失将产生更大的财务影响。
高浓度原料药生产的关键因素总结:挑战和潜在的缓解策略
因素 | 挑战 | 潜在的缓解策略 |
UF/DF步骤生产具有所需制剂组成的高浓度药物底物 | 由于粘度的增加,轴向压力降增加 | 降低进样流速 使用可降低粘度的赋形剂 提高温度,以降低粘度 选择替代性UF/DF膜包设计
|
由于Donnan效应和体积排除,出现pH和溶质浓度偏差 | 通过实验或建模方法,补偿pH和溶质漂移 | |
由于高浓度UF/DF,导致剪切、界面效应和聚集 | 选择其它泵类型 动态优化剪切特性
| |
UF/DF系统残留质量占据了总产物质量的很大一部分;由于回收缓冲液冲洗,导致的产物池稀释 | 产物的低错流、低TMP循环,以使膜表面去极化 针对稀释影响,采用产物过浓缩策略 在回收过程中,采用低缓冲液冲洗流速 | |
高浓度药物底物的除菌过滤 | 低过滤器通量、更高的过滤器污染几率、低过滤器处理量 | 调节pH、在远离pI的条件下进行操作 调节制剂中的赋形剂 膜选择 – 更亲水的膜可能可降低疏水性污染/聚集 |
赋形剂吸附至除菌过滤器 | 过滤器润洗,以使结合位点饱和 | |
高浓度药物底物的稳定性 | 更高的聚集几率 | 加入赋形剂,以提供稳定作用 |
在室温、室内光照条件下,更高的聚集几率 | 在生产过程中,使用低/无UV输出的黄光,使用基于时间的光照暴露控制 | |
由于更高的脂肪酶浓度,导致更高的PS80降解风险 | 在制剂中使用金属螯合剂 目标问题性脂肪酶去除 | |
高浓度药物底物的表观属性 | 由于赋形剂降解、氧化降解、光诱导的降解,导致表观变化 | 使用螯合剂、抗氧化剂或自由基清除剂 |
高浓度药物底物的冷冻 | 低温浓缩加剧了自交联动力过程 | 使用更短的冷冻时间,最大限度地降低低温浓缩效应 解冻后立即混合,以尽量减少蛋白质低温浓缩的发展 |






