前言
近年来,全球细胞治疗市场发展迅猛,我国政府对细胞治疗也给予大力支持,国家级各部委颁布多项支持政策。2022年5月10日,国家发展改革委员会印发《“十四五”生物经济发展规划》,《规划》在第(五)部分“加快提升生物技术创新能力”的“开展前沿生物技术创新”中提到:发展基因诊疗、干细胞治疗、免疫细胞治疗等新技术,强化产学研用协同联动,加快相关技术产品转化和临床应用,推动形成再生医学和精准医学治疗新模式。
一、细胞治疗行业概况
1.1 细胞治疗概述
1.1.1 定义
细胞治疗(cell therapy)是2011年全国科学技术名词审定委员会公布的材料科学技术名词。通常是指利用患者自体(或异体)的成体细胞(或干细胞)对组织、器官进行修复的治疗方法,细胞治疗目前已广泛用于骨髓移植、晚期肝硬化、股骨头坏死、恶性肿瘤、心肌梗死等疾病。
图表1:细胞治疗示意图
数据来源:《CIRCULATION RESEARCH》、智银全球生物医药项目库
1.1.2 细胞治疗的特点
相比于传统的药物治疗,细胞治疗主要具有“选择性高”、“局部浓度高”、“可个性化定制”三大优势。
选择性高:细胞药物能感知复杂的人体内环境,只在特定的环境中激活,以发挥相应功能,相比于传统的药物治疗,这意味着可以更大程度上限制药物的副作用。
局部浓度高:人体代谢、药物效应动力学和药物代谢动力学决定小分子药物靶向性较低,它不只在病变组织或细胞内分布,还分布于整个机体组织,这通常会造成严重的脱靶效应。而细胞药物的优势在于可主动迁移到靶组织或靶细胞内发挥作用。
可个性化定制:由于个体差异,很难控制每个患者传统药物的最佳使用剂量,但在细胞治疗中,可应用合成生物学设计基因开关控制药物的合成或释放,也可以根据临床需要设计不同细胞药物以治疗更多疾病。
此外,细胞免疫治疗具有长期性,可长期监控肿瘤, 2010 年,两名血癌患者成为宾夕法尼亚大学医学院CAR-T细胞疗法临床试验的第一批参与者,他们的癌症在当年即实现完全缓解(CR)。
10年后的2022年2月2日,根据研究人员在Nature上已发表的研究成果及长达10年的随访结果表明,CAR-T细胞在注入患者体内10年后仍然可以被检测到。
图表2:两名患者的CAR-T细胞扩增和维持情况
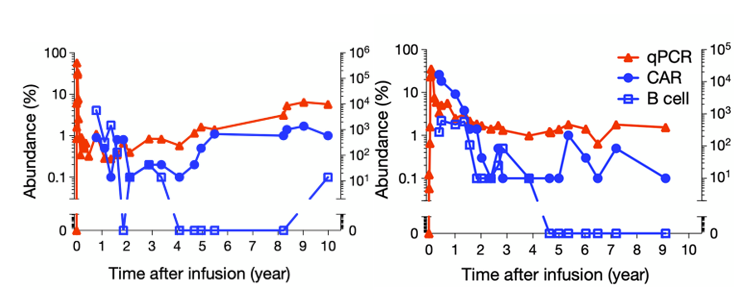
数据来源:Nature、智银全球生物医药项目库
1.1.3 细胞治疗是肿瘤治疗的下一程
在肿瘤细胞的发展过程中,细胞的癌变会导致新抗原物质的产生。而这类不表达于正常细胞的肿瘤特异性抗原可以激活人体免疫系统,促使免疫细胞对肿瘤细胞进行杀伤和清除。然而,肿瘤细胞在宿主体内能通过招募免疫调节细胞、下调肿瘤抗原表达、释放免疫抑制性因子等免疫逃逸机制躲避免疫系统的识别和攻击,从而得以继续增殖和转移,最终形成可见的肿瘤病灶。
图表3:肿瘤细胞抑制免疫反应作用机制
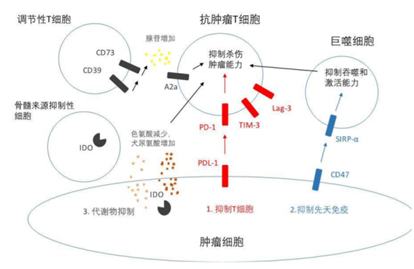
数据来源:CN-Healthcare、智银全球生物医药项目库
而细胞疗法则旨在通过体外对患者免疫细胞进行基因修饰和扩增后,使其能够直接在识别肿瘤抗原后被激活,并回输至患者体内,发挥治疗作用。这种治疗方法能大幅增加患者体内抗肿瘤的免疫细胞数量,达到杀伤和清除肿瘤细胞的治疗目的。
图表4:细胞疗法在体外对免疫细胞进行再教育
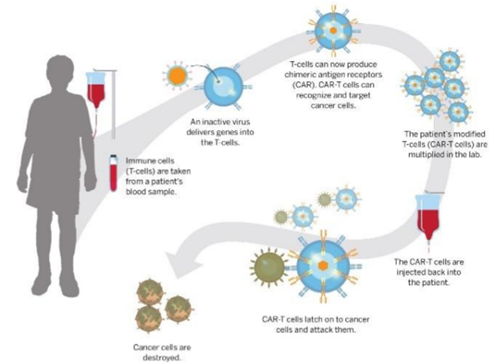
数据来源::Cancer Biology、智银全球生物医药项目库
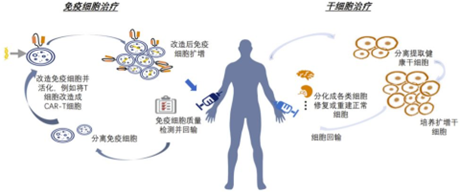
1.2 细胞治疗的分类
目前,学界对细胞治疗范围尚无明确统一界定,一般认为,细胞治疗包括干细胞治疗、免疫细胞治疗和其他细胞治疗。干细胞又可分为全能干细胞、多能干细胞和单能干细胞或胚胎干细胞和成体干细胞;免疫细胞治疗主要包括主动免疫治疗、过继性免疫治疗、LAK细胞免疫治疗、TIL细胞免疫治疗、CD3AK细胞免疫治疗、CIK细胞免疫治疗、EAAL细胞免疫治疗等。
图表5:细胞治疗分类
数据来源:CN-Healthcare、智银全球生物医药项目库
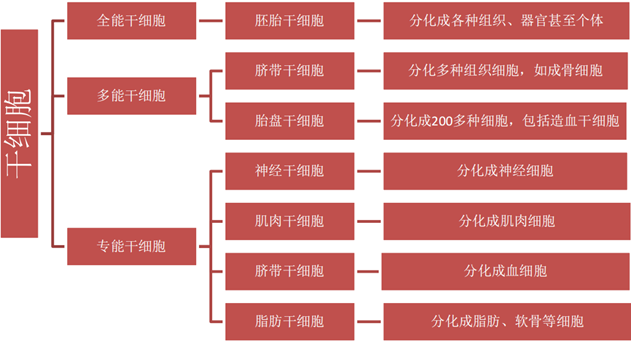
1.2.1 干细胞治疗
干细胞是可以分化为组织细胞的祖细胞。干细胞具有自我更新能力、多向分化潜能、低免疫原性和良好的组织相容性等特点,干细胞按分化潜能可分为全能干细胞、多能干细胞和单能干细胞。干细胞治疗机理主要是由于干细胞具有归巢能力、增殖分化能力和促进损伤修复能力。
图表6:干细胞的分类
数据来源:智银全球生物医药项目库
全能性干细胞(totipotent stem cells)它具有形成完整个体的分化潜能。由卵和精细胞的融合产生。受精卵细胞前几次分裂所产生的细胞也是全能干细胞。这些细胞可以无例外地生长出任何细胞类型。
多功能性细胞(pluripotent stem cells)这种干细胞在APSC多能细胞实验室具有分化出多种组织细胞的潜能。但却失去发育成完整个体的能力,发育潜能受到一定的限制。骨髓多能造血干细胞是典型的例子,它可分化出至少12种血细胞,但不能分化出造血系统以外的其他细胞。
单能干细胞也称专能或偏能干细胞(unipotent stem cells)这类干细胞只能向一种类型或密切相关的两种类型的细胞分化,如上皮组织基底层的干细胞、肌肉中的成肌细胞或叫卫星细胞。
按照发生学来源,干细胞可以分为胚胎干细胞和成体干细胞。
“胚胎干细胞”(embryonic stem cells,ESC)有许多重要的生物学特性:⑴发育的全能性。可发育为构成机体的不同细胞类型中任何一种细胞的潜能。ESC可诱导分化为下列细胞:造血干细胞、血管及内皮细胞、心肌细胞和肌肉细胞、神经细胞及其它分化细胞。⑵无限扩增性。体外无限扩增性是ESC研究和应用的前提和关键,这将为ESC提供无限的细胞来源。
“成体细胞”(adult stem cells,ASC)是指存在于一种已经分化组织中的未分化细胞,这种细胞能够自我更新并且能够特化形成组织的细胞。除从骨髓和血液中分离组织干细胞、还从人的胎盘、脐带、肌肉、大脑、皮肤、脂肪、滑膜等多种组织中获取各种干细胞。
已经发现的成体干细胞主要有:造血干细胞、骨髓间充质干细胞、神经干细胞、肝干细胞、肌肉卫星细胞、皮肤表皮干细胞、肠上皮干细胞、视网膜干细胞、胰腺干细胞等。成年个体组织中的成体干细胞在正常情况下大多数处于休眠状态,在病理状态或在外因诱导下可以表现出不同程度的再生和更新能力。
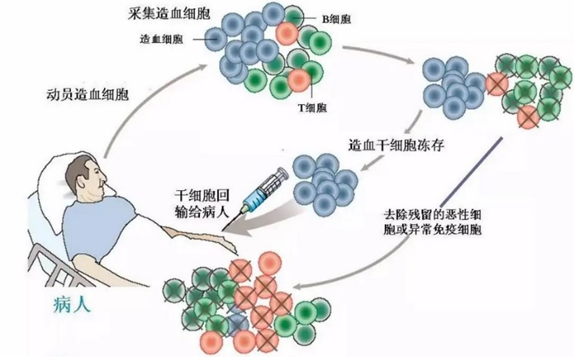
干细胞治疗可以治疗大部分血液系统恶性疾病。急性白血病患者,除急性早幼粒细胞性白血病以外,其他的急性白血病类型,只有造血干细胞移植治疗,才有可能彻底治愈,其他的化疗方法不能够彻底治愈,病人的复发率较高。对于淋巴瘤的患者,或者多发性骨髓瘤的患者,可以应用自体造血干细胞移植的方法来治疗,可以明显延长病人生存期,甚至达到治愈的目的。
图表7:干细胞移植治疗技术
数据来源:智银全球生物医药项目库
1.2.2 免疫细胞治疗
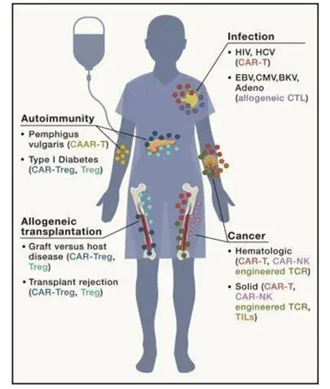
免疫细胞治疗,又称生物免疫细胞疗法,是指采集人体自身的或者异体的免疫细胞,经过体外培养或者修饰,使它的数量成千成倍的增多,靶向性杀伤功能增强,然后再回收到人体来杀灭血液及组织中的病原体、白细胞、突变的细胞,打破免疫耐受激活和增强机体的免疫功能,达到治愈疾病或者支持治疗的目的。
细胞免疫治疗不仅可以纠正细胞免疫功能低下的状态,促进宿主抗肿瘤免疫功能,同时还可以直接发挥抗肿瘤的作用。细胞免疫治疗还可以替代、修补或者改善细胞毒治疗引起的免疫功能受损。在临床上,细胞免疫治疗常常和化疗、放疗等技术进行配合,共同杀伤肿瘤细胞。
图表8:免疫细胞疗法治疗人类疾病
数据来源:CN-Healthcare、智银全球生物医药项目库
免疫系统的组成颇为复杂,包含细胞、抗体、补体等等。在细胞的部分可以进一步细分为初级免疫细胞(例如: NK自然杀手细胞、DC树突细胞、中性球、巨噬细胞),与次级免疫细胞(例如: CD4 T细胞、CD8 T细胞、B细胞)。此外,还有一些兼具初级免疫与次级免疫特性的细胞,最知名的就是gamma delta T 细胞、NKT细胞等。一般而言,初级免疫反应速度快,而次级免疫反应较长久且专一。免疫细胞疗法本身又分为很多种类:
LAK细胞免疫治疗
LAK细胞即淋巴因子激活的杀伤细胞。将外周血淋巴细胞在体外经淋巴因子白介素-2(IL-2)激活3~5天而扩增为具有广谱抗瘤作用的杀伤细胞。把LAK输给带瘤小鼠,不但使原瘤消退,还可以使已确立的转移瘤消失。LAK有广谱抗瘤作用,LAK与IL-2合用比单用LAK效果好,因为经IL-2激活的LAK在输入人体后仍需IL-2才能维持其杀伤活性。未来LAK细胞有以下几点发展思路:
提高LAK细胞的纯度,应用活化LAK细胞贴壁的特性,纯化粘附LAK(adherent-LAK,A-LAK)细胞。在IL-2诱导下数量可增加100倍,而且抗肿瘤转移的作用比LAK强20-50倍。
改变继承转移细胞在体内的分布,如改变注射细胞途径和方法,达到局部/区域继承免疫疗法的目的。
与其它细胞因子如IL-12、IFN、TNF-α和CSF联合治疗,增强LAK的杀伤活性,研究表明,抗CD3单抗与IL-2协同,能显著提高LAK细胞的数量和杀伤活性。应用CD3单抗诱导的杀伤细胞称为CD3抗体激活的杀伤细胞(CD3McAb activated killer cells,CD3AK),抗体含量在10-20ng/ml即可达到刺激杀伤活性的高峰,体外培养数天后即可出现明显的杀伤活性。CD3AK激活需要单核细胞存在,其增殖速度和细胞毒活性均高于LAK。所有的CD3+CD8+T细胞和1-6%CD3+CD4+T细胞可诱导出CD3AK。
NK细胞
自然杀伤细胞(Natural Killer Cell,NK)是先天性免疫系统的重要组成部分,是机体抗御感染和防止细胞恶性转化的重要免疫调节细胞。
NK细胞治疗具备广谱性,通常与化疗、放疗和手术治疗结合使用。在常规治疗方式将患者体内大多数肿瘤细胞清除后,进一步清除对化疗和放疗有抗药性的残留肿瘤细胞。NK细胞还能够深入组织和器官的内部,清除化疗、放疗和手术治疗达不到的区域的肿瘤细胞。NK细胞治疗总体有效率38%~70%,降低肿瘤复发风险率40%~50%。
最近20年关于癌症的根源最大的研究突破就是肿瘤干细胞的发现。意大利、法国和美国的研究小组分别独立发现NK细胞对多种肿瘤干细胞(比如神经母细胞瘤、黑色素瘤、口腔鳞状细胞癌、大肠癌的肿瘤干细胞)都能高效地进行杀伤,而且此杀伤作用比对普通癌细胞的杀伤作用更强。其可能的作用机制为:
肿瘤干细胞往往HLA-I分子的表达量很低,无法对NK细胞的活性起到有效抑制作用。
肿瘤干细胞表面的NK细胞激活受体相应的配体表达增加。比如在神经母细胞瘤干细胞表面高水平表达DNAM-1和NKp46配体, 在大肠癌干细胞中NKp30和NKp44配体高水平表达。
TIL细胞免疫治疗
肿瘤浸润淋巴细胞(Tumor Infiltrating Lymphocyte Cell,TIL)是一种从肿瘤组织中分离出的浸润淋巴细胞,是一群富含肿瘤特异性细胞毒性T淋巴细胞和NK细胞的异质细胞,具有高效、特异、副作用小等优点。TIL已应用于临床,主要治疗皮肤、肾、肺、头颈部、肝、卵巢部位的原发或继发肿瘤。研究表明从患者的新鲜肿瘤组织中对其进行体外分离扩增后,其具有很强杀瘤活性。其体外抗瘤效应比LAK强50~100倍以上,具有良好的应用前景。
卡替医疗是中国TIL/新抗原等创新免疫细胞治疗的代表性企业。ScTIL210是卡替医疗开发的第四代TIL,无需借助手术组织获取TIL细胞,而是从外周血采集单核细胞,分离肿瘤识别性T细胞,可显著提升治疗实施的便捷性,并进一步给予基因修饰,提升其克服肿瘤微环境和增加自我扩增的能力。该产品在前期的概念验证临床研究中已取得非常积极的疗效和安全性。
图表9:TIL疗法治疗原理
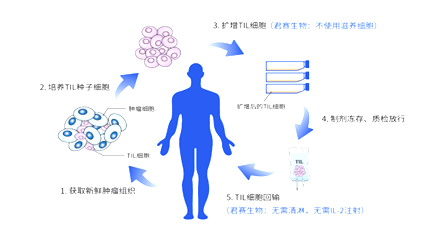
数据来源:知网、智银全球生物医药项目库
CD3细胞免疫治疗
CD3分子是由肽链以非共价键组成的复合分子,在成熟T细胞表面表达,对阻断急性同种异体排斥反应起主要作用。CD3分子与TCR组成复合受体分子,激活酪氨酸激酶,促使CD3分子免疫受体酪氨酸活化基序中的酪氨酸(Y)磷酸化。磷酸化的酪氨酸(pY)进一步磷酸化下游含酪氨酸的蛋白,从而引起激酶活化的级联反应,调控T细胞增殖和活化的靶基因,引起基因的表达和转录,T细胞由静止状态转为增殖和活化状态。
CD3分子具有稳定TCR结构和传递活化信号的作用。针对CD3分子的单克隆抗体能够激发或阻断T细胞活化信号转导,清除效应T细胞或诱导调节T细胞的产生,为治疗器官移植排斥和自身免疫性疾病提供了新的方法。
自20世纪90年代,CD3单克隆抗体开始应用于CIK细胞治疗,激活T细胞增殖及活化,在其他细胞因子IL2、IL1a等共同作用下,产生具有增殖速度快、杀瘤活性高、杀瘤谱广及非MHC限制性杀瘤特点的CIK细胞,对癌症、慢性白血病、肝病及神经性疾病等多种疾病治疗具有显著疗效。
目前代表性公司为阿斯利康、艾伯维等。TNB-486是一款靶向CD19/CD3的双特异性抗体,由阿斯利康通过收购TeneoTwo获得,目前正在进行临床1期试验。TNB-486通过与 CD19和 T 细胞上的 CD3 受体结合,激活 T 细胞并将其募集到表达 CD19 的肿瘤中,引发免疫反应。目前,TNB-486正用于治疗B 细胞血液系统恶性肿瘤,包括弥漫性大 B 细胞淋巴瘤和滤泡性淋巴瘤的适应症。
Epcoritamab由艾伯维和Genmab共同开发,可同时与T细胞上的CD3和B细胞上的CD20结合,并诱发T细胞介导的淋巴瘤B细胞杀伤。2022年06月14日艾伯维与Genmab 联合公布了Epcoritamab治疗复发/难治性B细胞非霍奇金淋巴瘤NHL-1 2期临床试验大细胞淋巴瘤扩展队列的初步结果。该研究队列包括既往接受过中位3线治疗的157例复发/难治性LBCL患者,显示总体缓解率(ORR)为63%,完全缓解率(CR)为39%。
CIK细胞免疫治疗
CIK细胞也就是细胞因子诱导杀伤细胞(cytokine-inducedkiller),是国内应用最广泛的肿瘤过继细胞免疫治疗效应细胞。1991年美国斯坦福大学Schmidt Wolf等首次发现在多种细胞因子(γ-干扰素、CD3单抗、白介素-1和白介素-2)作用下,外周血淋巴细胞可以被定向诱导并大量增值成为肿瘤杀伤细胞。与LAK很相似,CIK细胞疗法也是从患者或者患者亲属外周血提取免疫细胞,体外激活后输回给患者,主要区别在于CIK细胞疗法采用IL-2以外的其它因子,比如IFN-γ。但目前还没有大规模临床实验验证这种方法的有效性。
CIK细胞疗法的代表公司是韩国的Green Cross Cell Corporation(GCC),其细胞免疫治疗产品为Immuncell-LC。
ImmunCell-LC在2007 年获得韩国KFDA 批准,并在2018年获得美国FDA孤儿药称号。它被用作 肝细胞癌、脑肿瘤和胰腺癌 切除后的辅助治疗,通过清除残余肿瘤细胞实现治疗。 ImmunCell-LC的制备,通过分离外周血单个核细胞 (PBMC) ,然后用IL-2和抗CD3抗体一起刺激培养,最后得到活化的混合的一群异质性T细胞。
DC-CIK细胞免疫治疗
DC-CIK (或DC/CIK)是指与DC细胞共培养的CIK细胞。细胞因子诱导的杀伤细胞(cytokine-induced killers,CIK)能在体外被诱导并大量增殖。树突状细胞(dendritic cell,DC)是有效的专职抗原提呈细胞,成熟的DC可以通过Ⅱ型组织相容性抗原(MHC-Ⅱ)等途径提呈肿瘤抗原,有效抵制肿瘤细胞的免疫逃逸机制。CIK细胞和DC细胞是细胞免疫治疗的2个重要组成部分, DC与CIK能相互作用,诱发免疫应答,两者联合可确保高效的免疫反应。也就是说DC识别病原,激活获得性免疫系统,而CIK通过发挥自身细胞毒性,分泌细胞因子杀伤肿瘤细胞。
DC-CIK细胞疗法的代表公司是上海安集协康生物技术股份有限公司,一家从事细胞研发、生产、销售、存储及服务的高新技术企业。公司专注于细胞新药研发,致力于为中枢神经系统顽症患者提供全方位细胞解决方案。据安集协康介绍,公司目前拥有高效率的免疫细胞分离技术、DC-CIK 细胞、NK 细胞定向培养技术,且细胞活率、细胞总数、内毒素含量均优于国家标准。
γδT细胞免疫治疗
γδT细胞是介于特异性免疫与非特异性免疫之间的一种特殊类型的免疫细胞,主要分布于皮肤和黏膜组织,一般不超过T细胞总数的5%,γδT细胞处于机体免疫防护系统的第一线,在抗肿瘤免疫中具有重要的作用,具有细胞毒性和分泌多种细胞因子及趋化因子的功能。
由于γδT细胞具有独特的抗原识别特性和组织分布,使其成为最合适的早期抗肿瘤效应细胞之一,与其他天然免疫细胞构成机体防御恶变的第一道屏障,在抗肿瘤免疫监视和免疫效应中发挥着重要的作用。
2022年6月23日,生物技术公司Acepodia宣布,其在研同种异体γδ T细胞候选产品——ACE1831的IND申请已获得美国FDA批准,用于治疗非霍奇金淋巴瘤患者。这是Acepodia首款进入临床阶段的同种异体γδ T细胞候选产品,是该公司的一个重要里程碑。
CAR-T细胞免疫治疗
虽然DC-CIK疗法更容易获取和扩增,但CAR-T细胞疗法是以肿瘤特异性T细胞作为效应细胞,比CIK细胞具有更强的抗肿瘤活性,也就是说特异性更强。CAR-T(Chimeric Antigen Receptor T-Cell)又称嵌合抗原受体T细胞疗法,是通过细胞基因工程,利用识别肿瘤相关抗原抗体的嵌合蛋白与患者体内提取到的T细胞进行修饰,经过纯化和大规模扩增之后的T细胞导入回患者体内后能特异性识别肿瘤细胞相关抗原靶点,激活人体免疫反应,杀灭肿瘤细胞。
图表10:CAR-T治疗的流程

数据来源:德州大学西南医学中心、智银全球生物医药项目库
这种方法目前已经发展出嵌合抗原受体,也就是说如果在癌细胞表面找不到我们想要靶向的单个独特抗原,就可以转而构建识别肿瘤细胞两种不同抗原的T细胞,这样T细胞只会攻击具有两种抗原的细胞,而放过只表达一种抗原的正常细胞,构建出对于患者而言既有效且安全的靶向性免疫治疗。
CAR-T疗法目前主要应用在末线血液恶性肿瘤治疗中,与传统血液瘤治疗相比,CAR-T疗法由于只需一次注射,一次用药,治疗周期短,对患者的创伤小,副作用小,治疗周期短,治疗精准度高,但同时使用范围局限,费用高。
据药融云数据库,目前全球car-t疗法已有7款获批上市,分别是诺华的Kymriah(tisagenlecleucel);Gilead/Kite的Yescarta(axicabtagene ciloleucel);吉利德的Tecartus(brexucabtagene autoleucel);BMS的Breyanzi(lisocabtagene maraleucel);BMS和蓝鸟生物的abecma(idecabtagene vicleucel);复星凯特的阿基仑赛注射液;药明巨诺的瑞基仑赛注射液。除了BMS和蓝鸟生物的abecma为APRIL靶点,其余都是CD19靶点。
2021年末,北恒生物宣布其自主研发的CTA101 UCAR-T(通用型CAR-T)细胞注射液产品新药临床试验申请获CDE受理(受理号:CXSL2101509)。至此国内“现货型”异体来源的CAR-T创新药崭露头角。
通用型 CAR-T 疗法又被称为“现货”(off-the-shelf),是从健康的捐赠者那里收集 T 细胞或从 iPSC 中衍生的 T 细胞,经过工程化设计表达 CAR,以识别和摧毁癌细胞。
图表11:自体 CAR-T 与通用型 CAR-T 差异
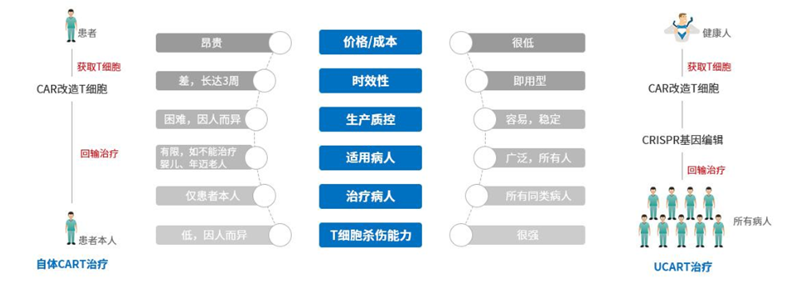
数据来源:北恒生物官网、智银全球生物医药项目库
不同自体 CAR-T 采集自患者本身的 T 细胞,通用 CAR-T的 T 细胞源自健康供体,经体外大规模扩增后制备成 CAR-T 细胞后进行低温保存,然后用于多个患者。基于此,通用 CAR-T可为患者提供现成的细胞疗法,无需交叉配型及长时间等待。另外,相比自体 CAR-T,通用 CAR-T 的制备可简化工程细胞的制造过程,其更适用于标准化和规模化生产,大大降低当前自体CAR-T 疗法的制造成本,减轻患者的治疗负担。
1.3 细胞治疗的历史
1968年,世界上第一例用于造血功能障碍的骨髓移植术完成,其有效成分是造血干细胞。
1988年,人类胚胎干细胞在体外生长和增殖成功,同年,肿瘤浸润淋巴细胞(TIL)疗法首次在临床上用于转移性黑色素瘤治疗达到了60%的客观有效率(ORR)。
1997年,FDA首次批准了自体软骨细胞疗法(Carticel)用于修复由急性或重复性创伤引起的症状性股骨髁软骨缺损。
2010年,首个树突状细胞(Dendritic cell,DC)癌症疫苗Provenge用于治疗激素难治性前列腺癌获得FDA批准。
2017年,过继性细胞疗法(Adoptive cell therapy,ACT)在肿瘤免疫治疗上取得了巨大成功,两款CAR-T产品Kymriah和Yescarta上市。
2021年由复星凯特引进的Yescarta(阿基仑赛注射液)被国家药品监督管理局(NMPA)批准,成为国内首款上市的CAR-T产品,随后药明巨诺的瑞基奥仑赛也被批准,成为我国首款按1类生物制品获批的CAR-T产品以及我国第二款获准上市的CAR-T产品。
图表12:细胞治疗发展历程
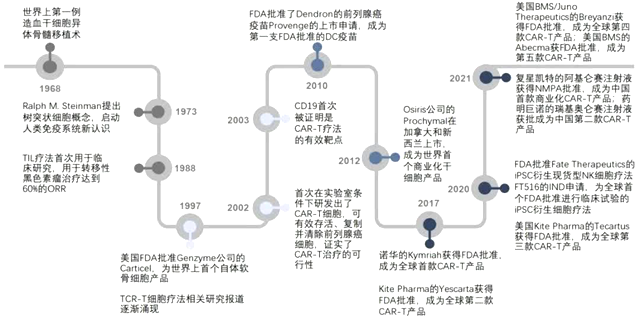
数据来源:创药网、智银全球生物医药项目库
二、细胞治疗药品情况
截止2022年初,全球经批准的细胞治疗产品共32款,包括12种免疫细胞和21种干细胞。值得注意的是,许多已经批准的细胞疗法正在开发新的适应症。
2.1 T细胞相关产品
截止2022年初,全球范围内共批准9种T细胞相关产品,其中美国FDA批准上市6 款CAR-T 产品,中国NMPA批准上市2款CAR-T产品,韩国KFDA批准上市1款CIK产品。适应症集中在大B细胞淋巴瘤(LBCL)、难治性大B细胞淋巴瘤(DLBCL)、MM(多发性骨髓瘤)、套细胞淋巴瘤(MCL)、非霍奇金淋巴瘤(NHL)。
图表13:各国获批免疫细胞(T细胞)一览
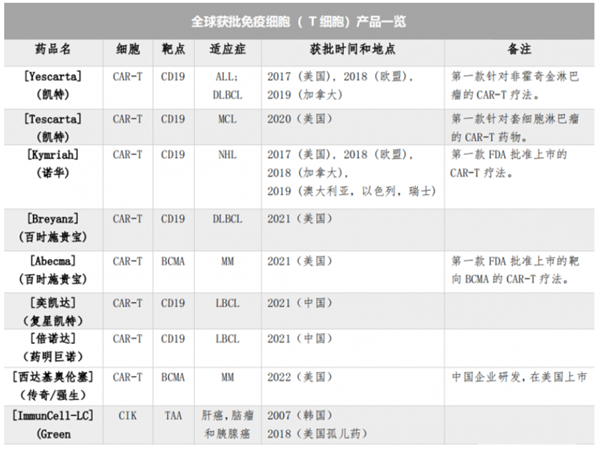
数据来源:GlobalOncologist、智银全球生物医药项目库
CAR的两个基本部分包括用于识别癌细胞表面抗原的细胞外靶点结合域和细胞内信号部分,由共同刺激和激活域组成,启动包括激活、扩增和细胞杀伤在内的过程。值得注意的是,所有经批准的CAR-T产品都是自体的,并且含有靶向CD19的CAR。
靶向BCMA的CAR-T疗法:BCMA(B cell maturation antigen):又被称作TNFRSF17或CD269,主要在浆细胞和成熟B淋巴细胞中表达,在其它的正常人体细胞中基本检测不到。此外,BCMA是MM细胞系上最具选择性表达的受体,其表达量随着B细胞的分化而逐渐增加,在多发性骨髓瘤的疾病进程中也逐步递增。因此,BCMA是治疗MM的理想靶点。小鼠实验发现,BCMA过表达可诱导蛋白激酶B、丝裂原活化蛋白激酶(MAPK)和核转录因子kB(nuclear factors kB,NF-kB)信号级联增强促进MM细胞的生长和存活,从而使MM进展加快;而BCMA表达下调可以显著减少MM集落的形成和降低MM细胞成活率。
图表14:国内外临床试验阶段BCMA CAR-T产品一览
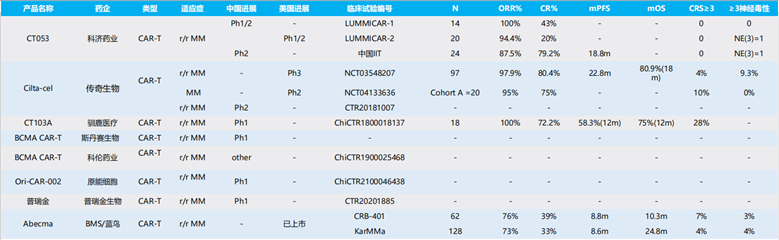
资料来源:Insight数据库、智银医药资料库
2021年3月,美国食品药品监督管理局(FDA)批准百时美施贵宝(BMS)与蓝鸟生物(bluebird bio, Inc)合作开发的靶向BCMA的CAR-T细胞疗法Idecabtagene Vicleucel (ide-cel,bb2121;商品名:Abecma)上市,用于4线治疗(包括免疫调节剂、蛋白酶体抑制剂以及抗体类药物治疗)后的复发或难治性多发性骨髓瘤的成年患者。值得注意的是,这是全球首款靶向BCMA的CAR-T细胞疗法。目前国内厂家的靶向BCMA的CAR-T细胞疗法产品都在临床试验中,最快的是传奇生物的Cilta-cel处于临床三期试验中。
靶向Claudin18.2的CAR-T疗法:Claudin18.2是位于细胞膜上的一个跨膜蛋白,表达于正常胃粘膜组织中,以及高度选择性、稳定地表达于特定肿瘤组织,参与肿瘤细胞的增殖分化和迁移,例如胃癌、食管癌、胰腺癌等癌症组织。这使其成为潜在的抗肿瘤药物有效分子靶点。
图表15:Clauding 18.2在不同实体瘤中的表达水平
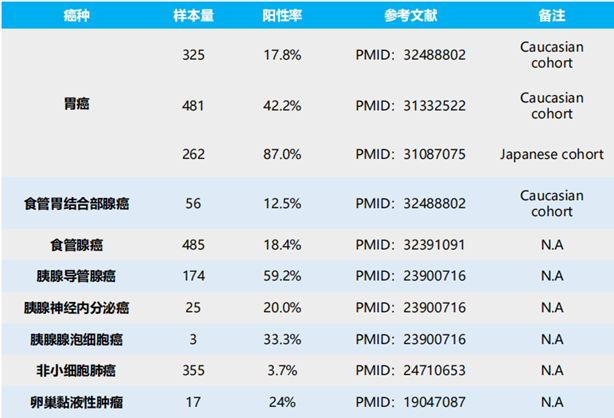
资料来源:PubMed、Cancer research、智银医药资料库
近些年来靶向Claudin18.2的创新疗法竞争逐渐激烈。目前,针对claudin18.2的药物开发中进展最快的是德国Ganymed公司开发的IMAB362(Zolbetuximab,claudiximab)。IMAB362是一种人鼠嵌合型抗体,能特异性靶向Claudin18.2亚型的单抗,FAST随机工期临床研究显示,标准化疗基础上增加抗Claudin18.2靶向治疗,能改善Claudin18.2表达阳性晚期胃癌患者的PFS和OS。另外,国内科济公司的AB011、迈博斯生物的TST001、奥赛康药业的ASKB589,都是靶向CAR-Claudin18.2细胞疗法,都已获准在中国开展I期临床试验。其中,传奇公司的LCAR-C18S和科济公司的AB011都选择到上海市东方医院开展I期临床试验。略有不同的是LCAR-C18S是针对既往接受过胃全切除术/胃大部切除术后的复发或转移性晚期胃腺癌,因为Claudin18.2在正常胃组织有表达,对没有行胃切除手术的患者有可能存在脱靶现象。
图表16:目前国内外处于临床阶段的Claudin18.2靶向创新疗法
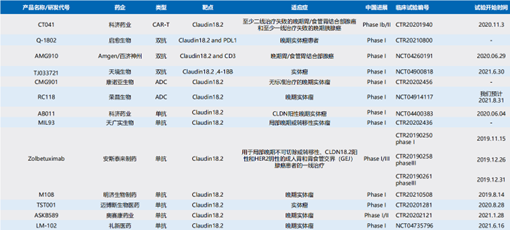
资料来源:Insight数据库、智银医药资料库
2.2 DC细胞相关产品
DC 疫苗是免疫细胞治疗另一个活跃领域,主要采用自体细胞。目前全球市场上共有3种DC产品获上市批准。
图表17:各国获批DC产品一览
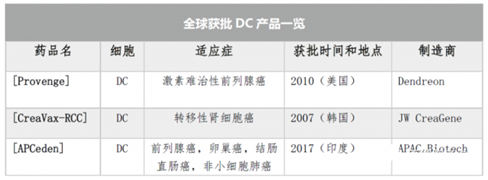
数据来源:GlobalOncologist、智银全球生物医药项目库
2010年,Provenge获得美国FDA批准,用于治疗激素难治性前列腺癌。Provenge是美国FDA批准的第一个DC疗法,也是FDA批准的唯一的DC疗法。
2007年,自体DC疗法CreaVax被韩国KFDA批准,用于肾细胞癌的治疗。
2017年,自体DC疗法APCeden被印度CDSCO批准,用于治疗前列腺癌、卵巢癌、结直肠癌和非小细胞肺癌等疾病的治疗。
2.3 干细胞相关产品
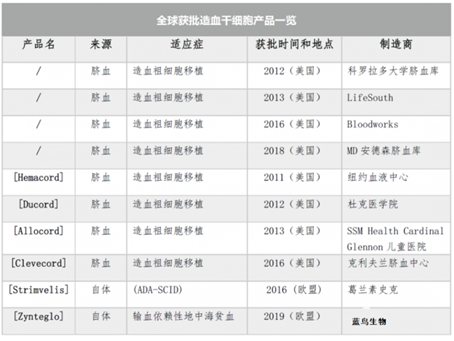
截至目前,全球共有21种干细胞产品已在全球获得批准,其中12种获得美国FDA或欧洲EMA的批准。其余9种产品主要在亚洲获得批准。获批产品主要是由造血干细胞或间充质干细胞组成。
目前全球批准的造血干细胞疗法共有 10 种。其中美国FDA批准 8 种脐血产品,均用于造血干细胞移植的治疗。欧盟EMA 批准 2 种基于自体造血干细胞的基因疗法,Strimvelis 用于腺苷脱氨酶缺乏症(ADA-SCID),Zynteglo 用于治疗输血依赖性地中海贫血症。
脐血造血干细胞比其他来源(如骨髓,外周血)的异体造血干细胞更有优势。因为脐血获得更容易,对人类白细胞抗原(HLA)的耐受性更高错配,GVHD的风险较低。此外,Strimvelis和Zynteglo均是EMA批准的基于自体造血干细胞的基因疗法。
2016年,EMA批准Strimveli,适用于腺苷脱氨酶缺乏症(ADA-SCID),一种由腺苷脱氨酶(ADA)基因编码突变引起的免疫缺陷疾病。
2019年,EMA批准Zyntegl, 适用于治疗输血依赖性地中海贫血,这是一种由β-珠蛋白基因突变引起的遗传性疾病,导致成人血红蛋白显著减少或缺失。
图表18:各国获批造血干细胞产品一览
数据来源:GlobalOncologist、智银全球生物医药项目库
目前全球批准的间充质干细胞产品共有 10 种,但没有一款获得美国FDA 的批准。根据作用机制和批准的适应症,MSCs产品可分为两大类:组织修复和免疫调节。其中,有三种MSCs产品已被批准用于组织修复应用。
图表19:各国获批间充质干细胞产品一览
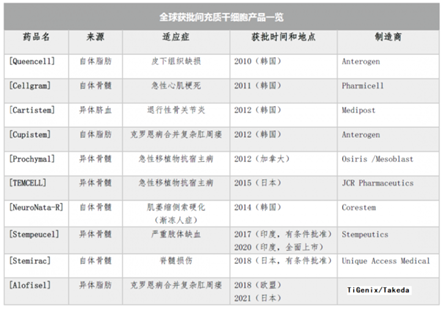
数据来源:GlobalOncologist、智银全球生物医药项目库
通过各国获批间充质干细胞产品一览可看出韩国在干细胞领域给予支持的态度,获批的产品数量占比最多。
2010年,韩国KFDA批准一种自体脂肪来源的细胞产品Queencell,适用于皮下组织缺损的治疗。不过,Queencell并非由单一MSCs组成,而是由MSCs、周细胞、肥大细胞、成纤维细胞和内皮祖细胞的混合细胞组成,类似于SVF。
2011年,韩国KFDA批准基于MSCs的组织修复产品Cellgram, 适用于治疗急性心肌梗死。
2012年,韩国KFDA批准一种基于MSCs的组织修复产品Cartistem,适用于重复性和/或创伤性软骨退行性病变,包括退行性骨关节炎以及一种自体脂肪来源MSCs产品Cupistem,适应症是克罗恩病复杂肛周瘘。
Alofisel,一种异体脂肪来源MSCs产品。EMA批准的唯一MSCs产品,适应症是克罗恩病复杂肛周瘘。作用机制主要是MSCs抑制活化淋巴细胞增殖从而减少促炎细胞因子产生。
Prochymal,一种异体骨髓来源MSCs产品。2012年获得加拿大CFIA批准,适应症是儿童类固醇难治性急性GVHD。
值得注意的是,在3期临床试验中,Prochymal在SR-aGvHD儿童患者首次类固醇治疗失败后使用,显示出作为一线治疗的安全性、耐受性和有效性。然而,FDA拒绝批准,FDA给出的理由是试验数据来自单臂试验而不是随机试验,建议至少再做一次随机试验的数据。
其中一些MSCs产品(例如Cellgram, Cartistem、Prochymal)正在当前临床试验中评估其他适应症,包括酒精性肝硬化、COVID-19引起的急性呼吸窘迫综合征(ARDS)和软骨损伤。
2.4 NK细胞疗法相关产品
由于CAR-T疗法的些许不足(CAR-T细胞治疗在自体和异体环境中都存在包括毒性问题在内的局限之处),CAR-NK细胞疗法开始受到业内关注。
CAR-NK细胞疗法是通过基因工程的改造,将识别靶细胞(比如肿瘤细胞)表面抗原的抗体或受体与激活免疫细胞所需要的信号分子相连接,从而激活NK细胞,让它对肿瘤细胞进行特异性的攻击。
相比于CAR-T,CAR-NK细胞疗法具有独特的应用优势:
① 与 T 细胞相比,NK细胞具有高度的细胞毒性效应,可以以非抗原特异性方式杀死其靶标,而不会引起移植物抗宿主病(GCHD);
② NK细胞缺乏克隆扩增以及在数天至数周内的免疫介导排斥反应,使得威胁患者生命的毒CRS的可能性降低;
③ NK细胞具备更多的肿瘤杀伤途径,如执行细胞脱粒、激活凋亡途径和介导ADCC功能。
图表20:NK细胞作用机制
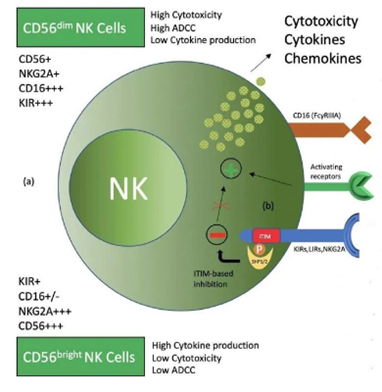
数据来源:智银全球生物医药项目库
临床前研究表明,CD19-CAR-NK细胞对血液系统肿瘤有很高的应答率,并且易于制造,与目前的CAR-T细胞免疫疗法相比,这是一个巨大的进步。除CD19外,淋巴瘤和白血病的CAR-NK细胞临床研究也针对CD7 (NCT02742727) 和CD33 (NCT02944162) 。
图表21:针对血液恶性肿瘤的CAR-NK细胞临床试验
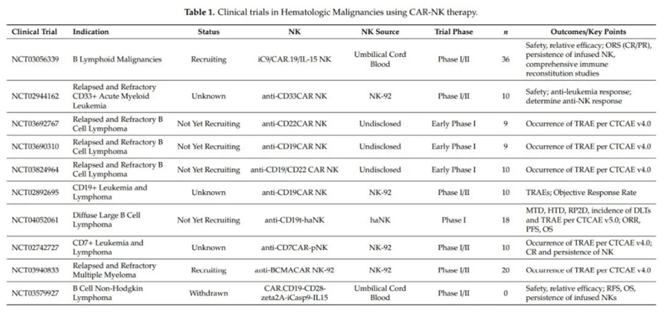
数据来源:ClinicalTrials.gov、智银全球生物医药项目库
近两年来NK细胞疗法发展迅速,有较多公司在开发CAR-NK,另有一些是开发单纯的NK细胞,此外也有贝斯昂科等公司开发了特色的super-NK细胞。Super-NK类主要是在NK细胞上下功夫,经过基因工程处理后的NK细胞在功能性上明显增强,对血液瘤和实体瘤具有显著的杀伤能力;iPSC-CAR-NK则是CAR-NK的升级版,iPSC细胞所具备的无限增殖能力,可提供大量细胞来源。
三、细胞治疗行业分析
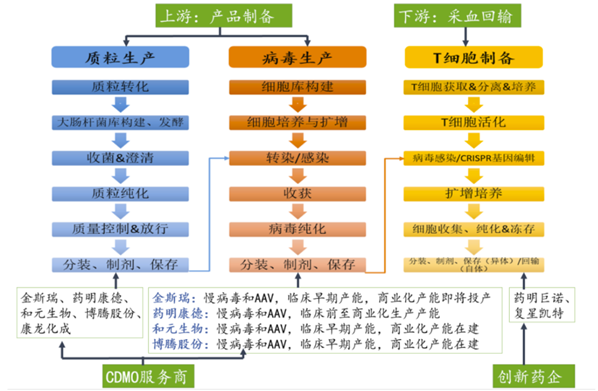
3.1 细胞治疗产业链
整个细胞治疗产业大体上分上游、中游和下游,上游是细胞存储和设备试剂耗材;中游是技术研发和新药的转化;下游是CDMO和临床应用。
图表22:细胞治疗产业链上下游
数据来源:智银全球生物医药项目库
上游的细胞存储是中国目前整个细胞产业链里面发展最成熟,市场竞争最激烈的领域,设备、耗材和试剂在未来可能是潜在增长的领域。
中游无论是干细胞药物研发还是以CAR-T为代表的免疫细胞药物研发,已经有很多企业都在参与。他们的盈利模式或是向医院提供细胞技术体系来收取服务费和专利费,或是为患者提供个体化治疗,再按一定的比例和医疗机构分享治疗费用。国外代表公司有:Juno、Kite、诺华、辉瑞、梯瓦、罗氏等。国内代表公司有:中源协和、西比曼、合一康、博生吉、安科生物、源正细胞等。
开展下游产业的模式一般有两种:一种为三甲医院自行开展此业务,另一种为三甲医院和企业合作,企业提供技术服务和技术支持,医院提供临床平台进而实施治疗行为。下游的CDMO逐渐开始出现,规模也越做越大。未来在临床上,随着药物获批,技术转化和成果的产生,如何能够提高患者的治疗效果以及远期的生存质量,是临床上需要去改进的地方。
3.2 需求动因
伴随着老龄化的加剧,世界范围内癌症患者的数据开始不断增加。肿瘤是人类疾病第一大杀手。肿瘤发病率和死亡率持续增高将造成严重社会负担,由此驱动作为肿瘤治疗的重要手段之一的 CAR-T、 TCR -T等细胞治疗的强大需求。
据 2022 年美国癌症协会( ACS )统计,在过去的 28 年里,美国病人死于癌症的风险持续降低, 2022 年美国将新增190万例癌症病例和近 61 万例癌症死亡病例。从 2015 年至 2019 年,美国癌症死亡风险每年下降约 2 %。
图表23:美国癌症男性和女性发病率
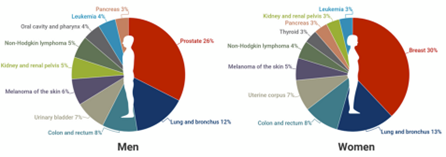
数据来源CA、智银全球生物医药项目库
作为世界上的人口大国,中国的癌症数据并不容乐观。近年来中国癌症医疗负担不断加大,中国癌症发病率,死亡率均居全球第一,中国已经成为名副其实的癌症大国。据最新的报告,全球每年新增 1 800 万癌症病例及 960 万癌症死亡病例,其中我国新增病例数占 380 . 4 万例、死亡病例数占 229 . 6 万例。全球每新增 1 00 个癌症患者中,中国人就占21 个。
图表24:2020年各国癌症死亡病例数
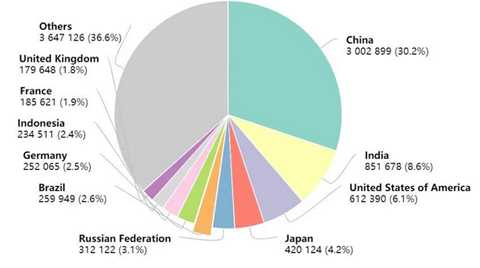
数据来源:healthcare、智银全球生物医药项目库
2020年中国癌症新发病例457万例,新发病例数前十的癌症分别是:肺癌82万,结直肠癌56万,胃癌48万,乳腺癌42万,肝癌41万,食管癌32万,甲状腺癌22万,胰腺癌12万,前列腺癌12万,宫颈癌11万,这十种癌症占新发癌症数的78%。
图表25:2020年中国新发病例数前十的癌症
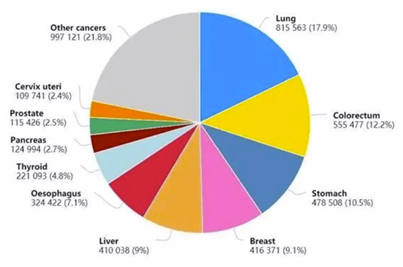
数据来源:GlobalOncologist、智银全球生物医药项目库
据不完全统计, 2012 年我国新增癌症病例约 307 万例,其中约 220 万人死于癌症,预计到 2030 年我国新增癌症病例将达到 500 万人,死亡人数将达到 386 万人。
图表26:全球及我国癌症发病、死亡人数及预测
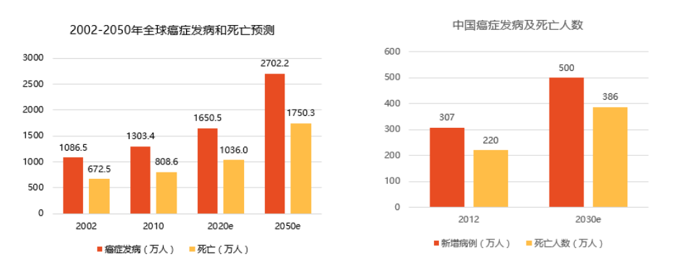
数据来源:全国肿瘤登记中心、智银全球生物医药项目库
2022年2月,国家癌症中心发布最新一期的全国癌症统计数据,在不同的癌症类型中,死亡趋势呈上升的分别为:
男性:前列腺癌、结直肠癌、胰腺癌、白血病;女性:宫颈癌、甲状腺癌、乳腺癌。死亡趋势呈上升的分别为:食管癌、胃癌、肝癌、肺癌。
图表27:不同癌种死亡趋势
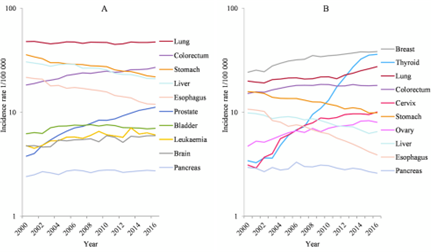
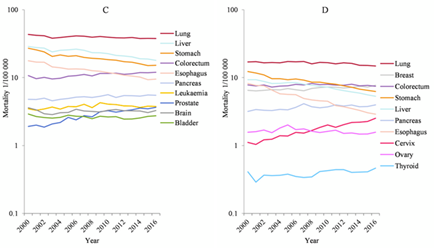
数据来源:GlobalOncologist、智银全球生物医药项目库
3.3 行业增速
我国细胞治疗行业相对于国外起步较晚,但我国细胞治疗的市场需求是巨大的。Frost&Sullivan数据显示,2016-2021年,中国抗肿瘤药物的市场规模从1250亿元增长至2440亿元,罕见病药物的市场规模由32.5亿元增长至110.5亿元,预计到2030年,中国抗肿瘤药物的市场规模将达到4825亿元,罕见病市场规模预计能达到600-900亿元人民币。
干细胞疗法方面,根据QYResearch的研究数据,2020-2026年,中国干细胞医疗产业市场规模复合增长率约为15%,未来几年,中国干细胞医疗产业市场规模在全球市场规模中的占比将进一步上涨。前瞻保守估计,到2026年,中国干细胞医疗产业市场规模将达到325亿元。
图表28:2022-2026年中国干细胞医疗产业市场规模预测
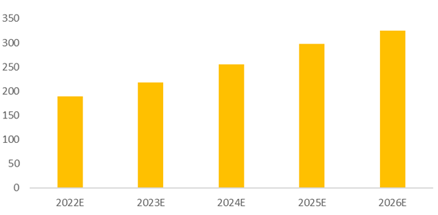
数据来源:QYResearch、智银全球生物医药项目库
CAR-T细胞疗法方面,据统计,2019~2024年CAR-T疗法全球市场规模复合年增长率为55.0%,2024年将增长至66亿美元;2024年至2030年复合年增长率预计为22.1%,2030年将进一步增长至218亿美元。由此可见,目前CAR-T市场远未饱和,亟待企业挖掘。
中国CAR-T细胞疗法市场规模将增长至2024年的人民币53亿元,并进一步增长至2030年的人民币289亿元,2022年至2030年的复合年增长率为45.0%。
图表29:中国CAR-T细胞疗法市场规模预测
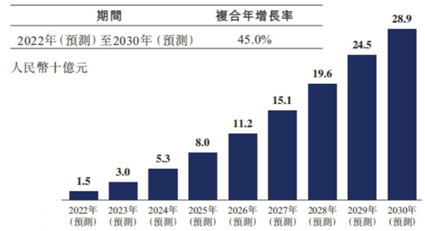
数据来源:Frost & Sullivan 、智银全球生物医药项目库
2021年,全球细胞疗法融资TOP 10企业分别为基因疗法初创公司(ElevateBio)、细胞疗法新锐(AllogeneTherapeutics)、专注于开发自身免疫和退行性疾病调节性T细胞(Treg)疗法(SonomaBiotherapeutics公司)、一家致力于免疫肿瘤学的服务商(PACTPharma)、ViaCyte(美国再生医学公司)、OrchardTherapeutics、NGMBiopharmaceuticals、eGenesis公司、上海细胞治疗集团(hanghaiCellTherapyGroup)、GyroscopeTherapeutics控股公司,细胞疗法募集金额分别为8.45亿美元、4.2亿美元、3.35亿美元、3.2亿美元、3.115亿美元、2.91亿美元、2.9亿美元、2.65亿美元、2.602亿美元、2.486亿美元。可以看出,全球细胞疗法融资企业TOP10除上海细胞治疗集团(hanghaiCellTherapyGroup)外,其它企业均来自美国。
图表30:2016-2021年全球细胞疗法融资事件及金额
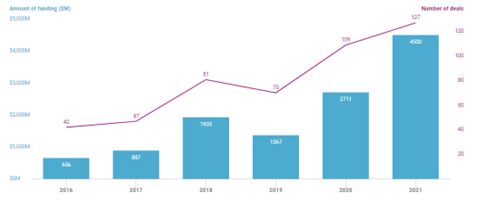
资料来源:CBInsights、智银医药资料库
截至2021年11月,全球细胞疗法领域投资机构TOP10依次为ARCHVenturePartners、AlexandriaVenturelnvestments、MPMCapital、RACapitalManagement、DomainAssociates、NewEnterpriseAssociates、MorgenthalerVentures、ThecolumnGroup、JLabs、casdinCapital,全部来自美国,可以看出美国企业对细胞疗法的重视。
图表31:全球细胞疗法领域投资机构TOP 10
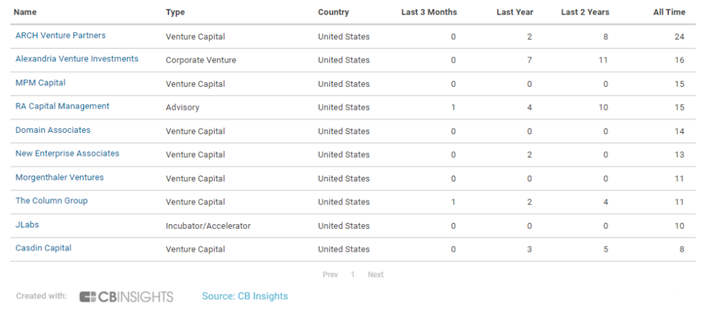
资料来源:CBInsights、智银医药资料库
3.4 全球细胞治疗管线情况
截至2022年4月15日,全球肿瘤免疫在研管线中有2756种处于活跃研发中的细胞治疗产品,相比2021年的2031种增加35.7%。2020年和2021年的增速分别为60.7%和43.3%。
图表32:2018-2022细胞治疗管线数量变化
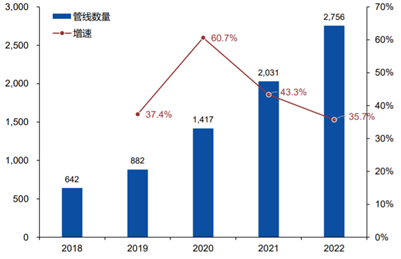
数据来源:Landscape of cancer cell therapies、trends and real-world data、智银全球生物医药项目库
同样的趋势也体现在细胞治疗靶点数量的变化中。2022年细胞治疗靶点460个,相比2021年的351个增加31.1%。2020年和2021年的增速分别为34.1%和41.5%。
图表33:2018-2022细胞治疗靶点数量变化
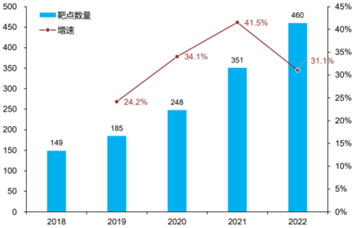
数据来源:Landscape of cancer cell therapies、 trends and real-world data、智银全球生物医药项目库
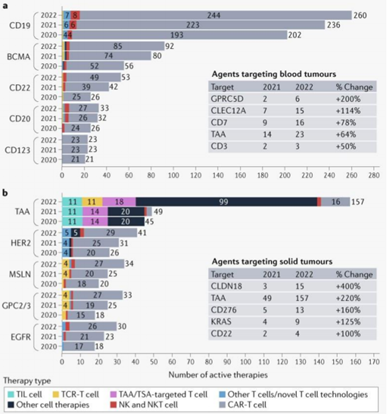
在血液系统恶性肿瘤中,细胞治疗热门靶点仍然集中于CD19、BCMA 和 CD22,相关的管线分别达到260个、92个和53个。血液瘤中的部分新靶点管线显着增长,例如GPRC5D (+200%)、CLEC12A (+114%) 和CD7 (+78%),分别达到6个、15个和16个。
在实体瘤中,肿瘤相关抗原(TAA)、HER2和间皮素 (MSLN)仍然是最热门的靶点,相关管线分别达到157个、41个和34个。实体瘤中增长迅速的新靶点包括CLDN18 (+400%)、CD276 (+160%) 和 KRAS (+125%),分别达到15个、13个和9个。TAA相关管线也显著增加,相比2021年增长220%。
图表34:2020-2022细胞治疗热门靶点
数据来源:GlobalOncologist、智银全球生物医药项目库
在不同细胞治疗类别中,CAR-T细胞疗法仍是管线最多的种类。2022年共有1432 个CAR-T在研管线,同比增长24%。 基于NK细胞的疗法数量达到283个,同比 增长55%。 各种非T细胞或NK细胞的其他细胞疗法, 如树突状细胞、干细胞或骨髓细胞等, 2022年增长为129%,达到422种。
图表35:2020-2022不同类型的细胞治疗管线数量及所处阶段
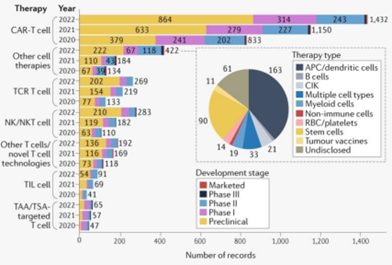
数据来源:《Nature Reviews Drug Discovery》、智银全球生物医药项目库
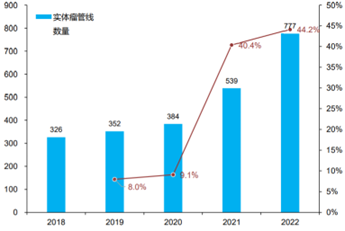
细胞疗法试验的数据显示,截至2022年4月,有1795项处于活跃研发状态的细胞疗法试验,比2021年的1353个增加33%。针对血液瘤的细胞疗法临床试验2022年达到1018个,相比2021年的814个增加25.1%。
图表36:针对实体瘤的细胞治疗靶点数量变化
数据来源:ClinicalTrials.gov、智银全球生物医药项目库
针对实体瘤细胞疗法的临床试验显著增长,2022年达到777个,占所有试验的43%,相比2021年539个增加44.2%,增速高于血液瘤临床增速。
图表37:针对血液瘤的细胞治疗管线数量变化
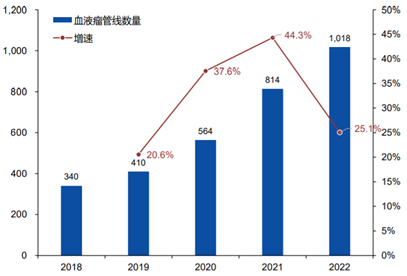
数据来源:《Nature Reviews Drug Discovery》、智银全球生物医药项目库
从研发地区来看,中国紧跟美国,处于研发管线主导地位。中国开展的细胞治疗研究由2020年498项增长至2021年695项,增速达到40%,超过美国。此外国内企业研究占比由53%增长至60.4%,逐渐从学术研究走向临床研究。
图表38:全球细胞治疗研发情况(按地区与支持机构划分)
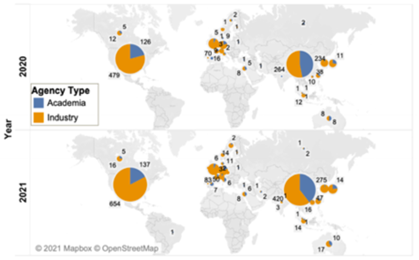
数据来源:wind、nature、智银全球生物医药项目库
国内的传奇生物、科济药业、博生吉、吉凯基因、茂行生物、驯鹿医疗、华夏英泰、百暨基因、优瑞科(北京)生物等公司CAR-T疗法在研管线超过10个。
目前国内外针对的靶点主要集中在CD19、APRIL、CD20和CD22等,全球已经上市的产品大部分针对CD19,其中有一款是针对APRIL的。以下是国内的在研管线靶点分布情况。
图表39:国内的在研管线靶点分布

数据来源:药融云、智银全球生物医药项目库
目前国内的在研管线,从适应症来看,主要集中在急性B淋巴细胞白血病、B淋巴细胞瘤,非霍奇金淋巴瘤、多发性骨髓瘤、急性淋巴白血病等血液瘤,针对实体瘤的占比3.67%。
图表40:在研管线适应症分布
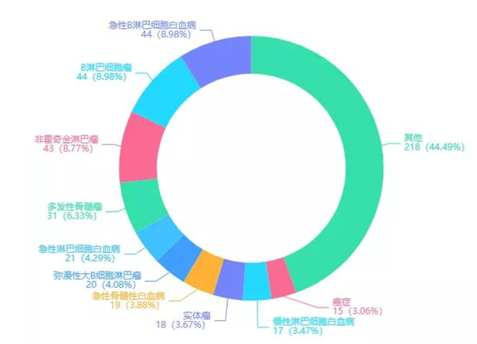
数据来源:药融云、智银全球生物医药项目库
3.5 国外细胞疗法主要公司
3.5.1 Sana Biotechnology
总部位于美国西雅图的Sana Biotechnology是一家基因、细胞疗法明星公司,成立于2018年。公司专注于开发不会发生免疫排斥反应的通用型细胞疗法,以及利用融合(fusogen)技术,无需在体外进行基因工程改造,即可在患者体内直接将 T 细胞转化为 CAR-T 细胞的疗法。此外,公司还在开发能对不同细胞进行精准基因编辑的工具。
Sana由基于CRISPR核心技术改造CAR-T和TCR-T疗法的先驱公司Juno Therapeutics原班人马创办,其创始团队、管理团队、科学家团队和董事会的阵容强大:
公司总裁兼首席执行官Steve Harr,曾担任 Juno 的首席财务官兼企业发展部主管。
联合创始人兼董事会主席Hans Bishop是原 Juno 联合创始人兼首席执行官,同时还是肿瘤早筛巨头 GRAIL 的首席执行官,在生物技术行业拥有 30 多年从业经验。
开发主管和首席医学官Sunil Agarwal曾是 Juno 的研发负责人,还曾在基因泰克担任临床开发主管。创始科学家团队则包括华盛顿大学医学院蛋白质设计研究所所长David Baker 博士、哈佛医学院副教授Chad Cowan等。
图表41:部分管理团队成员

数据来源:公司官网、智银全球生物医药项目库
技术方面, Sana拥有体内和体外两大细胞工程平台:
体内细胞工程平台能够进行细胞特异性基因有效载荷在体内的递送,这可能改变许多疾病的治疗方法。例如,虽然利用几种基因编辑技术来改变血红蛋白的表达并为镰状细胞病和β地中海贫血患者提供潜在的治疗方法已经取得早期的临床成功,但这些方法的应用范围受到很大的限制,因为需要在体外对造血干细胞进行基因修饰,然后移植回患者体内。
Sana 的解决方案是融合技术,其旨在将有效载荷专门输送至患者体内靶细胞,从而绕过体外细胞操作和移植。这项技术具有广泛的潜在适用性,可运用于CAR-T疗法、造血干细胞疗法以及肝细胞。
对于CAR-T疗法,融合技术能特异性地将CAR递送进患者体内细胞,即将患者身体作为生物反应器来制造 CAR-T 细胞疗法,从而解决复杂的细胞制造问题,并且也可以避免向体内递送 CAR 之前与清除淋巴细胞相关的安全性问题。在健康的非人灵长类动物研究中,Sana已经证明靶向CD8的融合体(fusosome)能被很好地耐受,不会引起CAR相关毒性,同时显示出活性。
图表42:Sana体内细胞疗法在研管线
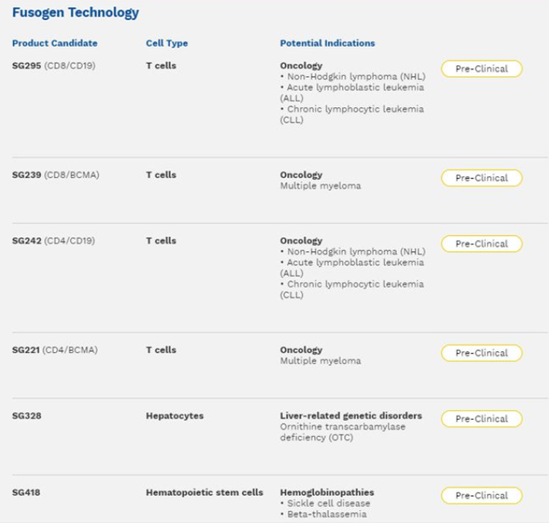
数据来源:公司官网、智银全球生物医药项目库
Sana最先进的融合CAR-T 候选产品(SG242、SG295)靶向表达 CD19 (存在于多种 B 细胞恶性肿瘤中)的癌细胞。预计最早于 2022 年为 SG295 提交 IND 申请,最早于 2023 年为 SG242 提交 IND。
此外,融合技术也可以将有效载荷特异性递送到肝细胞中,将新的 DNA 整合到靶细胞的染色体 DNA 中,并在器官生长过程中分裂和扩增,主要适应症是遗传性疾病;造血干细胞疗法主要针对镰状细胞病和 β 地中海贫血,利用专有的融合技术则可以直接将修饰血红蛋白的有效载荷输送到病人体内细胞中。
图表43:Sana融合技术示意图
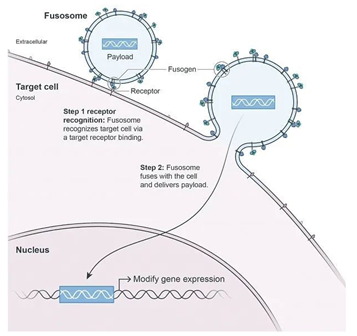
数据来源:公司官网、智银全球生物医药项目库
Sana 的体外细胞工程平台则是利用低免疫原性技术。这种技术结合以下3种基因修饰来隐藏宿主免疫系统中的细胞:1)破坏MHC I类和II类表达(使适应性免疫反应失活);2)过表达CD47(使细胞隐藏于先天免疫系统中,包括巨噬细胞和自然杀伤细胞);3)来自健康捐赠者的多能干细胞被用作初始材料,然后利用低免疫原性编辑技术进行基因修饰。这些经过编辑的细胞随后被分化成具有治疗意义的细胞类型,这些细胞作为现货型疗法被给予患者。
图表44:利用人iPSC制造低免疫原性治疗性细胞
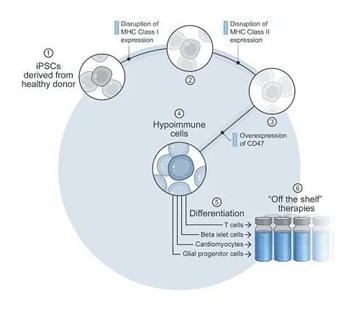
数据来源:Sana招股书、公司官网、智银全球生物医药项目库
3.5.2 Century Therapeutics
Century Therapeutics,2018年创立,并于2021年6月在纳斯达克上市(目前市值7.4亿美元)。Century 专注于开发基于诱导多能干细胞(iPSC)的通用型NK细胞疗法和T细胞疗法,用于治疗血液类肿瘤和实体瘤。通过 iPSC 技术、CRISPR 基因编辑、蛋白质工程技术,以及其专有的 Allo-Evasion 技术,提升细胞疗法的性能,克服宿主免疫排斥反应,增强临床效果的持久性。
目前 Century 研发进度最靠前的是候选药物 CNTY-101,这是一款iPSC来源的 CAR-iNK 细胞疗法,通过基因工程改造表达 CD19 CAR、可溶性IL-15、EGFR安全开关。用于治疗复发性难治性B细胞淋巴瘤。
以 CD133 和 EGFR 为靶点的治疗复发性胶质母细胞瘤的 CAR-iNK 疗法,是 Century 首个治疗实体瘤的临床后选产品,同时靶向 CD133+EGFR 两个靶点,有助于解决胶质母细胞瘤中的肿瘤异质性和抗原丢失问题。
图表45:Century研发管线

数据来源:公司官网、智银全球生物医药项目库
3.5.3 Carisma Therapeutics
总部位于宾夕法尼亚州费城的临床阶段生物制药公司CARISMA Therapeutics孵化自宾夕法尼亚大学,致力于开发工程化巨噬细胞的分化和专有细胞治疗平台,这些细胞在先天性和适应性免疫应答中起着关键作用。
公司创始团队包括CAR-T细胞领域的知名专家,宾大Perelman医学院细胞免疫疗法中心血液肿瘤学教授Saar Gill和Michael Klichinsky博士。该公司的技术平台主要建立在Klichinsky博士的论文上。
2021年3月18日,CARISMA宣布已在I期多中心临床试验(NCT04660929)中完成其CAR-M疗法CT-0508首例患者给药。CT-0508是一种HER2靶向的CAR-M疗法。这项临床试验代表基因治疗发展的一个关键里程碑,因为这是首次将CAR-M疗法用于人体研究。
巨噬细胞根据来源不同、分化不同与肿瘤的关系复杂。肿瘤相关巨噬细胞更多是与肿瘤增长相关,而有些巨噬细胞具有肿瘤杀伤活性。CT-0508在体外转染识别HER2的抗体、并控制在诱导炎症的M1表型,与肿瘤HER2结合后会激活CAR-M、释放激活细胞因子,令肿瘤微环境由冷变热。CT-0508临床前研究中显示,不仅对HER2阳性肿瘤有效,而且对HER2阴性的肿瘤也有杀伤作用,功能上类似原位肿瘤疫苗。
2022年1月10日,Moderna与Carisma共同宣布,双方达成一项合作协议,将结合 Carisma 的工程巨噬细胞技术与 Moderna 的 mRNA 和脂质纳米颗粒(LNP)技术来开发体内 CAR-M 疗法,专注于癌症免疫治疗。根据协议,Carisma 将获得 4500 万美元的预付款和 Moderna 价值 3500 万美元的投资,也将有资格获得开发、监管和商业里程碑付款。Carisma 将负责药物发现和优化,Moderna 将负责合作产生的任何临床开发和商业化。
3.6 国内细胞疗法主要公司
当前,国内大部分企业主要布局在 CIK 细胞和没有抗原负载的 OC-CIK 领域。随着CAR-T临床 研究的热度上升,以及国家政策支持,国内越来越多的企业开始布局CAR-T、 TCR -T技术。
3.6.1 复星凯特
复星凯特生物科技有限公司为上海复星医药集团与美国Kite(吉利德科学旗下公司)的合营企业,专注于肿瘤细胞治疗产品的研发、产业化和商业化发展,造福中国患者,其创始人为黄海先生。公司在研产品与研发管线如下:
Axicabtagene Ciloleucel,美国商品名Yescarta,是美国Kite Pharma开发的CAR-T 细胞免疫治疗产品。
2017 年10 月18 日获得美国 FDA 批准上市,用于复发难治性大B细胞淋巴瘤患者的治疗,是美国 FDA 批准的首款针对特定非霍奇金淋巴瘤的CAR-T细胞药物。
2018 年8 月27 日,Yescarta成为欧洲第一批获批准上市的CAR-T细胞治疗产品,用于复发或难治性弥漫性大B细胞淋巴瘤DLBCL和原发性纵隔B细胞淋巴瘤(PMBCL)患者的治疗。
2019年1月,Yescarta获得加拿大卫生部批准上市,用于既往接受二线或多线系统治疗的复发性或难治性大B细胞淋巴瘤成人患者的治疗。
Kite Pharma公布的 ZUMA-1 II期随访数据显示,101名难治性大B细胞淋巴瘤患者接受Yescarta治疗并有机会完成两年随访,最佳总缓解率为83%,完全缓解率达到58%;中位随访15.4个月,有42%的受试者维持缓解,其中40%维持完全缓解,中位缓解持续时间达到11.1个月2;中位随访27.1个月, 仍有39%的受试者维持缓解,其中37%维持完全缓解。这说明在达到完全缓解后,Yescarta的疗效可以持续。
复星凯特2017年初从美国Kite Pharma引进Yescarta,获得全部技术授权,并拥有其在中国包括香港、澳门的商业化权利,2021年6月,复星凯特的奕凯达成为国内首个获批上市的CAR-T细胞治疗产品,适用于治疗二线或以上系统性治疗后复发/难治性大B细胞淋巴瘤(LBCL)成人患者。
然而,复星凯特公布的相关营收数据比较有限,2022半年报中也未提及;但2021年年报中,复星医药公布了营收超1亿元的产品名称,奕凯达不在其中。也就是说,截止至2022年3月,这款CAR-T产品营收暂未超过1亿元。
不过在今年7月中旬的上市一周年活动上,复星医药曾披露称奕凯达已惠及超过200位淋巴瘤患者。根据奕凯达120万/针的单价测算,能够得出,奕凯达的累计销售金额大约是在2亿元人民币之上。
除Yescarta以外,复星凯特同时在上述地区享有Kite Pharma后续产品授权许可的优先选择权。公司2000平米的细胞治疗研发中心于2019年初落成,研发管线还包括多个 CAR-T/TCR-T 临床阶段品种和早期创新研发项目;并且与国内外肿瘤免疫治疗领域优秀研发机构合作,打造可持续的创新研发管线。
3.6.2 药明巨诺
药明巨诺(港交所代码:2126)是一家领先的细胞免疫治疗公司,由巨诺医疗(一家百时美施贵宝的子公司)和药明康德联合创建,是一个专注为血液及实体瘤开发、制造和商业化的突破性细胞免疫疗法的一体化平台。
公司的创始团队均拥有丰富的医药行业从业经历,并且此前都在外资头部药企担任要职, 有望助力公司快速成长。CEO 李怡平曾是医生,后在 Merck 担任过研发科学家,以及 Amgen 公司大中华区创始总经理, 拥有丰富的临床研发和企业管理经验。CTO林立源具有丰富的 CMC开发经验,曾先后在多家领先的生物科技和细胞治疗企 业担任过研发负责人,拥有很强的研发实力。此外,为进一步铺垫公司的商业化以及全球化战略布局,公司邀请了吴琼和 Mark 担任公司的首席商务官和首席医学官,持续扩大高管团队,提升销售能力以及临床推进能力。
图表46:药明巨诺创始团队

数据来源:药明巨诺官网、智银全球生物医药项目库
药明巨诺已经战略性地搭建涵盖血液及实体肿瘤、由七款候选药物或上市产品组成的细胞免疫治疗产品管线,致力于为患者提供突破性、高品质、安全有效的细胞免疫治疗产品。其中,JWCAR129是以BCMA为靶点的自体CAR-T产品,BCMA通常在多发性骨髓瘤中表达,是具有潜力的CAR-T治疗靶点。其他以BCMA为靶点的CAR-T疗法,在接受过多达十次前线治疗仍无法控制疾病的复发或难治性多发性骨髓瘤患者中,已展现出高缓解率及可控的毒副作用。
图表47:药明巨诺研发管线
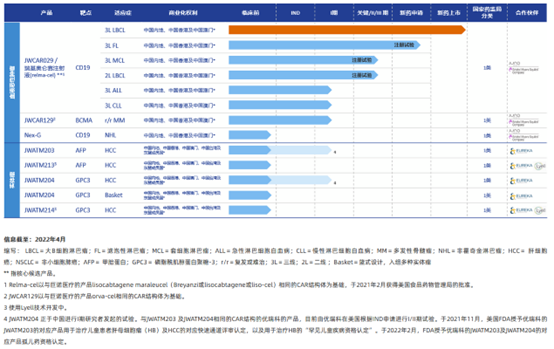
数据来源:药明巨诺官网、智银全球生物医药项目库
瑞基奥仑赛是药明巨诺首个商业化产品,据2021年年报,药明巨诺产品瑞基奥仑赛营收3080万元,毛利率为29.4%;在2022年半年报中,药明巨诺表示,上半年瑞基奥仑赛毛利率已增长至35%,收入约为6600.7万元。
然而,药明巨诺目前营业收入依然难以覆盖8440万元的销售费用及9090万元的行政支出。
3.6.3 传奇生物
传奇生物(NASDAQ: LEGN)成立于2014年,是一家集肿瘤免疫细胞疗法研发、临床、生产及商业化开发于一体的跨国生物制药公司,位列全球免疫细胞疗法领域第一方阵,全球员工总数已逾1000人。
其创始人为章方良博士,章博士自2015年5月起担任传奇生物技术公司董事会主席。他于2002年与他人共同创立了GenScript集团,2015年,章博士创建了传奇生物Legend Biotech,成为GenScript的子公司,扩大了GenScript的业务范围。2018年,章博士在中国医疗保健峰会上被授予年度人物,以表彰他对医疗保健领域的贡献和重大影响。章方良博士是9项科学专利的发明者。在创立GenScript之前,章博士于1995年至2002年在Schering-Plough担任首席科学家,章博士拥有杜克大学生物化学专业的博士学位。
公司的“LCAR-B38M CAR-T细胞自体回输制剂(简称:LCAR-B38M细胞制剂)”是国内首个按“治疗用生物制品1类新药”申请获得CDE受理的CAR-T产品,并获得优先审评资格。2018年3月12日,该产品获得CDE的临床试验批件,成为国内首个按药物申报临床试验获批的CAR-T细胞疗法。
图表48:LCAR-B38M细胞制剂上市路径

数据来源:传奇生物官网、智银全球生物医药项目库
公司充分利用团队丰富的研发经验及不断完善的研究设施,挖掘细胞治疗的潜力,搭建强大的新药研发体系及丰富的研发管线,以治疗在大众普遍的认知中无法治愈的疾病,如血液恶性肿瘤、实体瘤、传染病和自身免疫性疾病。
图表49:传奇生物研发管线

数据来源:传奇生物官网、智银全球生物医药项目库
3.6.4 茂行生物
茂行生物是一家临床阶段的细胞疗法开发企业,由免疫治疗、基因编辑、生物医药领域知名专家和生物企业资深运营管理人士共同创立,致力于新型免疫细胞治疗技术的开发。其创始团队简介如下:
创始人尚小云先生:免疫学博士,全军免疫学研究所,师从吴玉章教授;是中国免疫学会终身会员,湖北省肿瘤学会免疫专委会理事,重庆市生物信息学会理事;曾获得重庆市新产品创新青年科技人才等奖项;获得国家发明专利二十余项,获得软件著作权八项,发表专著一部,以第一作者或共同作者发表论文 18 篇,其中 SCI 收录期刊论文11篇,累计影响因子60余分,论文被引 192 次。
公司现阶段聚焦颅内肿瘤,首个用于复发胶质瘤的产品管线在初步临床研究中获得了突破性疗效和可控的安全性验证。
脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,其中胶质母细胞瘤是最恶性的脑胶质瘤(Ⅳ级),中位生存期平均 14.6 个月。
我国近年胶质瘤的发病率以每年 1%~2%的速度递增。目前胶质瘤治疗以手术切除为主,辅以放射治疗(分次外照射)和药物化疗等多种方式的综合治疗,但没有药物可为胶质瘤患者带来显著的临床获益,存在巨大未满足临床需求。脑胶质瘤领域临床在研管线较少,具有更好的竞争格局。
图表50:茂行生物研发管线

数据来源:茂行生物官网、智银全球生物医药项目库
3.7 行业宏观政策及监管
目前,我国对细胞治疗产品按照药品、医疗技术管理的“双轨制”进行监管。企业主导研制细胞制剂鼓励按药品申报,由国家药品监督管理局(NMPA)按照药品进行监管,企业开展临床试验需要按照药物临床试验相关要求提交申请;医疗机构主导的生物医学新技术可按第三类医疗技术进行管理,并限定在本医疗机构内开展临床研究和转化应用,医疗机构和相关项目由卫健委进行备案监管。整体上,技术早期以医疗机构开展临床研究为主,但最终鼓励企业以药品进行临床试验和上市申报。
图表51:“双轨制”监管
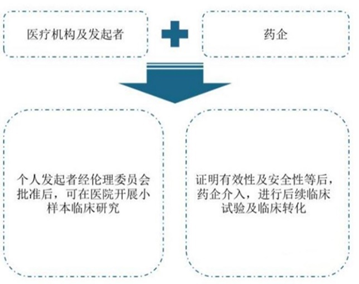
数据来源:GlobalOncologist、智银全球生物医药项目库
四、行业发展困境与趋势
4.1 细胞治疗技术发展困境
4.1.1 安全性问题:CRS和神经毒性
经临床发现,与CAR-T细胞治疗相关的两个标志性临床毒性是细胞因子风暴(CRS)和神经毒性,而对这些毒性的处理目前仍然是临床所面临的巨大挑战。CRS患者通常在CAR-T细胞治疗的第一周内表现为发热、低血压和呼吸功能不全,并伴有血清中高水平的细胞因子。神经毒性表现为暂时性的记忆丧失、神志不清、癫痫发作,很少的出现急性脑水肿。CRS和神经毒性均归因于分泌细胞因子的T细胞的快速活化和扩增。
目前的理解是,CAR-T细胞分泌的细胞因子和/或配体-受体的相互作用激活髓系隔间的额外免疫细胞,这些细胞因子反过来释放更多的细胞因子,形成一个激活炎症的循环,称为细胞因子风暴。患者体内自然产生的肾上腺素也被证明有助于这种自我放大的产生环路。
图表52:CAR-T细胞诱导的CRS及其神经毒性的分子机制

数据来源:《Blood Advances》、智银全球生物医药项目库
4.1.2 转染工艺改进,长期安全性需验证
转染是将核酸导入真核细胞中的过程,是细胞生物学、基因表达和基因抑制实验中的关键步骤。采用各种化学、生物学或物理方法导入外源性核酸会改变细胞的特性,从而实现细胞基因功能和蛋白质表达研究。根据转染后核酸是否整合到宿主细胞染色体中分成“瞬转”(瞬时转染)和“稳转”(稳定转染)。
图表53:细胞转染示意图
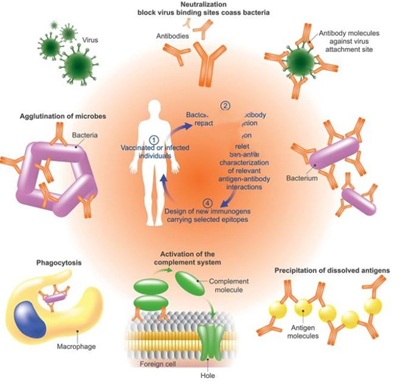
数据来源:苏州阿尔法生物实验器材有限公司、智银全球生物医药项目库
转染工艺的长期安全性是监管重点关注的内容,公司需对产品的长期安全性进行跟踪。 不论选择何种转染方式,经过基因改造的细胞产品的长期安全性是各国监管机构关注的重要问题。
4.2 细胞治疗发展趋势
4.2.1 开发通用型产品,提高药物可及性
细胞治疗效果优异,但对于技术、生产、商业化、应用端均提出高的要求, 未来,国内细胞疗法领域或将进入良性循环,整个细胞治疗上中下游的供应和协同生态也会逐步建立和完善起来。在此前提下,开发通用型产品,布局下一代技术,进而提高药物可及性将成为未来的发展趋势:
虽然CAR-T在血液瘤中效果惊艳,但在所有的肿瘤中,实体肿瘤占比90%以上,实体瘤是 CAR-T 疗法始终没能迈过去的一道坎,包括肿瘤靶点特异性低、免疫抑制性肿瘤微环境,CAR-T 浸润难度大等。如何开发通用型产品,布局下一代技术,将CAR-T在血液肿瘤上的成功,复制到实体肿瘤,提高药物可及性是行业的一大发展趋势。
4.2.2 联合治疗成为重点
CAR-T疗法联合mRNA疫苗
BioNTech公司开发的BNT211是靶向实体瘤的新一代CAR-T疗法,将靶向CLDN6抗原的CAR-T疗法与表达CLDN6抗原的mRNA疫苗CARVac相结合。
临床试验中纳入的16例复发难治性晚期实体瘤患者分别为睾丸癌8例,卵巢癌4例,子宫内膜癌、输卵管癌、肉瘤及胃癌各1例。疗效数据和结果初步证实,CLDN6 CAR-T细胞联合CAR-T的RNA疫苗(CARVac)在剂量探索阶段显示出良好的安全性,并显示出令人鼓舞的疗效。mRNA疫苗(CARVac)可用于改善CAR-T细胞的抗肿瘤作用,为利用CAR-T细胞治疗难治性实体瘤提供一种新的策略。
NK细胞疗法联合PD-1
由广东省蛋白质组学重点实验室姜勇教授团队开展的最新研究发现,PD-1抑制剂在临床治疗中对非小细胞肺癌具有活性,并且发现除T细胞外,NK细胞不仅同样能够表达PD-L1蛋白,而且还具有延长晚期非小细胞肺癌患者生存期的潜力。
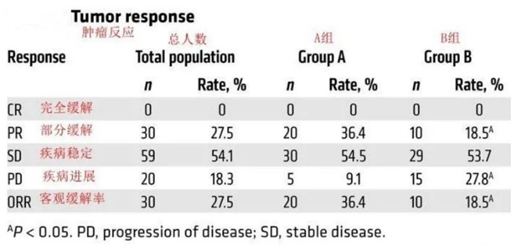
109名PD-L1阳性的晚期非小细胞肺癌患者随机分成两组, 55名患者接受NK细胞回输联合Keytruda治疗,54名患者单独的K药治疗,参加这项随机试验的大多数患者是现吸烟者或既往有吸烟史者,患有非鳞状组织学肿瘤,并且以前接受过一线系统治疗。
结果显示接受过多次NK细胞回输配合K药治疗的患者,中位总生存期为18.5个月;只接受过1次NK细胞回输配合K药的患者,中位总生存期为13.5个月;只接受K药单药治疗的患者,中位总生存时间为13.3个月。有效率方面,接受过NK细胞回输的患者,有效率为36.4%;单药K药的患者,有效率为18.5%。而控制率方面,两组相差不大。
图表54:NK细胞疗法联合PD-1实验结果
数据来源:广东省蛋白质组学重点实验室、智银全球生物医药项目库






