一、基因治疗行业概况
1.1 概念
基因支持着生命的基本构造和性能。其有两个重要的属性,一个是基因的物质性,另一个重要属性是信息性,信息的属性离不开传递,而一旦传递中途发生变故,误差的基因会导致生物体不能适应环境或者导致自身的毁坏。
基因治疗(gene therapy)实际上就是DNA分子中核苷酸种类、数量和顺序的改变,导致遗传信息的改变而致病。由于癌变及遗传性疾病等是因体内某种基因缺乏、缺陷或突变引起的,因此对这种基因进行替代、修复和增补,就能治疗这些疾病,从而控制这些疾病的发生,故称基因治疗。
1.2 定义
基因治疗是指将正常的或者有治疗作用的外源基因插入到靶细胞中,修复靶细胞中有缺陷的基因,或者替代有缺陷的基因,从而达到治疗疾病目的的生物医学技术。基因治疗定义有广义和狭义之分,狭义的概念是指用具有正常功能的基因置换或增补患者体内有缺陷的基因,从而达到治疗的目的。广义的概念指把某些遗传物质转移到患者体内,使其在患者体内表达,最终达到治疗某种疾病的方法。随着科学家对遗传物质的作用机理的了解,科学家开始考虑如何人为干预遗传和表达的过程,基于基因技术发展,现已可以在分子水平对基因进行改造和修正。
常规治疗一般是针对基因异常而导致的各种症状,治标不治本,而基因治疗是针对遗传疾病的根源-异常的基因本身,基因的异常是遗传疾病的本质,将异常的基因修正,或者用正常基因取代有缺陷的基因,那么外在的症状也将迎刃而解。目前,基因治疗根据治疗途径可以分为体外基因治疗和体内基因治疗。具体表现为基因增补和基因编辑。(注:本报告不讨论细胞治疗类基因治疗药物)
(1)基因增补:利用递送载体,将外源基因导入病变细胞,其表达产物能修饰缺陷细胞的功能或加强原有功能。或是与相应的基因结合,影响原有基因的功能。是目前获批上市和临床在研阶段产品中,最主要的基因疗法技术路径。
(2)基因编辑:精确修饰特定目标基因,从而破坏有害基因或修复变异基因,包括ZFNs,TALEN以及2020年获诺贝尔化学奖的CRISPR/Cas9技术。以CRISPR/Cas9技术为例,Cas9蛋白在sgRNA的导向下,通过碱基互补配对,到达不同的靶部位,通过切割靶基因,对目标基因进行定点精确编辑,从而实现对患者原有基因组“错误”基因的改变与修正。基因编辑系统向临床的转化正处于早期阶段,目前尚无产品上市。
图表1:基因治疗过程示意图
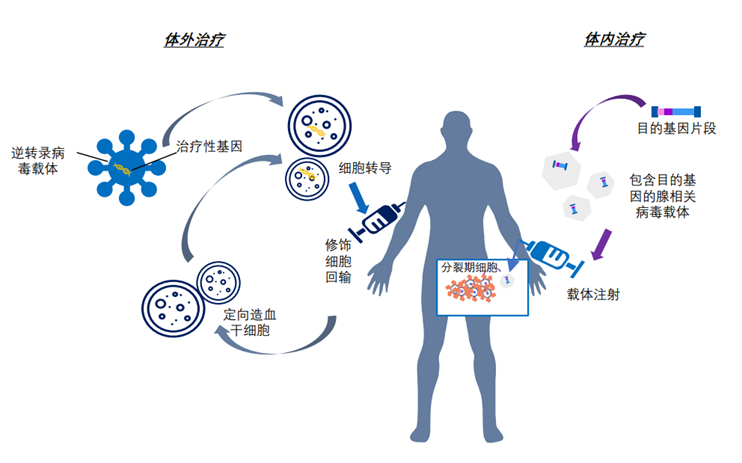
资料来源:FDA,CBER,智银医药资料库
1.3 发展历程
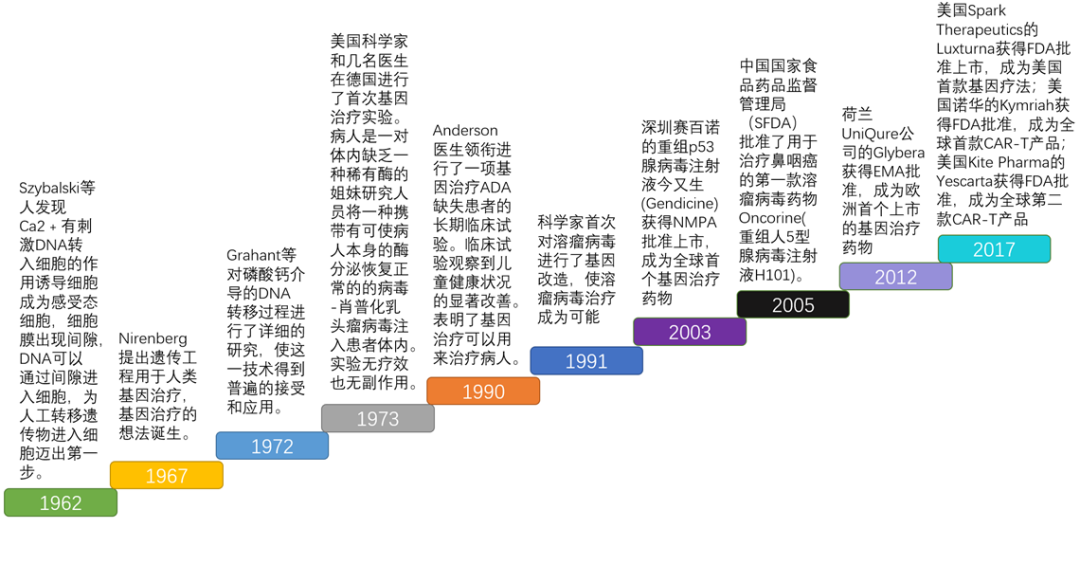
基因治疗历史发展历程
1962年,Szybalski等人发现Ca2﹢有刺激DNA转入细胞的作用,Ca2+能使细胞膜磷脂双分子层形成液晶结构,促使细胞外膜与内膜间隙中的部分核酸酶解离开来,离开所在区域,诱导细胞成为感受态细胞,细胞膜出现间隙,DNA可以通过间隙进入细胞,为人工转移遗传物进入细胞迈出第一步。
1967年,Nirenberg提出遗传工程用于人类基因治疗,基因治疗的想法诞生。
1968年,Burnett等用DEAE协同转移的方法将病毒导入培养细胞,为病毒作为遗产物质的载体做铺垫。
1972年,Grahant等对磷酸钙介导的DNA转移过程进行详细的研究,使这一技术得到普遍的接受和应用。
20世纪70年代初,Graessman和Dicumak奠定了用显微注射法转移基因的技术基础
1973年,美国科学家和几名医生在德国进行首次基因治疗实验。病人是一对体内缺乏一种稀有酶的姐妹研究人员将一种携带有可使病人本身的酶分泌恢复正常的的病毒-肖普化乳头瘤病毒注入患者体内。实验无疗效也无副作用。
1990年,被称为“基因治疗之父”的William French Anderson医生领衔进行一项长期临床试验,治疗患有腺苷脱氨酶(ADA)缺乏性重度联合免疫缺陷症(ADA-SCID)的儿童。使用逆转录病毒将ADA基因转移到分离的T细胞中,然后将这些基因修饰的T细胞回输至患者体内,以求向ADA-SCID患者中引入健康的ADA基因。令所有人高兴的是,临床试验观察到儿童健康状况的显著改善。表明基因治疗可以用来治疗病人。
1991年,中国复旦大学的研究人员进行“成纤维残暴基因治疗血友病B”项目,此外还开展针对肿瘤和血液病的基因治疗。
1999年,基因治疗的进展遭遇滑铁卢,18岁的Jesse Gelsinger患有鸟氨酸转氨甲酰酶缺陷(OTC),他参与一项由宾夕法尼亚大学开展的临床试验,研究人员用腺病毒将缺失的基因传递到他体内。4天后,Gelsinger死于强烈免疫反应导致的多器官衰竭。首例受试者的死亡给基因治疗发展史蒙上一层阴影,同时也是一个警醒,提醒人们注意风险。FDA随即暂停几项基因治疗临床试验。
图表2 基因治疗发展历程
资料来源:智银医药资料库
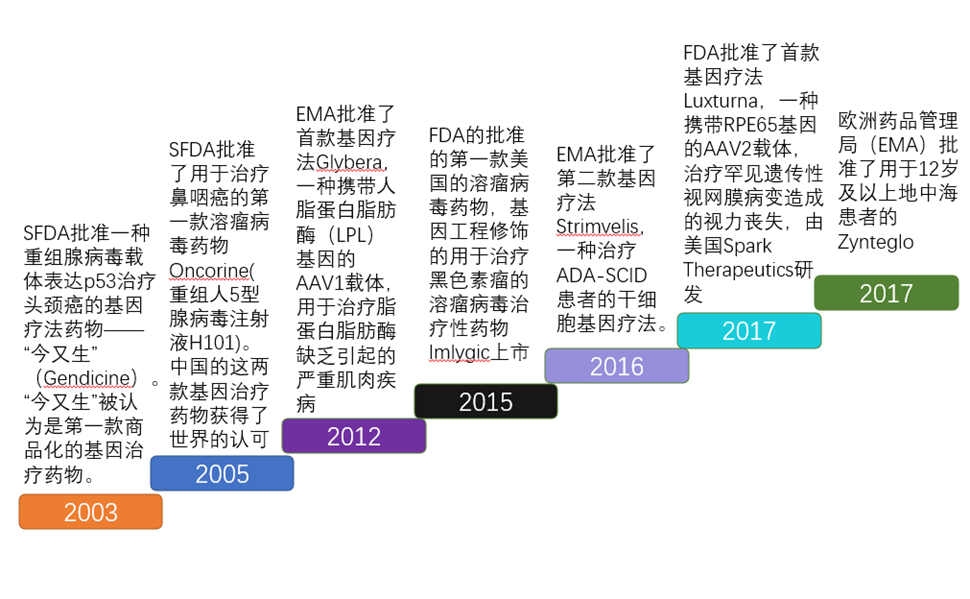
基因治疗部分药物上市历史
2003年中国国家食品药品管理局(SFDA)批准一种重组腺病毒载体表达p53治疗头颈癌的基因疗法药物——“今又生”(Gendicine)。“今又生”被认为是第一款商品化的基因治疗药物。2005年SFDA批准用于治疗鼻咽癌的第一款溶瘤病毒药物Oncorine(重组人5型腺病毒注射液H101)。迟疑和怀疑伴随着Gendicine和Oncorine的使用,但是来自中国的这两款基因治疗药物仍然获得世界的认可。此后数年内欧美和中国都无基因治疗产品获批,直至2012年EMA批准首款基因疗法Glybera,开启基因治疗的“元年”。
图表3 基因治疗部分药物上市历史
资料来源:智银医药资料库
1.4 技术路径与机制
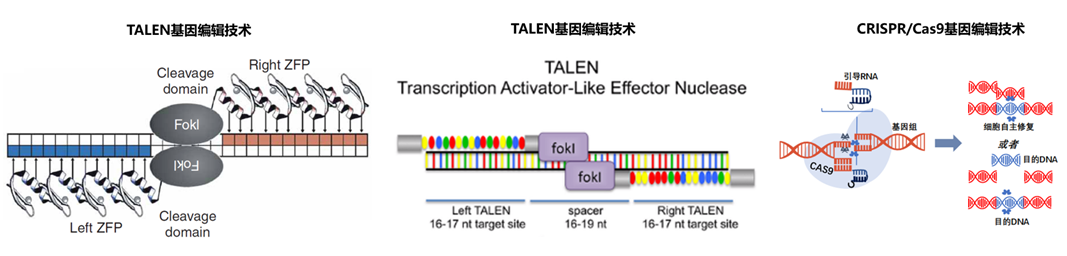
基因编辑技术主要经历了三代发展,从重组核酸酶介导的技术向以RNA引导的基因编辑技术发展,成本逐步降低,周期缩短,靶向修饰效率不断提高。
Zinc finger nucleases,(ZFNs, 锌指核酸酶)
ZFNs技术是第一代基因组编辑技术,是由天然DNA转录因子衍生而来,其功能实现基于特异性识别DNA的锌指蛋白(ZFP)和Fok I内切酶的核酸酶结构域组成。每个锌指蛋白可识别3个碱基序列,研究者可通过锌指蛋白的排列组合进行不同靶向指定编辑。通常使用的锌指蛋白筛选手段是噬菌体展示,以达到高通量筛选的目的。从2001年开始,ZFN开始被陆续用于不同物种的基因编辑。但是由于技术研发成本较高、专利垄断严重,造成以技术平台发展缓慢,直接导致应用和普及的滞后。特别是在第二、第三代基因编辑技术被开发出来之后,锌指蛋白的研究和临床使用频率大为减少。
Transcription activator like effector nucleases(TALENs,转录激活因子效应物)
TALENs是与ZFNs结构类似但更加灵活和高效的第二代靶向编辑技术,核心蛋白由 AvrBs3 蛋白衍生而来。与ZFNs不同的是,该技术使用两个氨基酸组合来识别单个碱基序列,从而大大减少ZFNs容易脱靶的问题。得益于其低脱靶率,TALEN技术常被细胞治疗平台用于体外细胞碱基的编辑,特别是在嵌合抗原受体T细胞治疗平台开发中。可是依然高昂的研发费用限制该技术的大规模应用。
CRISPR/Cas技术
CRISPR/Cas技术是基于原核生物抵御外来病毒及质粒DNA的一种适应性免疫系统开发而来的第三代基因编辑技术。通过人工设计的 sgRNA(guide RNA)来识别目的基因组序列,并引导Cas蛋白酶进行有效切割DNA 双链,最终达到对基因组DNA 进行修饰的目的。其中Cas9 蛋白和Cpf1蛋白是最为常用的蛋白酶。作为当今最为广泛使用的基因编辑技术,CRISPR/Cas平台有着ZFNs和TALENs无法匹敌的低价格、高灵活性、多靶向等优势。这些优势促使该产品从科研到临床的快速转化。当今,CRISPR/Cas技术广泛应用于体外分子诊断、基因标记、单碱基编辑等领域。以CrisprTherapeutics和Editas Medicine为代表的一大批新型医药公司正在传染病、罕见病癌症等领域进行大量基于此技术的临床试验。
图表4 ZFN、TALEN及CRISPR/Cas9基因编辑技术
资料来源:智银医药资料库
CRISPR/Cas作为革命性的基因编辑技术,优势明显;相较于ZFNs和TALENs,CRISPR/Cas的开发周期更短,成本较低,靶向效率更高:
①低廉的开发价格、较短的开发周期、简便的开发过程加速了基因编辑技术的迭代,促成CRIPSR/Cas技术的广泛使用。
②简易的多重编辑、高靶向效率使CRIPSR/Cas成为基因工程研究的加速器,为临床转化奠定基础。
自2012首次应用以来,CRIPSR/Cas已然成为基因编辑在科研和临床应用上的不二选择。除常见的遗传疾病领域的应用,CRISPR/Cas也在其他疾病领域有丰富的在研临床试验。CRISPR/Cas可编辑线粒体DNA、胚胎和RNA,在表观遗传标记和基因阻截中也有广泛应用。
图表5 基因编辑技术的临床研究与应用对比
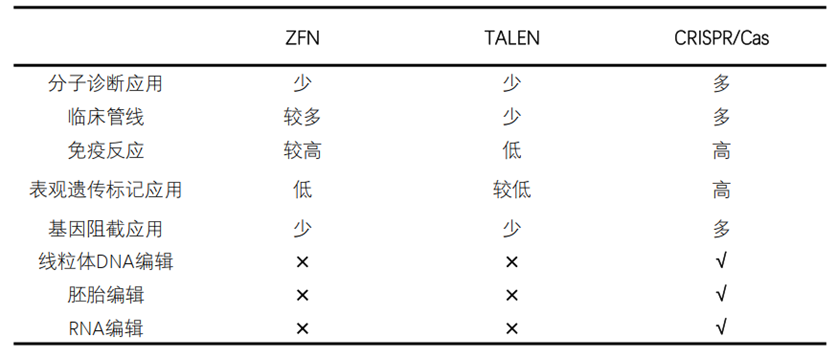
资料来源:基因组编辑技术的原理及应用,智银医药资料库
而基因增补目前的技术路径主要通过各类载体的递送。基因增补过程主要为将正常功能的基因片段插入到异常的细胞中。目前基因增补手段主要依赖核酸药物,核酸药物按照种类又可划分为DNA药物(裸质粒等)、RNA药物[干扰RNA(RNAi)等]及反义寡核苷酸药物以及重组病毒类药物,其作用原理是借助一定载体将核酸药物传送进细胞内并进行复制转录继而从基因层面起到治疗效果;基因增补的技术难题体现在递送方式,当然这也是整个基因治疗的技术难题。基因治疗的研发优势,体现在一旦解决递送方式,研发难度反而较传统药物更低。无论是在体外还是体内进行基因改造,基因治疗的三大共性步骤包括:核酸序列的设计与合成、将目标序列递送至细胞中(体内或体外)和工业化生产。其中,核酸序列的设计与合成难度较小分子靶向药和单抗药物更低,因此一旦研发出一个安全高效的递送系统,基因治疗产品的研发难度反而更低、研发成功率更高。递送方式包括病毒载体和非病毒载体两大类,非病毒载体的工业化级别放大相对容易,病毒载体的规模化生产仍面临一定的瓶颈。
图表6 基因增补示意图
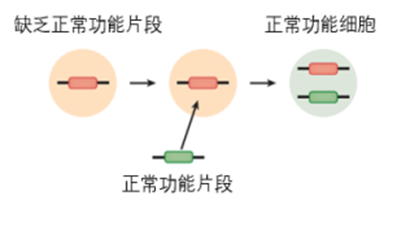
资料来源:Entering the Modern Era of Gene Therapy,智银医药资料库
1.5 产业链分析
基因治疗产业链可分为上游,中游和下游。上游是病毒载体的生产厂商。病毒载体的生产步骤包括:目的基因制备,病毒载体构建,重组病毒培养,重组病毒纯化,质量控制等环节,各环节涉及多种设备及试剂耗材。中游是基因治疗的制药企业,包括基因增补,基因编辑两类药企。下游则是各类罕见病/遗传病患者。包括2型先天性黑蒙症(LCA),脊髓性肌肉萎缩症(SMA),β-地中海贫血(TDT),A/B型血友病,遗传性视网膜病变等。
图表7 基因治疗产业链国内外企业分布

资料来源:动脉橙,智银医药
1.5.1 上游
上游是病毒载体的生产厂商。病毒载体的生产步骤包括:目的基因制备,病毒载体构建,重组病毒培养,重组病毒纯化(层析&过滤等),质量控制等环节,各环节涉及多种设备及试剂耗材。
海外企业例如赛默飞,思拓凡等基本覆盖了病毒载体生产的全流程,我国基因治疗产业发展时间较短,但发展速度快,企业创新活跃度不断加强,整体产业链完整度不高,目前产品多集中在中游药物研发领域创新,对产业链上游的核心把控不强。国内企业在各环节上有所侧重,例如主营病毒载体构建的企业包括和元生物,药明生基,金斯瑞,诺唯赞等,重组病毒培养与纯化的企业包括宜明细胞等。
上游的难点不仅仅在于基因开发,病毒载体的生产面临诸多工艺壁垒及人才壁垒。病毒载体生产的上游(USP)难点包括:质粒是AAV的主要成本来源,如何减少瞬时转染所需的质粒数量以及提高转染效率;如何提高细胞培养密度,扩大产能。下游(DSP)主要难点在层析纯化环节,目前病毒载体DSP整体收率仅 20-30%,难点在于USP中存在的空壳病毒(不含有治疗基因但会引起免疫反应),如何降低空壳率。正是由于病毒载体的工艺开发难度大,国内具备良好病毒经验、工艺背景和丰富生产管理经验的复合型人才极度稀缺。
病毒载体的生产有很高的资金壁垒。CGT CDMO需重资产投入(数亿美元) ,才能建立符合cGMP标准的厂房及设备。病毒载体生产的各环节需要的各类设备及试剂耗材,设备包括生物反应器,离心机,层析柱等,试剂耗材包括质粒、培养基、HEK293细胞等。我国基因治疗上游产业链环节创新较弱,虽有上海和元、北京五加和等基因治疗载体研发企业实现创新突破。然而,病毒载体生产所需的设备和试剂耗材基本依靠进口(这和其他IVD领域以及细胞治疗领域面临着同样的难题),成本更为高昂。
图表8 基因治疗产业链上游各环节
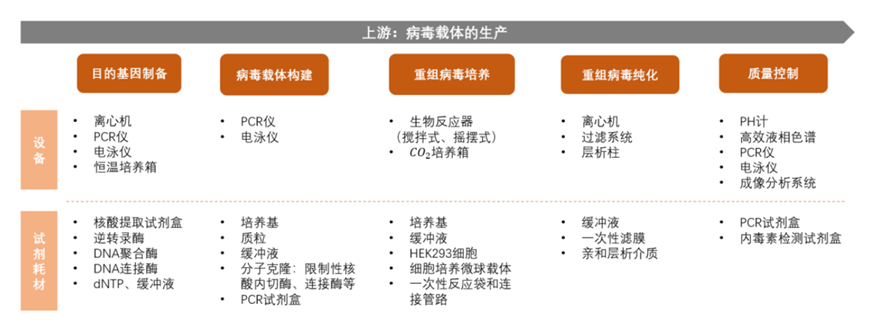
资料来源:蛋壳研究院,智银医药
1.5.2 中游
中游是基因治疗的制药企业,包括基因增补,基因编辑两类药企。基因增补的国外企业包括已有产品上市的罗氏(Spark),诺华(AveXis),Orchard(GSK),Bluebird,uniQure 等,基因增补的国内企业包括纽福斯生物,天泽云泰,朗信生物,北京中因,至善唯新,本导基因,辉大基因等。基因编辑的国外企业包括CRISPR发明者创立的 CRISPR,Intellia,Editas。
我国基因治疗产业链中游并驾齐驱,产品审批流程相对滞后。我国目前基因治疗领域累计企业500+家,绝大部分集中在药物研发领域。我国基因治疗领域中游药物研发企业近年来不断实现突破,如siRNA领域的瑞博生物;基因编辑领域的博雅辑因;溶瘤病毒领域的上海希元、澳元和力等企业均实现临床及产品研究的突破。同时对于药物研发的规模化生产能力,目前企业虽加速布局,但整体市场空间尚需时日才能完全释放。
1.5.3 下游
下游是各类罕见病/遗传病患者。包括2型先天性黑蒙症(LCA),脊髓性肌肉萎缩症
(SMA),β-地中海贫血(TDT),A/B 型血友病,遗传性视网膜病变等。
近年来随着覆盖药品研发和生产服务的CDMO模式逐渐兴起,基因治疗领域的CRO/CDMO企业也逐渐兴起,成为协助基因治疗药物研发的中坚力量。
二、基因治疗行业市场情况
2.1 市场发展进程
前述提及基因治疗,基因治疗包括基因增补和基因编辑两大技术路径。目前,基因增补技术相对成熟,已有数款产品获FDA/EMA批准上市,为罕见病患者的治疗提供希望,在研管线也非常丰富,海外不少产品已进入拟上市/上市申请或临床后期阶段。
基因编辑,作为定向精准且功能更为强大的技术,目前向临床的转化大多处于早期阶段,尚无产品上市,但多个临床试验正在进行中,且临床效果良好。
已上市产品
Gendicine被认为是第一款商品化的基因治疗药物,由深圳市赛百诺公司研发,主要用于治疗头颈部鳞状细胞癌,是全球首个抗肿瘤基因治疗产品。通过携带有野生型p53基因的重组复制缺陷型人5型腺病毒,可通过表达抑癌基因p53,刺激机体产生特异性抗肿瘤免疫反应,上调多种抗癌基因和下调多种癌基因活性,从而增强抑癌作用,特异地引起肿瘤细胞程序性死亡,从而实现杀伤肿瘤的目的。
图表9 全球获批上市的细胞与基因治疗产品,1998-今
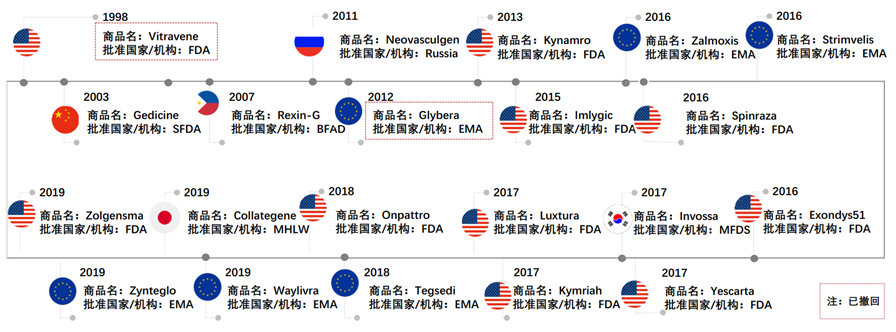
资料来源:Forntiers,智银全球医药项目库
目前,全球获批的基因治疗产品达到20余种,市场价格高昂,蓝鸟公司的基因疗法Zynteglo(定价210万美元),诺华公司的Zolgensma更是开出高达280万美元的价格,我国已上市的CAR-T产品定价分别是120万(益基利仑赛注射液)与129万人民币(基奥仑赛注射液),但为罕见和遗传性疾病以及无法治愈疾病带来巨大的希望。
图表10 部分基因治疗产品售价
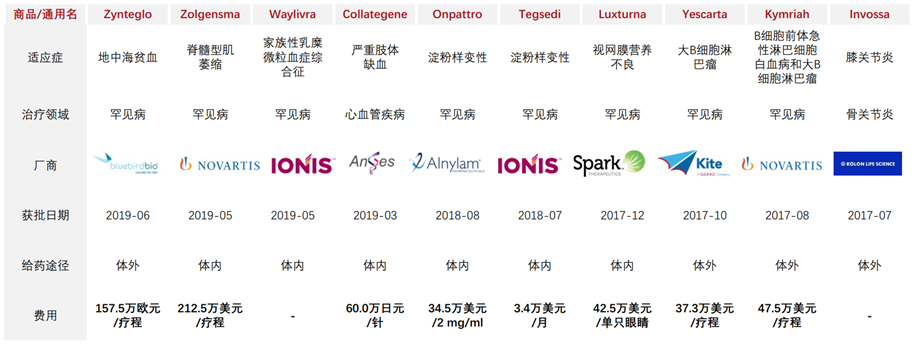
资料来源:Forntiers,智银全球医药项目库
基因增补技术相对成熟,上市产品表现良好
从2012年至2021年,FDA批准2款产品,EMA批准6款产品(2款是FDA先批准)。FDA批准的2款产品,均基于腺相关病毒AAV载体。2017年批准的Spark公司的Luxturna产品,用于治疗双等位RPE65基因突变导致的2型先天性黑蒙症LCA,以及2019年批准的诺华的Zolgensma产品,用于治疗2岁以下的脊髓性肌肉萎缩症SMA。EMA批准了6款产品。除FDA率先批准的上述两款产品,还有2012批准的uniQure公司的Glybera产品,也是基于AAV载体,是EMA批准的首款基因治疗产品,用于治疗脂蛋白脂肪酶缺乏症LPLD。
目前海外基因增补产品的在研管线丰富。2022年即将有3款拟上市产品,以及6款拟提交上市申请BLA的产品,以及十几款已经进入临床3期的在研管线。纵观海外基因增补技术的在研管线,产品以体内基因治疗为主,且基于AAV载体;体外治疗大多基于LV载体。
国内基因增补管线整体进展较慢,多处于临床1期,适应症集中于眼科遗传病和血友病。纵观国内基因增补技术的在研管线,产品基本为体内途径,且基于AAV载体,仅本导基因基于LV平台有相关管线。数家国内研发药企的管线获得FDA的孤儿药认定(ODD),包括纽福斯生物的NR082用于治疗Leber遗传性视神经病变,天泽云泰的VGB-R04用于治疗先天性凝血因子IX缺乏引起的血友病B,北京中因的ZVS101e用于治疗结晶样视网膜色素变性。
基因编辑技术定向精准,功能强大
前述已经介绍基因编辑技术的技术路径以及发展历程。目前,在基因编辑领域,研发管线集中于 CRISPR/Cas9 技术。CRISPR/Cas9的三位发明者奠定其成为基因编辑领域“三巨头”的基础,Emmanuelle Charpentier教授,Jennifer Doudna教授,以及张锋教授,分别创立全球领先的基因编辑公司 CRISPR,Intellia,Editas。
国内基因编辑管线整体仍处于临床早期阶段。进展最快的是博雅辑因的体外疗法 ET-01,处于临床 1 期,体外疗法还有瑞风生物的RM001。体内疗法包括本导基因的 BD111,北京中因的 ZVS203e,以及辉大基因的HG-203。博雅辑因的 ET-01 产品用于治疗输血依赖性β地中海贫血症(TDT)。
2.2 市场规模
全球细胞与基因治疗投融资火热。随着2017年FDA批准Luxturna,Kymriah和Yescarta以来,CGT行业的快速发展吸引着大量资本的流入,据alliancerm披露,全球CGT领域投融资总额从2014年约50亿美元快速增长至2021年的约230亿美金。
图表11 2014-2021年全球CGT领域投融资情况
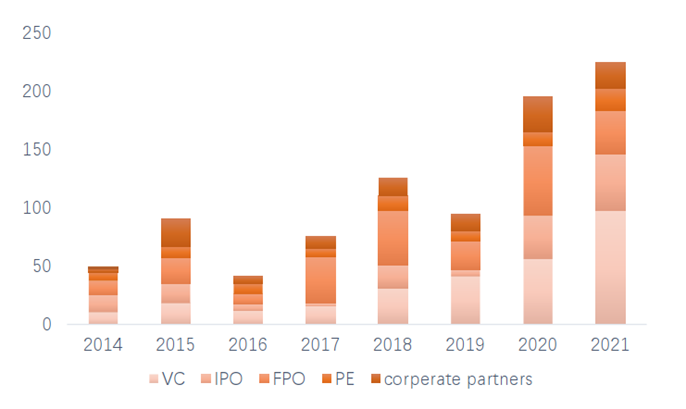
资料来源:alliancerm 官网,智银医药资料库
2016年至2020年,全球CGT市场从0.5亿美元增长到20.8亿美元,复合年增长率为153%。根据Frost & Sullivan数据与预测,2020年全球基因治疗市场规模达20.8亿美元,2016-2020年CAGR为153.3%,预计到2025年全球基因治疗市场规模将达到305.4亿美元,2020-2025年CAGR高达71.2%。
图表12 全球基因治疗市场规模及增速
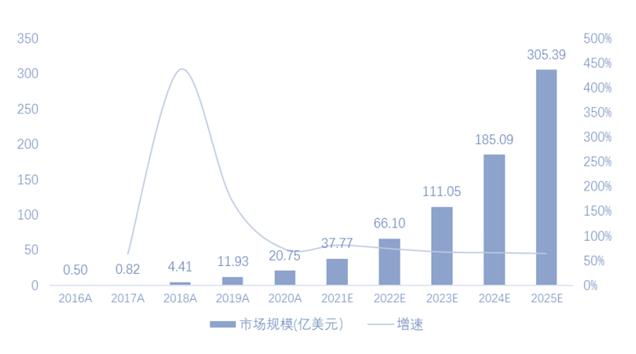
资料来源: Frost & Sullivan,智银医药资料库
2016年至2020年,中国CGT市场从0.02亿美元增长到0.03亿美元,复合年增长率为12%。预测未来中国CGT市场规模仍保持快速增长趋势,于2025年整体市场规模为25.9亿美元,2020到2025年(估计)中国CGT市场复合年增长率为276%。
图表13 全球基因治疗市场规模及增速
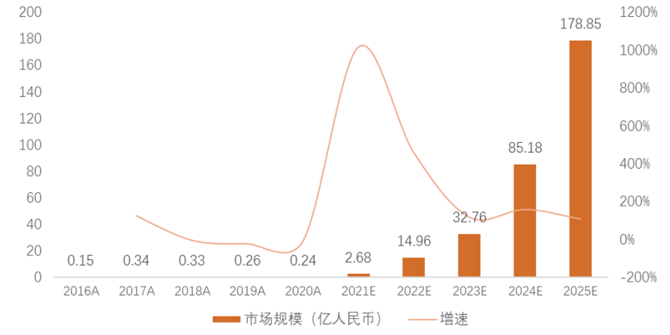
资料来源:Frost & Sullivan,智银医药资料库
2.3 基因治疗中国市场未来发展方向
中国庞大的潜在患者基数对基因治疗需求持续增加,同时大量生物技术公司的涌现、资本市场投融资热潮等因素推动,未来中国基因治疗市场会呈现以下几点发展趋势:
方向一:治疗领域扩增
目前,基因治疗主要针对罕见病与肿瘤治疗。此后,基因治疗也将逐渐向其他疾病扩展适应症。例如,2020年2月,基因治疗公司Genprex宣布与匹兹堡大学达成一项糖尿病基因治疗技术的独家许可协议,将对胰腺细胞进行重新编程,以恢复其补充胰岛素的功能,从而治疗1型和2型糖尿病。目前糖尿病尚无根治的治疗手段,主要干预方式依然是注射胰岛素以控制血糖水平。如果这一细胞和基因治疗产品能够研发成功,将对糖尿病的治疗及慢性病领域产生重大影响。随着基因治疗研究的深入,未来的疗法将不再局限于处理人类基因组中的单个基因缺陷,构建合适的载体获得多个外源基因的高效转移与表达将对存在多个基因缺陷的疾病有重大意义。
方向二:载体的多样化
目前,应用最为广泛的载体当属腺相关病毒载体、慢病毒载体等。近年来,溶瘤病毒作为免疫疗法的新生力量,引起广泛关注,其相关研究也取得巨大进展,疱疹病毒、痘病毒、腺病毒成为目前研究较多的溶瘤病毒毒株。随着基因治疗研发的深入,病毒载体将更为多样化,不断提高导入效率以及安全稳定性。此外,非病毒载体例如裸露DNA、脂质体、纳米载体等因具有成本低、制备简单、便于大规模生产、安全性高、外源基因长度不受限制等优点也将成为重要研发领域。
方向三:CDMO快速发展
CDMO企业多样化的服务内容和积累的基因治疗基础研究与开发改造经验可以为基因治疗企业提供包括细胞与载体选择与优化服务、细胞系与载体构建和病毒包装服务、质量检测服务、临床阶段小规模生产服务以及后期商业化生产服务,节省研发成本和时间,提高成功率。相关研发生产平台齐全,可提供多样化的选择,并减少药企试错成本;专业的QA/QC人员和全过程的严格监管,可确保满足载体生产符合国家GMP质量标准。此外,一些CGT CDMO公司还可提供一站式新药临床试验申请(IND)和新药上市申请(NDA)等法规相关服务,进一步帮助药企加快研发进度。因此,基因治疗产业发展将带动CDMO的市场规模不断扩张。
方向四:支付模式多元化
基因治疗对于罕见病和恶性肿瘤的治疗效果以及近年来医保对于基因治疗支付的积极探索,促进基因治疗商业化进展。以治疗SMA的Zolgensma为例,尽管其价格高昂,但在2019年获批后成为SMA的重磅疗法,美国商业保险机构Cigna对其全额药价覆盖,2020年销售额达到9亿美元。面临高昂价格的争议,CGT企业积极与各国政府及医保体系进行基于价值的多元化支付模式探索。这些支付模式的探索为CGT商业化逐步铺平道路,预计未来对于基因治疗多元化的创新支付模式将惠及更多患者。
方向五:研发成本降低
现已有CGT产品例如CAR-T细胞治疗已经取得临床成功,未来有着巨大的市场潜力,将持续成为热点研发方向。研发人员在进一步优化技术与临床疗效的同时,也在降低研发及治疗的成本。未来病毒载体优化及生产、CAR-T细胞等技术的逐渐成熟将带来成本的下降,基因治疗将扩展应用到更多患者治疗中。
三、基因治疗药物研发现状
前述我们对基因治疗进行了详细的定义,主要包括基因增补和基因编辑两大类别。基因增补技术目前相对成熟,已有不少产品已上市。目前基因编辑暂无已上市产品。2012年是基因治疗领域的快速发展时期,同时也是CRISPR/Cas9 基因编辑技术诞生的年代,因此本文共梳理从2012年到今基因治疗药物研发现状。其中包括已上市产品和在研产品。
3.1 已上市产品(2012-2022)
3.1.1 单质粒
2019年在日本上市的Collategene(beperminogene perplasmid)。Collategene是一种编码肝细胞生长因子(HGF)基因的质粒,注射到人体内后,表达出的肝细胞生长因子能够促进血管的生成,从而治疗缺血性疾病,目前的主要适应症为治疗闭塞性动脉硬化症和血栓闭塞性脉管炎。
图表14 Collategene作用机制
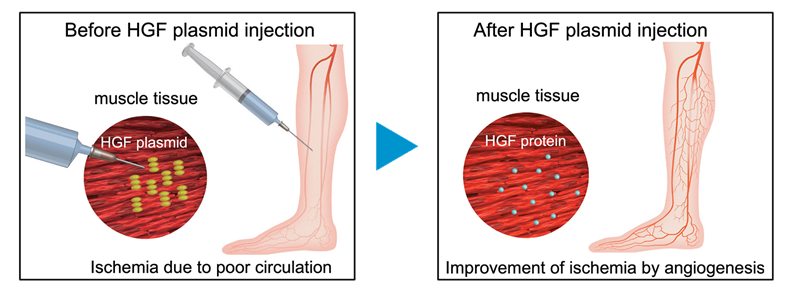
资料来源:Anges,智银全球医药项目库
相关研究表明,病毒载体介导的促血管生成因子基因的传递诱导小鼠心脏血管瘤的形成,将表达血管内皮生长因子的基因工程细胞注入到正常肌肉中,术后24d后也可以观察到血管瘤的形成。因此,为避免促血管生成因子的长期表达,裸质粒是一个很好的选择。Collategene使用I期临床数据获厚生劳动省(MHLW)有条件、有时限批准,未经大型临床试验验证;日本注册性II期临床中6个月随访治疗组与安慰剂组溃疡完全愈合、截肢率和死亡率指标无统计学差异;美国III期临床入组中断;
Collategene含有肝细胞生长因子cDNA和将其转染到人体细胞的质粒,首次获批的适应症为闭塞性动脉硬化症和血栓闭塞性脉管炎。具体使用方法为一只4mg的药物分8个地方注射到患部周围,质粒将肝细胞生长因子插入人体细胞而生效,单次注射费用60万日元约4.1万人民币,有必要时可以四周后重复一次。
图表15 当前上市的单质粒产品

资料来源:Anges,智银全球医药项目库
3.1.2 反义寡核苷酸
反义寡核苷酸是一种单链寡核苷酸分子,通常包含15~25个核苷酸残基。其进入细胞后在核糖核酸酶H1的作用下通过碱基互补配对原则同与其互补的靶信使核糖核酸(messenger RNA,mRNA)结合,抑制靶基因的表达。2012-2022年期间共有8款。
2013年,美国FDA批准的一款包含载脂蛋白B-100的反义寡核苷酸药物Kynamro(mipomersen)用于治疗纯合子家族性高胆固醇血症。
2016年,有2个反义寡核苷酸药物获得美国FDA批准,分别为Spinraza(nusinersen)和Exondys51(eteplirsen)。Spinraza用于治疗脊髓性肌萎缩,Exondys51用于治疗杜氏肌营养不良症。2018年7月,Tegsedi(inotersen)作为一款反义寡核苷酸药物获得EMA批准,用于治疗遗传性甲状腺淀粉样变性。
2019年,Waylivra(volanesorsen)获得EMA批准用于治疗成年人家族性乳糜微粒血症综合征。Vyondys53(golodirsen)获得FDA批准用于治疗杜氏肌营养不良症。
2020年,日本独立行政法人医药品医疗器械综合机构(Pharmaceuticals and Medical Devices Agency,PMDA)批准的Viltepso(viltolarsen),用于治疗杜氏肌营养不良症。
2021年,FDA批准的Amondys45(casimersen)用于治疗杜氏肌营养不良症。
从治疗领域来看,全部是罕见病治疗领域,其中有4个适应证为杜氏肌营养不良症。从开发公司来看,小核酸药物研发公司Ionis公司占5个,Sarepta公司占3个。
图表16 当前上市的反义寡核苷酸产品
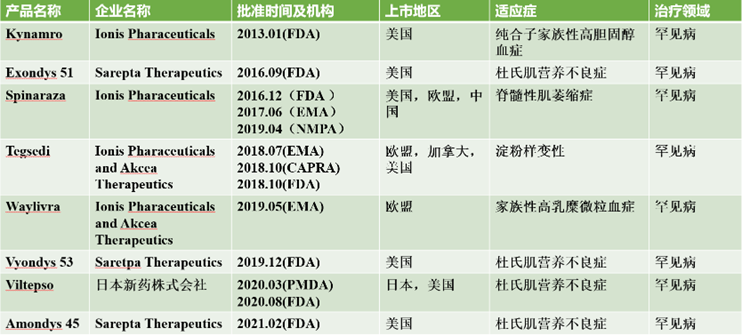
资料来源:智银全球医药项目库
3.1.3 RNAi药物
全球共有4款RNAi药物获批上市,均为2018年后上市产品,4款RNAi药物都是小干扰RNA(small interfering RNA,siRNA)药物,siRNA进入细胞后,与解旋酶和其他因子结合,形成RNA诱导沉默复合物(RNA-induced silencing complex,RISC),RISC与mRNA结合,使得mRNA降解。
2018年,Onpattro(patisiran)作为首个RNAi药物获得FDA和EMA的许可,用于治疗淀粉样变性。
2019年,Givlaari(givosiran)获得FDA批准用于治疗肝卟啉病。
2020年,2款RNAi药物获批上市,Oxlumo(lumasiran)获得EMA和FDA批准用于治疗高草酸尿症,Leqvio(inclisiran)获得EMA批准用于治疗高胆固醇血症。Leqvio的获批上市,也使得RNAi疗法的疾病领域不仅局限于罕见病。
载体上,除Onpattro使用的纳米脂质体,后续3个药物都是使用靶向肝细胞的N-乙酰半乳糖胺(N-acetylgalactosamine,GalNAc)修饰。
图表17 当前上市的RNAi产品
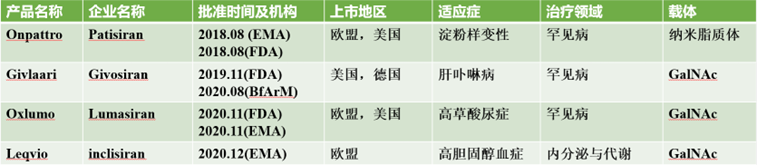
资料来源:智银全球医药项目库
首款siRNA药物Onpattro
Onpattro(patisiran)是Alnylam公司开发的一种靶向转甲状腺素蛋白的RNAi疗法,这类药物通过沉默一部分参与致病的mRNA起作用。Onpattro将siRNA包裹在脂质纳米颗粒中,在输注治疗中将药物直接递送至肝脏,通过与编码异常TTR的mRNA相结合,阻止TTR的产生。2018年8月,该药获得FDA批准,用于由遗传性转甲状腺素蛋白淀粉样变性引起的周围神经疾病(多发性神经病)成人患者,成为首款获得FDA批准的RNAi疗法。
图表18 Onpattro作用机制
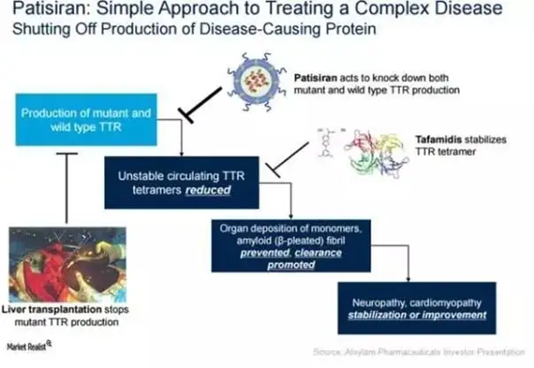
资料来源:生物谷,智银医药资料库
2021年第四季度和全年的全球净产品收入分别为1.39亿美元和4.75亿美元,与2021年第三季度和2020年全年相比,季度和年度分别增长15%和55%。截至2021年12月31日,全球超过2,050名患者接受ONPATTRO治疗。
图表19 Onpattro销售收入
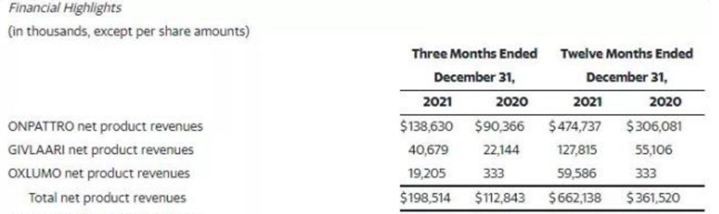
资料来源:Alnylam官网,智银全球医药项目库
3.1.4 重组病毒类药物
病毒因其良好的感染效率和在体内外靶细胞中持久表达的潜力被用于生物研究领域重组细胞的构建以及作为医药领域基因治疗技术的重要载体。而现在,病毒除了可以作为细胞和基因治疗药物的主要工具外,重组病毒也已经作为一类药物进入临床使用。目前,主要应用的病毒包括腺病毒及腺相关病毒、逆转录病毒、单纯疱疹病毒等。2012年-2022年期间,全球共有8款重组病毒类基因治疗药物获批上市。
2012年,EMA批准的Glybera(alipogene tiparvovec)用于治疗家族性脂蛋白脂酶缺乏症,Glybera所用的载体为重组腺相关病毒。Glybera的获批上市是整个基因治疗领域的里程碑,促进了基因治疗的发展。但是,由于高昂的价格以及市场需求有限,Glybera已经撤市。
2015年,Imlygic(talimogene laherparepvec)获得FDA批准用于治疗黑色素瘤,这是FDA批准的首个溶瘤病毒药物,使用的载体为单纯疱疹病毒。
2016年,EMA批准的第二款基因治疗产品,GSK公司的Strimvelis,基于逆转录病毒载体,用于治疗腺苷脱氨酶ADA突变导致的重度联合免疫缺陷症(ADA-SCID),定价仍高居66.5万美元,且ADA-SCID极为罕见,每年欧洲仅新增15例患者,因此截至2017年,仅2名患者接受治疗,2018年4月,GSK将Strimvelis出售给Orchard,当时仅5例患者接受该治疗。
2017年,腺相关病毒载体药物Luxturna(voretigene neparvovec-rzyl)获得FDA批准上市用于治疗经证实的双等位基因RPE65突变相关的视网膜营养障碍性疾病。2019年,美国FDA批准Zolgensma(onasemnogene abeparvovec-xioi)用于治疗脊髓性肌萎缩症。
2019年和2021年,EMA先后批准Bluebird公司基于慢病毒载体的Zynteglo和Skysona产品,分别用于治疗12岁及以上的非β0/β0基因型输血依赖性β-地中海贫血(TDT),和早期脑性肾上腺脑白质营养不良(CALD)。2021年6月,PMDA宣布授予Delytact(teserpaturev)许可,在一定的条件及时限内,允许被应用于治疗恶性胶质瘤患者。
目前已上市的8款重组病毒类药物中,从治疗领域来看,罕见病治疗有6款,肿瘤治疗有两款,使用最多的载体为腺病毒相关载体(AAV)。
图表20 当前上市的重组病毒类产品

资料来源:智银全球医药项目库
(1)Luxturna,收款有效治愈2型先天性黑蒙症LCA
2017年12月,FDA批准的全球首款基因治疗产品Luxturna,用于治疗双等位RPE65 基因突变导致的2型先天性黑蒙症LCA(遗传进行性视网膜罕见病)。
已有研究发现19个与LCA相关的致病基因,其中由RPE65基因纯合子突变导致的 LCA 称为LCAⅡ型,约占LCA的16%。RPE65基因的产物RPE65(视网膜色素上皮。特异性蛋白65kDa)是一种类维生素A异构酶,其功能是将全反式视黄酯转换为11-顺式视黄醛,从而完成视色素的循环再生。RPE65基因突变导致RPE65蛋白失去异构酶活性,缺乏 RPE65 将导致视黄酯的局部堆积,从而引起光感受器细胞的进行性萎缩,不能对光发生反应,患儿出生后即开始出现视力的逐步受损,最终导致视力丧失。Luxturna以AAV2为载体,递送正常的RPE65基因,直接注射到视网膜色素上皮(RPE)细胞中,使视网膜细胞重新获得合成全反式规黄酯异构酶的能力,逐渐恢复视觉感光能力。
患者只需单次注射一支即可达到治疗效果,Luxturna每支价格42.5万美元,双眼治疗费85万美元。2018年,销售额2700万美元截至2019年9月,销售额2800万美元(2019年10月罗氏收购 Spark 后未披露)。
图表21 Luxturna基因治疗产品的作用机制
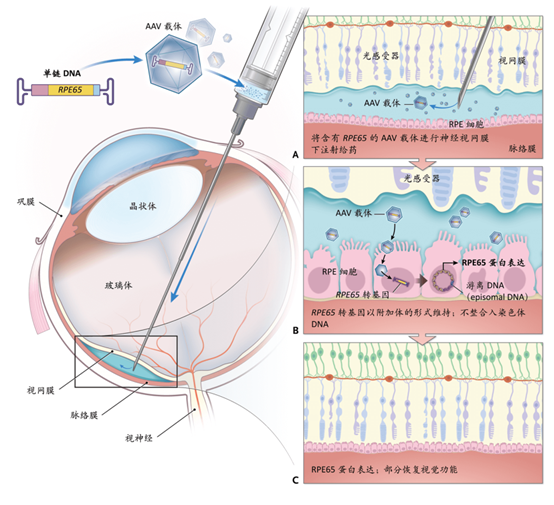
资料来源:Current Opinion in Ophthalmology,智银全球医药项目库
(2)Zolgensma,FDA批准“全球最昂贵药物”,有效治愈脊髓性肌肉萎缩症SMA
2019年5月,FDA批准的诺华公司的Zolgensma产品,用于治疗2岁以下的脊髓性肌肉萎缩症SMA。2018年5月,SMA被列入国家卫健委等部门联合制定的《第一批罕见病目录》。SMA是一种运动神经元性疾病,婴幼儿时期发病,由存活运动神经元1(SMN1) 基因突变导致。 该基因编码存活运动神经元(SMN)蛋白,这是一种遍布全身的蛋白质,对于称为运动神经元的特异神经细胞的维持和功能至关重要,大脑和脊髓中的运动神经元控制整个身体的肌肉运动。由SMN1基因突变引起的SMA通常根据发病年龄和严重程度分为几种亚型。婴儿期发病的SMA是最严重和最常见的亚型。患有这种疾病的儿童抬头、吞咽和呼吸都有问题。这些症状可能在出生时出现,也可能在6个月后出现。在新生儿中,SMA发病率为六千分之一至一万分之一,预计国内SMA患者约1200-2000人。常规人群中,约每40人~50人就有1个是SMA致病基因携带者。
Zolgensma以AAV9为载体,能够透过血脑屏障,将SMN1基因递送到中枢神经系统。Zolgensma是全球最昂贵的药物,定价高达 212.5 万美元,不过患者只需接受一次静脉注射给药,就能在细胞中长期表达SMN蛋白,实现长期缓解甚至治愈。
图表22 SMA致病机理
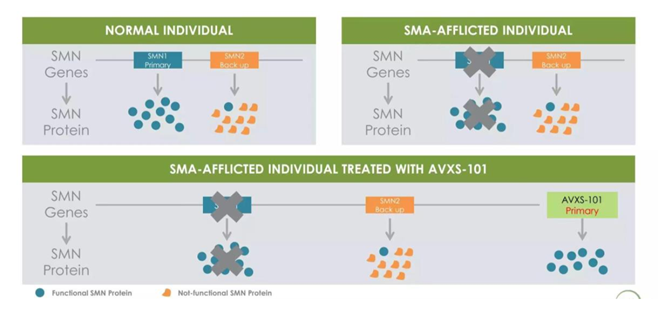
资料来源:蛋壳研究院,智银全球医药项目库
目前Zolgensma已经在全球近40个国家和地区获批,2019年获批当年销售额3.61亿美元,2020年Zolgensma的销售额达9.2亿美元,同比增长151%。2021年销售额13.51亿美元,增速47%。2022Q1销售额3.63亿美元,增速18%。2020年5月,Zolgensma被纳入日本医保,患者只需支付30%费用,2021年3月Zolgensma被纳入英国国家医疗服务体系。
图表23 Zolgensma 2019年至今销售额
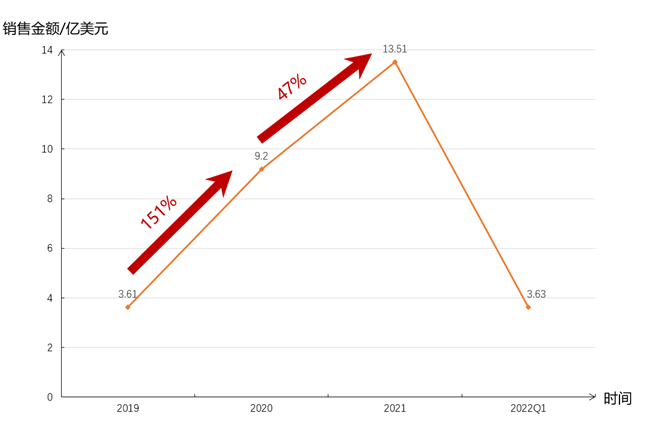
资料来源:智银医药资料库
3.2 在研产品(2012-2022)
目前海外的基因治疗在研产品相对丰富,有不少产品已经进入到拟上市/上市阶段,而在国内,无论是基因增补还是基因编辑,国内的管线整体进度都较为缓慢,基因编辑大部分都处于临床前研究。
3.2.1 基因增补
基因增补在研管线丰富,海外不少产品已进入拟上市/上市申请或临床后期阶段
在海外,2022年即将有5款拟上市产品(其中3款近期已上市),以及4款拟提交上市申请BLA的产品,以及十几款已经进入临床3期的在研管线。纵观海外基因增补技术的在研管线,我们发现,产品以体内基因治疗为主,且基于AAV载体;体外治疗大多基于LV载体,包括Bluebird公司的两款产品beti-cel(已上市)和eli-cel,PDUFA目标日期分别为2022年8月19日和2022年9月16日。近期beti-cel疗法已获FDA上市许可,成为潜在的美国首个针对β地中海贫血患者的慢病毒载体基因疗法。此前FDA曾授予Instiladrin产品快速通道资格,突破性疗法认定和优先审评资格,并接收递交的BLA。如果2022年获得批准,该疗法将为对BCG无反应的NMIBC患者提供一个有希望的选择。OTL-103产品已获得FDA授予的孤儿药资格和罕见儿科疾病(RPD)资格。Etranacogene dezaparvovec 产品可能是潜在的第一个为血友病B患者提供持久、功能性治疗益处的基因疗法。BMN270产品获得FDA和EMA的孤儿药指定,于2022年8月24日获得FDA上市许可,用于治疗重度血友病A。
图表24 海外拟(近期已)上市基因增补产品
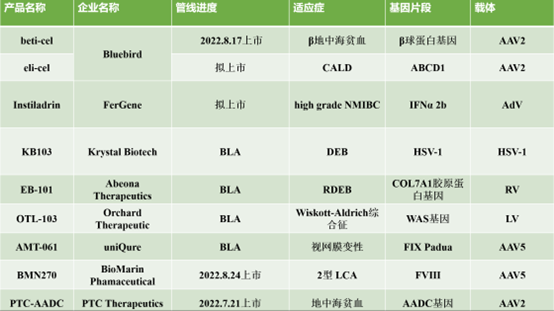
资料来源:智银全球医药项目库
图表25 海外临床Ⅲ期基因增补产品
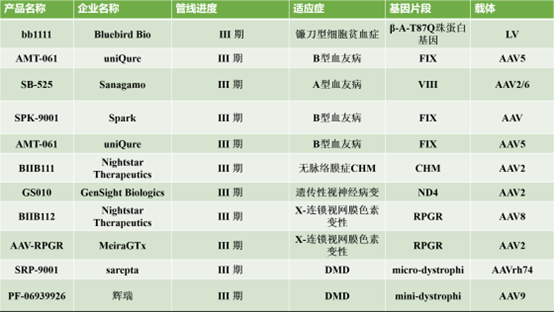
资料来源:智银全球医药项目库
首款针对β地中海贫血患者基因疗法Zynteglo获得FDA批准
β地中海贫血是一种严重的遗传病。由于编码β珠蛋白的基因发生突变,患者体内的血红蛋白水平显著下降,甚至缺失。为了生存,患者不得不终身接受输血治疗。虽然输血可以暂时缓解与严重贫血相关的症状,包括疲劳、虚弱和呼吸急促,但它们并不能从根本上治疗疾病,并可能产生因为铁过载和多器官损伤导致的严重并发症。
Zynteglo是一款一次性基因疗法。它将从患者体内分离的造血干细胞在体外进行基因工程改造,让它们能够生成功能正常的β珠蛋白。这些造血干细胞在输注回患者体内后,会源源不断地生成具有正常功能的血红细胞,极大减少患者对输血的需求。在理想情况下,患者甚至不需要进行输血治疗。这款疗法此前已获得FDA授予的孤儿药资格、突破性疗法认定和优先审评资格,并在欧盟获得批准。
图表26 Zynteglo示意图
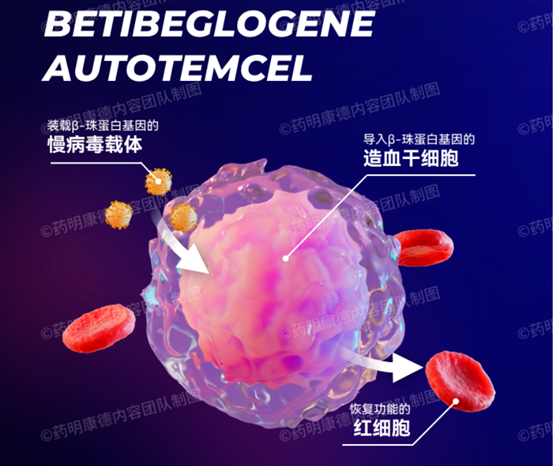
资料来源:药明康德,智银医药资料库
全球首个直接注入大脑的AAV基因疗法获批上市
2022年7月21日,PTC Therapeutics, Inc.(纳斯达克股票代码:PTCT)宣布,Upstaza™(eladocagene exuparvovec)已获得欧盟委员会的上市许可。Upstaza 是第一个获批的针对芳香族 L-氨基酸脱羧酶(AADC)缺乏症的基因疗法,也是第一个直接注入大脑的上市基因疗法,它被批准用于治疗年龄为18 个月及以上的患者,上市许可适用于所有 27 个欧盟成员国,以及冰岛、挪威和列支敦士登。
Upstaza™是一种以2型腺相关病毒(AAV2)为载体的体内基因疗法,患者由于编码AADC酶的基因出现突变而致病,AAV2携带编码AADC酶的健康基因,以基因补偿的形式达到治疗效果,理论上一次给药长期有效。
在Upstaza临床研究中,无法达到预期运动发育里程碑的患者在接受此疗法治疗3个月后就能观察到具有临床意义的运动功能改善,这一转变持续到接受治疗后10年。此外,所有接受治疗的患者的认知能力均得到改善。
图表27 Upstaza作用示意图
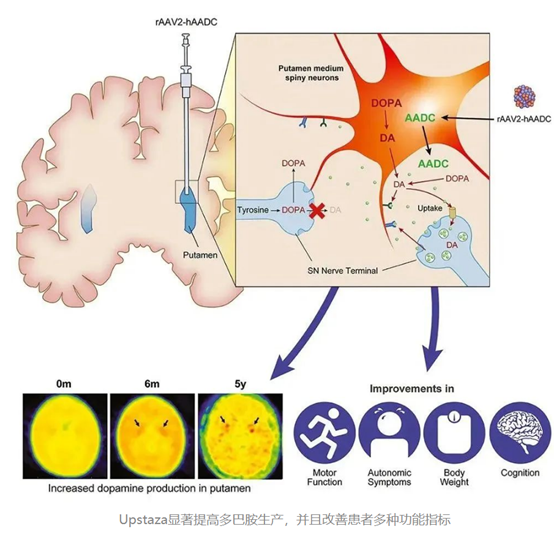
资料来源:PTC官网,智银全球医药项目库
国内基因增补管线整体进展较慢,适应症集中于眼科遗传病及血友病
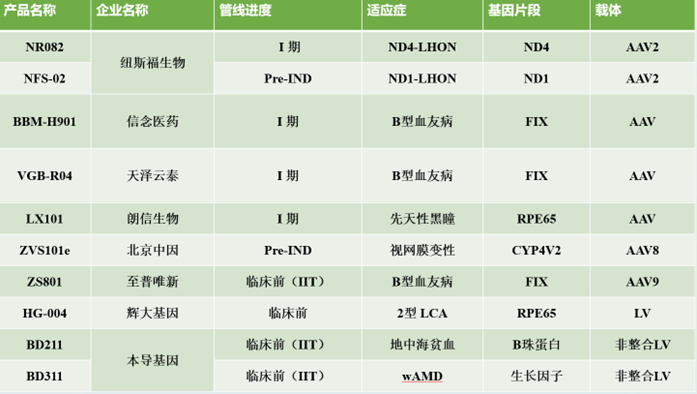
国内基因增补管线整体进展较慢,多处于临床1期,适应症集中于眼科遗传病和血友病。纵观国内基因增补技术的在研管线,我们发现,产品基本为体内途径,且基于 AAV 载体,仅本导基因基于LV平台有相关管线。数家国内研发药企的管线获得FDA的孤儿药认定(ODD),包括纽福斯生物的NR082( NFS-01),天泽云泰的VGB-R04,北京中因的ZVS101e。
纽福斯生物的NR082(NFS-01)产品用于治疗ND4突变引起的Leber遗传性视神经病变(ND4-LHON)。2021年3月30日,获得中国IND,2022年1月19日,获得美国临床批件。国内首个获得临床试验许可的眼科体内基因治疗药物,并已于2020年9月获得美国FDA孤儿药认定(ODD)。2022年1月24日,获欧洲药品管理局(EMA)孤儿药品委员会(COMP)授予孤儿药身份(ODD)。NFS-02产品用于治疗ND1突变引起的Leber遗传性视神经病变(ND1-LHON) ,处于Pre-IND(IND申报准备)阶段。2022年1月19日,获美国食品药品监督管理局(FDA)的孤儿药认定(ODD)。
信念医药的BBM-H901产品用于治疗B型血友病。 2021年8月6日获得IND,2021年12月30日完成首例给药。国内第一个获批进入注册临床试验的血友病AAV基因治疗药物,也是国内第一个全身给药的罕见病基因疗法用药。
天泽云泰的VGB-R04产品用于治疗B型血友病。2022年4月20日获得IND,完成首例给药。2021 年12月获得美国FDA的孤儿药认定(ODD),这是首个中国自主研发用于血友病B的体内基因治疗产品获得该认定。
朗信生物的LX101产品用于治疗RPE65双等位基因突变的先天性黑矇LCA 2022年4月19日获得IND。
北京中因的ZVS101e产品用于治疗CYP4V2突变导致的结晶样视网膜变性BCD,处于Pre-IND阶段。2021年8月获得美国FDA孤儿药资格授权。
另有部分处于临床前研究阶段(包含研究者发起的临床IIT)的管线。
至善唯新的ZS801产品用于治疗B型血友病,2022年2月,由至善唯新合作发起的“ZS801项目”——AAV(腺相关病毒)载体表达人凝血因子IX基因治疗技术在血友病B患者中的安全性和有效性的临床研究,即将在中国医学科学院血液病医院开展。
辉大基因的HG-004用于治疗2型先天性黑蒙症LCA,以及本导基因的BD211(体外)和BD311产品,分别用于治疗地中海贫血和湿性老年性黄斑变性(wAMD)。本岛基因的慢病毒载体转导自体CD34+造血干细胞治疗输血依赖型β-地中海贫血,已完成2例IIT人体临床,这是国内首次基于慢病毒载体基因转导技术治疗中重型地中海贫血的成功案例。基于BDlenti技术平台开发的基因编辑治疗湿性老年性黄斑变性(BD311)也已完成1例IIT人体临床。
图表28 国内临床阶段基因增补产品
资料来源:智银全球医药项目库
3.2.2 基因编辑
在基因编辑领域,研发管线集中于CRISPR/Cas9技术。CRISPR/Cas9的三位发明者奠定其成为基因编辑领域“三巨头”的基础,Emmanuelle Charpentier教授,Jennifer Doudna 教授,以及张锋教授,分别创立全球领先的基因编辑公司CRISPR,Intellia,Editas。其中,CRISPR公司的CTX001是全球进展最快的体外基因编辑疗法,计划在2022年底提交BLA,用于治疗输血依赖性β地中海贫血症(TDT)和镰状细胞贫血(SCD),已获得美国FDA授予再生医学高级治疗产品(RMA)、快速通道资格(FTD)和孤儿药资格(ODD),获得欧盟委员会授予ODD。
Intellia公司的NTLA-2001是全球最值得期待的体内基因编辑疗法,采用LNP递送全核酸基因编辑药物(Cas9mRNA+sgRNA),用于治疗遗传性转甲状腺素蛋白淀粉样变性合并多发性神经病(ATTRvPN),2021年10月,NTLA-2001获得FDA授予的孤儿药资格(ODD)。
Editas公司的AGN-151587(EDIT-101)是全球首个基于体内CRISPR的基因编辑技术,用于治疗 Leber先天性黑蒙症10型(LCA10),然而,早期临床结果虽证实其安全性,在疾病症状改善方面却不尽人意。
而国内基因编辑管线整体仍处于临床早期阶段。进展最快的是博雅辑因的体外疗法 ET-01,处于临床1期,体外疗法还有瑞风生物的RM001。体内疗法包括本导基因的 BD111,北京中因的ZVS203e,以及辉大基因的HG-203。
博雅辑因的ET-01产品用于治疗输血依赖性β地中海贫血症(TDT)。2021年1月18日,获得IND,2021年9月8日,完成首例患者入组。国内首个获国家药监局批准开展临床试验的基因编辑疗法产品和造血干细胞产品。
瑞风生物的RM001产品用于治疗β地中海贫血症,处于临床前阶段。
2022年5月6日,瑞风生物将在2022EHA年会上首次公开报道β-地中海贫血基因编辑治疗产品RM-001的初步临床研究成果。针对RM-001开展的临床研究结果显示,所有患者均在回输细胞后1-2个月内顺利摆脱输血依赖出院。此次在EHA亮相的研究标题为:自体HBG1/2启动子修饰的CD34+造血干细胞/祖细胞(RM-001)治疗输血依赖型β-地中海贫血的初步安全性和有效性研究(两位患者均随访超过5个月,状况良好)。这是全球范围内首次报道的基因编辑修饰γ-珠蛋白启动子的地贫临床研究,同时也是中国药企首次在国际会议和EHA上报道的地贫基因编辑临床结果。
本导基因的BD111产品用于治疗单纯疱疹病毒性角膜炎(HSV),处于Pre-IND阶段。基于BDmRNA递送专利技术开发的基因编辑治疗病毒性角膜炎(BD111),已完成3例IIT人体临床,是全球唯一慢病毒递送Cas9 mRNA技术,世界第二例人体CRISPR-Cas9基因编辑治疗的人体临床研究项目。本导基因研究团队通过基因编辑和递送技术的融合,全球首创基因治疗递送载体——类病毒体-mRNA(VLP-mRNA),并利用该递送技术进行CRISPR基因编辑治疗病毒性角膜炎的临床前研究,实现从角膜到三叉神经节的逆行运输,终于将潜藏在神经节的HSV-1病毒库清除。
北京中因的ZVS203e产品用于治疗Rhodopsin基因突变导致的常染色体显性遗传视网膜色素变性(adRP),处于临床前阶段。
辉大基因的HG-203产品用于治疗湿性老年性黄斑变性(wAMD),处于临床前阶段。国内唯一一家拥有自主知识产权CRISPR-Cas基因编辑工具的企业,使用AAV9 载体携带RNA编辑工具,通过玻璃体腔注射,敲低VEGFA基因的mRNA。
CRISPR公司·CTX001——全球进展最快的体外基因编辑疗法
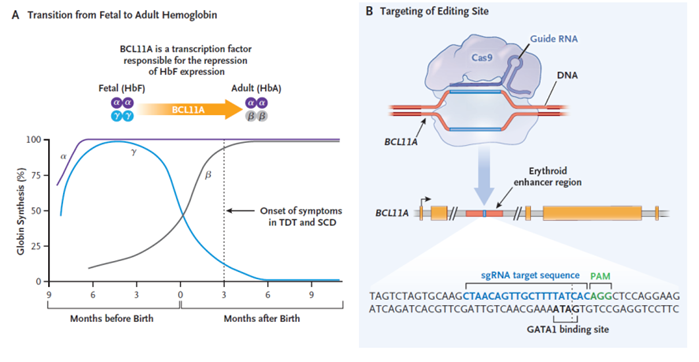
目前,全球进展最快的体外基因编辑疗法是CTX001由诺奖获得者Emanuelle Charpentier于2013年创立的CRISPR Therapeutics公司和Vertex Pharmaceuticals公司合作研发,用于治疗输血依赖性β地中海贫血症(TDT)和镰状细胞贫血(SCD)。CTX001治疗TDT和SCD已获得美国FDA授予再生医学高级治疗产品(RMA)、快速通道资格(FTD)和孤儿药资格(ODD),获得欧盟委员会授予ODD。Vertex 计划在2022年底提交CTX001用于治疗这两种适应症的全球(包括美国 FDA)生物制品许可申请BLA)。TDT和SCD都是由于编码血红蛋白的基因发生突变而造成的血液疾病。BCL11A基因指导胎儿到成人血红蛋白的过渡,BCL11A是一种转录因子,负责抑制胎儿血红蛋白(HbF)表达。严重患者通常需要经常接受血红细胞输入进行治疗,不但给患者带来不便,而且长期血红细胞输入会带来铁元素过载等副作用。
图表29 CRISPR/Cas9 在CTX001的作用机制
资料来源:NEJM,智银全球医药项目库
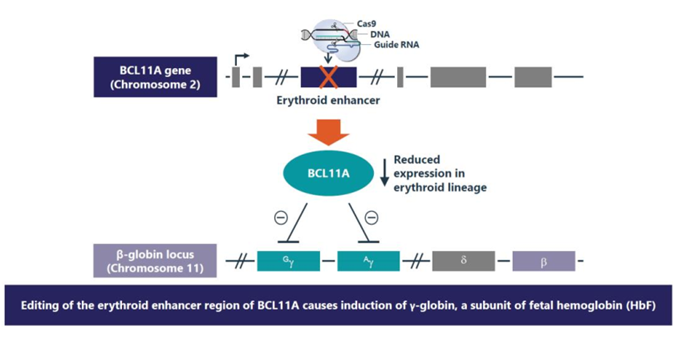
CTX001采用体外基因编辑疗法,利用CRISPR技术,通过电转在体外对患者的造血干细胞进行改造后再回输。患者首先接受干细胞动员和清血采集,得到的造血干细胞和祖细胞(HSPCs)经CRISPR-Cas9制备成CTX001,接下来在白消安清髓后,患者接受CTX001输注。CRISPR技术的sgRNA,靶向BCL11A基因,该基因在人体内与胎儿血红蛋白的表达密切相关。上述两种贫血的患者在婴儿期没有明显症状,就是因为体内还有较多的胎儿血红蛋白,尚未转变成成年患者体内的异常血红蛋白。通过 CRISPR-Cas9基因编辑患者的自体造血干细胞,降低 BCL11A 基因的表达,促进红细胞中重新产生高水平的胎儿血红蛋白(HbF)。HbF是携带氧气的血红蛋白的一种形式,在出生时自然存在,随着婴儿的长大,血液中的血红蛋白转换为成人形式的血红蛋白。 因此,通过CTX001治疗,可以提高HbF水平,缓解TDT患者的输血需求,并减少SCD患者的疼痛和使人衰弱的血管闭塞性危象(VOC)。
图表30 CTX001治疗的作用机制
资料来源:CRISPR Therapeutics,智银全球医药项目库
Intellia 公司·NTLA-2001——体内基因编辑
在体内基因编辑领域,NTLA-2001有望成为首个治疗ATTR淀粉样变性疾病的疗法,用LNP递送全核酸基因编辑药物(Cas9 mRNA+sgRNA)。2021年06月26日,NEJM发表的CRISPR体内基因组编辑疗法NTLA-2001在1期临床试验中获得积极结果。6名接受治疗的患者中,3名患者接受0.1mg/kg剂量,3例患者接受0.3mg/kg剂量,接受治疗28天后,两种不同剂量的患者血浆种TTR蛋白水平分别平均下降52%和87%,其中一名患者TTR水平下降96%。同天,Intellia Therapeutics公司(NTLA.US)和再生元(Regeneron)公司(REGN.US)也联合宣布其在研CRISPR体内基因组编辑疗法NTLA-2001的临床结果
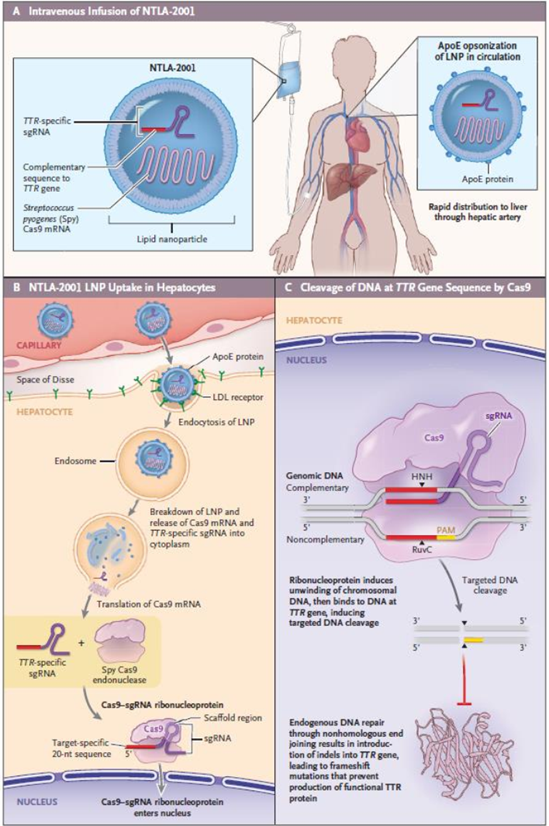
2020年10月,Intellia Therapeutics宣布,MHRA授权该公司启动1期临床试验,将评估其基因编辑疗法NTLA-2001的安全性和有效性。2021年10月,NTLA-2001获得FDA授予的孤儿药资格(ODD)。转甲状腺素蛋白淀粉样变性,或ATTR淀粉样变性,是一种危及生命的罕见进行性的遗传病。在老年人中,遗传性淀粉样变性基因(TTR)突变会导致甲状腺功能异常。这些错误折叠的转甲状腺素蛋白(TTR)在体内堆积形成淀粉样蛋白,导致心脏、神经和消化系统等多个组织出现严重并发症。ATTRv淀粉样变性主要表现为多发性神经病(ATTRv PN),可导致神经损伤,或心肌病(ATTRv-CM),可导致心力衰竭。据估计,全球大约有5万名患者,大部分患者从出现症状起预期生命仅为2-15年。NTLA-2001是第一个通过静脉注射的基于CRISPR/Cas9的疗法。通过脂质纳米颗粒(LNP)递送载体,将携带靶向治病TTR基因的sgRNA和优化的spCas9蛋白的mRNA序列(后者执行精准编辑),递送至肝脏,特异性敲除TTR基因,旨在通过降低血清中TTR的浓度来治疗ATTR淀粉样变。
1. NTLA-2001静脉输液:NTLA-2001 LNP(脂质纳米颗粒)包裹:TTR-specific sgRNA(TTR基因向导RNA)、Complementary sequence to TTR gene(TTR基因互补序列)、streptococcus pyogenes Cas9 mRNA(化脓性链球菌-Cas9信使 RNA)。脂质体LNP表面布满ApoE蛋白质,用于和肝细胞表面结合,促进肝细胞吞噬;通过肝动脉快速进入肝脏。
2. NTLA-2001 LNP肝细胞吸收过程:NTLA-2001 LNP经毛细血管,越过disse腔,ApoE蛋白质特异性结合肝细胞表面的低密度脂蛋白受体(LDL receptor),NTLA-2001 LNP被肝细胞内吞形成内涵体(Endosome),NTLA-2001 LNP破裂,Cas9信使RNA和TTR基因互补序列进入细胞质,Cas9信使RNA被翻译成Cas9核酸内切酶,并与TTR基因互补序列形成Cas9-向导 RNA核糖核蛋白,然后进入细胞核。
3. Cas9核酸内切酶对TTR基因的切除:Cas9-向导 RNA核糖核蛋白促使DNA双链解旋,精准定位TTR基因。Cas9核酸内切酶有两个功能结构域:RuvC和HNH,当两个结构域激活时,HNH核酸酶结构域剪切互补链,RuvC结构域剪切非互补链,在基因组上产生双链断裂,以此达到切除TTR基因的目的。
图表31 NTLA-2001的作用机制
资料来源:NEJM,智银全球医药项目库
3.3 基因治疗递送方式
3.3.1 现存递送载体
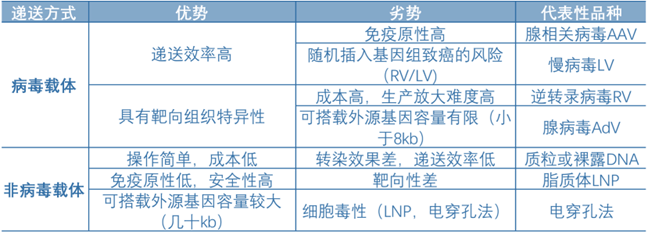
基因治疗研发的核心是递送方式,病毒载体由于其天然转导效率高的优势被广泛应用,其中,腺相关病毒载体AAV是全球目前临床研究和使用最多的载体。通过前文阐述基因治疗的具体定义及技术路径。
可以发现,基因治疗过程中必不可少的关键步骤就是外源基因的导入,即“递送方式”。目前递送方式可分为两大类,一类是病毒载体(生物学方法),一类是非病毒载体(物理和化学法)。经人工改造失去致病能力的病毒载体是当前被广泛应用的递送方式,关键优势在于其天然转导效率高。重组腺相关病毒载体rAAV是临床应用最广泛的载体,因为AAV是目前最安全的病毒载体,不仅免疫原性低,非致病性,同时具备不整合宿主基因组保障安全性和组织靶向特异性的优势。
基因治疗的一大核心是递送方式,理想的递送方式需具备多项要素。 前文已经详细阐述基因治疗的作用机制,理论上,只要将目标基因精准递送到患者的靶细胞即可起到治疗效果,但实际上,基因达到靶细胞的效率,即“递送效率”并不理想,例如眼科疾病的递送效率仅20-40%,而脑科疾病甚至低于10%。
因此,从需求出发,理想的基因治疗载体需具备如下特征:首先能够剔除自动复制自身载体的能力,具有高转导效率,能感染分裂和非分裂的细胞;能靶向特定的细胞,且可以长期稳定表达转基因;同时具有较低的免疫原性或致病性,不会引起炎症;具备足够的空间来递送大片段的治疗基因;从商业化角度,需具备大规模生产(稳定可纯化易制备)的工艺等优点。经人工改造失去致病能力的病毒载体是当前被广泛应用的递送方式,关键优势在于其天然转导效率高。
目前基因治疗的递送方式可分为两大类,一类是病毒载体(生物学方法),一类是非病毒载体(包括物理和化学法)。病毒载体具备转导效率高、具有靶向组织特异性的核心优势,但存在免疫原性较高,慢病毒随机插入基因组致癌风险等安全性问题,以及规模化放大生产的瓶颈有待突破,代表性的病毒载体包括腺相关病毒AAV,慢病毒LV,逆转录病毒RV,腺病毒AdV等。非病毒载体免疫原性低,可搭载外源基因容量较大,且操作简单,成本低,但存在转染效果差,递送效率低,靶向性差等症结问题,代表性品种包括质粒或裸露的DNA,脂质体LNP,以及物理电穿孔法等。
因此,目前人工改造的病毒是基因治疗中最常用的载体,根据ASGCT数据,89%在研CGT项目采用病毒载体作为递送系统。
图表32 基因治疗的递送方式
资料来源:智银医药资料库
3.3.2 不同病毒载体对比
天然病毒本身具备强感染性及天然将自身基因导入靶细胞的优势,因此病毒载体一旦经人工改造,剔除其“致病能力”,即可在利用病毒“强感染性”进行外源基因导入的同时,避免病毒本身致病性给患者带来的安全隐患。以逆转录病毒为例,病毒感染细胞并表达基因的过程:病毒先与细胞表面的受体结合,通过内吞进入细胞,病毒逆转录酶将病毒RNA逆转录为DNA并插入宿主基因组中,因此病毒的遗传信息可以永久性地存在于宿主细胞中,并随细胞的分裂传递给子代细胞。因此,基因治疗的过程即,首先经人工改造得到低毒性、复制缺陷的工程病毒载体,利用基因重组技术将目标基因添加到病毒载体基因组中,再利用病毒感染患者细胞并表达自身基因组的天然能力,在细胞内表达患者自身缺失基因的功能性拷贝,并产生相应功能性蛋白,达到治疗目的。
病毒载体是否整合进宿主细胞基因组,决定药物的应用场景。 回顾我们前文梳理的已获批上市的基因增补产品,可以发现,当前获批的三款体内基因治疗产品Glybera、Luxturna和Zolgensma均采用腺相关病 AAV载体,而获批的三款体外基因治疗产品 Strimvelis、Zynteglo和Skysona分别采用逆转录病毒载体RV和慢病毒载体LV(第二代逆转录病毒)。这是因为,逆转录病毒载体RV、慢病毒载体LV由于能整合进宿主细胞基因组这一特性,常用于体外CGT将目的基因导入造血干细胞或T细胞(细胞治疗 CAR-T)中,实现基因的长期表达;而腺相关病毒载体AAV和腺病毒载体AdV由于感染过程温和、表达长效等优势,常用于体内CGT,避免外源基因随机插入致癌的风险。AAV和LV是CGT领域最常用的病毒载体。常见的病毒载体包括逆转录病毒载体RV,慢病毒载体LV,腺相关病毒载体AVV和腺病毒载体AdV。下表展示各类载体的特点,具体信息在后文中有说明.
图表33 不同病毒载体特点

资料来源:蛋壳研究院,智银医药资料库
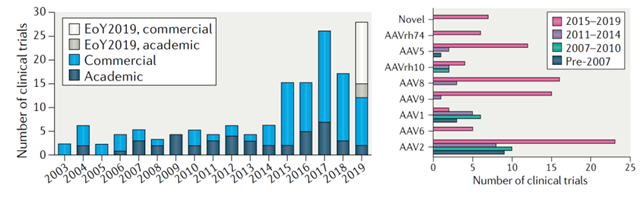
AAV是全球临床研究和使用最多的载体。基于AAV的细胞与基因治疗临床试验,是临床试验中使用最多的病毒载体。
全球采用rAAV的基因治疗临床试验数量激增。根据Nature Reviews Drug Discovery披露,从2003年到2019年,使用AAV作为载体的临床研究逐年增多,就目前来看,大多数研究处于临床早期阶段。2003-2019年合计登记149项临床试验。每年启动的试验数量从2010年的5项增加到2017年的26项。AAV亚型中,AAV2最常用,AAV8和AAV9近年增多。从临床试验来看,AAV主要用于眼部、大脑、肌肉和肝脏疾病的治疗中。据Dmitry A. Kuzmin等统计,AAV2血清型使用最多,其最具安全性和有效性。2015年以来,AAV8和AAV9逐步成为治疗中枢神经系统疾病CNS的临床选择。
图表34 采用rAAV临床数量变化以及AAV不同血清型的临床数量
资料来源:NRDD,智银全球医药项目库
下文介绍各个类型载体的具体的优劣势以及特点。
逆转录病毒载体RV
逆转录病毒RV呈球形,是具有囊膜的单链RNA病毒,直径为 80-130nm。RV由两条相同的单链RNA、逆转录酶以及包裹其外的核衣壳和包膜组成。第一代逆转录病毒以γ-retrovirus和C-type retrovirus为代表,其中γ-逆转录病毒载体能整合到宿主细胞基因组中,1990年作为第一个被FDA批准的病毒载体用于针对ADA-SCID的临床试验中。优劣势:逆转录病毒RV虽具备长期稳定的基因表达,感染细胞谱系广的优势,但面临着潜在基因毒性,基因插入突变的风险,同时不具有组织靶向特异性,以及仅感染分裂细胞(对神经细胞等终末分化细胞导致的基因疾病无用)等劣势。2000年代,就有患者在接受逆转录病毒基因治疗后患上白血病,FDA也因此停止了数十项逆转录病毒基因治疗临床试验。相关研究表明,RV整合目标位点的选择不是随机的,病毒载体优先靶向某些区域,产生原癌基因的顺式激活或抑癌基因的抑制,以及内源性基因与病毒蛋白相互作用的反激活。
慢病毒载体LV
由于第一代逆转录病毒RV存在的安全性问题, 第二代逆转录病毒应运而生,代表性产品如慢病毒载体LV。慢病毒载体LV来源于HIV-1型病毒,也是具有囊膜的单链RNA病毒。优劣势:相较于逆转录病毒RV,慢病毒载体LV能够转染分裂或非分裂细胞,在适应症的拓展上更具优势,同时,慢病毒LV基因插入方式,使得诱发癌病的风险降低,提升安全性(因为慢病毒的基因组随机插入宿主细胞基因组的编码区,专一性不强,避免集中插入癌症基因附近、激活原癌基因,因此诱癌风险降低)。不过,慢病毒作为第二代逆转录病毒,仍面临着潜在基因毒性,基因插入突变的风险,同时不具有组织靶向特异性等弊端。回顾第一章对基因治疗发展历程的阐述,Bluebird公司的两款基于慢病毒载体LV的基因治疗产品LentiGlobin和Skysona,分别于2021年2月和8月因安全性问题(患者出现急性髓细胞白血病(AML)和骨髓细胞异常增生症(MDS))被暂停临床试验。但经调查,虽然LV整合患者的VAMP4基因,但无证据表明VAMP4基因与AML或基因组稳定性相关,因而,2021年12月,FDA 授予 Skysona 产品优先审查。
腺相关病毒载体AAV
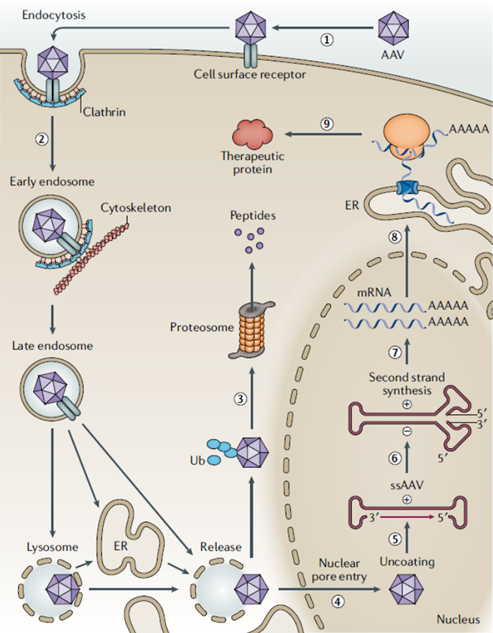
AAV是微小病毒科家族成员之一,是一类无法自主复制、无被膜的20面体微小病毒,其直径仅18-26nm,含有4.7kb左右的线状单链DNA作为基因组。临床采用的重组腺相关病毒载体(recombination adeno-associated virus,rAAV)是在非致病的野生型AAV基础上改造而成的基因载体,rAAV已成为基因治疗的主要递送载体。
rAAV只需保留ITRs,将原基因组替换为目标基因实现重组载体的构建。野生型的AAV基因组包括Rep基因(AAV复制和包装蛋白)和Cap基因(AAV外壳蛋白),两侧有两个末端反向重复序列(ITRs)。重组载体rAAV携带的衣壳蛋白与野生型AAV基本相同,但rAAV衣壳内的基因组中编码病毒蛋白的部分被删除,被替换为治疗性转基因(GOI)。值得一提的是,AAV基因组中唯一被保留的部分是ITRs,只有145 bp的ITRs对于rAAV的增殖是必要的,ITRs引导基因组的复制和病毒载体组装,在载体生产和确保在细胞中持久转导发挥重要作用。移除96%的AAV基因组,不仅最大化rAAV携带目标基因的容量,同时降低病毒载体的免疫原性和细胞毒性。研究表明AAV通过在细胞表面结合主受体和共受体感染靶细胞,从而触发其内吞进入内小体。AAV病毒粒子从核内体中释放并在细胞核周围区域积累。AAV病毒粒子一旦进入细胞核,就会脱壳并释放其单链基因组,并将其转化为双链DNA(dsDNA)模板,在双链DNA板上进行转基因的转录和翻译。
图表35 rAAV载体转导过程
资料来源:Nature review,智银医药资料库
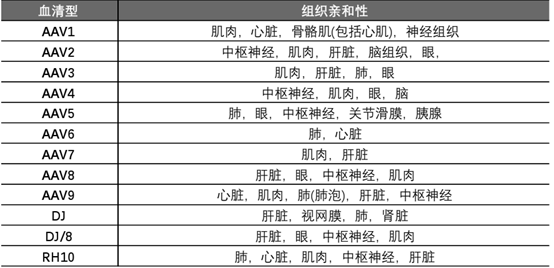
AAV核心优势:安全性,不整合宿主基因组,靶向组织特异性。AAV是目前最安全的病毒载体,免疫原性低,非致病性。因为AAV缺乏独立复制能力,只有当辅助病毒(腺病毒、单纯疱疹病毒)存在时才能复制、感染并裂解宿主细胞,否则只能达到溶源性潜伏感染(感染宿主细胞并潜伏,但不会裂解宿主细胞)。AAV相较于逆转录病毒和慢病毒的核心优势还体现在两方面,不整合宿主基因组和组织靶向性。一是不整合宿主基因组避免致癌风险,同时能做到长期稳定,尽管AAV没有基因组的整合,但AAV基因组进入体内后,跟组蛋白结合,形成一个类似染色体的结构,非常稳定不会被降解。目前人体内的数据比较有限,但在狗的B型血友病实验中,给药13年以后效果依然非常好。二是组织靶向性提高特异性,目前己发现AAV至少有12种天然血清亚型及120多种变型,每一种AAV血清型具有不同的组织趋向性,可靶向不同的组织。不过,AAV由于自身基因组小,可搭载的外源基因有限,而且AAV不整合宿主基因组,因此其搭载的外源基因可能随着细胞的分裂而稀释。
图表36 AAV不同血清型的组织靶向特异性不同
资料来源:Cell,智银医药资料库
腺病毒载体AdV:AdV是无包膜的双链DNA病毒,直径70~90nm,和AAV一样不整合宿主基因组。优劣势:AdV虽然也提供组织靶向特异性,但免疫原性高,系统给药可导致全身炎症反应,已有致死病例记录,且AdV在机体内表达持续时间仅3周,较AAV载体过于短期。目前常用的AdV亚型为5型和2型。我国目前有两款已上市的腺病毒载体药物,深圳赛百诺的重组人P53腺病毒注射液和上海三维的重组人5型腺病毒注射液。
四、基因治疗药物CDMO行业助力行业发展
目前基因治疗行业CDMO助力产业链上游,解决病毒载体规模化生产的瓶颈,降低生产成本,助力基因治疗的商业化进程。病毒载体的规模化生产面临诸多瓶颈,门槛极高,当前面临产能极度短缺的现状。和传统创新药研发产业链类似,基因治疗领域也衍生出一类提供生产研发外包服务的CDMO企业,帮助药企降本增效,提升研发效率
4.1 CDMO行业市场规模
2016年至2020年,美国的细胞和基因治疗CMO/CDMO市场规模从5亿美元增至11亿美元,复合年增长率为23.8%。随着CGT相关研究和临床试验的扩大 到2025年,全球细胞和基因治疗CMO/CDMO市场将达到101亿美元,2020年至2025年的复合年增长率为34.9%。中国的细胞和基因治疗CMO/CDMO市场将是增长最快的市场,2020年至2025年的复合年增长率为51.1%。与美国市场类似,欧洲细胞和基因治疗CMO/CDMO市场从2016年的3亿美元增长到2020年的7亿美元,增长迅速,复合年增长率为20.6%。未来五年,市场规模将达到26亿美元,2020年至2025年复合年增长率为30.6%。
图表37 基因治疗CDMO市场规模及增速
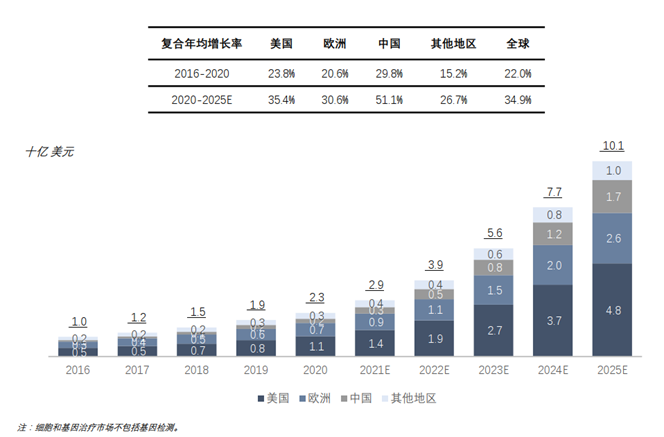
资料来源:沙利文,智银医药资料库
4.2 CDMO行业发展前景
病毒载体的生产门槛高,大量初创平台缺乏上游生产线的配置实力。
根据沙利文,CGT 在临床前和临床阶段的研发费用是传统药物的 1.2-1.5 倍,因为CGT病毒载体生产成本高,各类活性及安全性测试繁琐。基因治疗产业链上游的病毒载体的生产制备步骤繁琐、工艺难度大、制备周期长,且需要多种设备及相关试剂耗材的支持。然而,这些上游设备及试剂目前仍主要依靠进口,国产化率不到 10%。同时,CGT基础研究和技术孵化往往源自高校、科研院所、医疗机构、初创型技术公司,尽管其在基因功能研究、基因编辑技术和疾病模型等方面具有扎实的学术背景,但对产业化和商业化知之甚少。更重要的是,对于大量初创型的研发平台来说 并不具备大额投入固定资产建设全套生产装置的能力。而对于大型药企,更应当将资源侧重于药物研发和临床试验本身,而无需重复建设符合 cGMP 的生产设备及配套的纯化、质检设备。
图表38 基因治疗药物与传统药物的研发费用对比
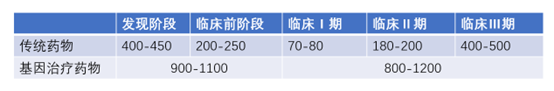
资料来源:智银医药资料库
CGT CDMO降本增效,其生产外包渗透率远高于传统药物。
据J.P.Morgan统计,基因治疗的外包渗透率超过65%,远超传统生物制剂的35%。2021年,CRB对150家基因治疗企业的调研显示,仅23%的企业选择完全自主搭建产线,绝大多数企业选择完全(20%)或部分(57%)外包给CDMO生产。究其原因,药企选择CDMO外包的主要原因是缺乏GMP级的生产产能(占54%),另外18%和12%的企业从研发成本和研发周期角度考虑。另外,根据CRB调查,高达81%的公司表示未来5年可能发生研发技术的更换,而FDA要求产品申报IND时必须明确生产工艺,一旦有重大变更需重新申报,因此CDMO为药企提供多样化工艺的灵活选择,避免药企由于技术变更导致的生产工艺变更的转换成本。
图表39 CGT 企业生产模式
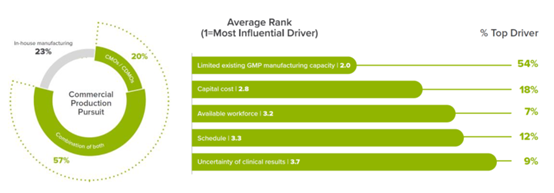
资料来源: CRB: Cell and Gene Therapy Industry Report - Final (19Oct2020),智银医药资料库
五、国内外头部基因治疗公司
5.1 bluebird
bluebird成立于2010年,拥有世界上最庞大的离体基因治疗数据集,为行业树立了标准。Bluebird专注于严重的遗传疾病,拥有行业领先的镰状细胞病、β-地中海贫血和脑肾上腺脑白质营养不良临床项目,并正在推进研究,将新技术应用于这些疾病和其他疾病。公司定制设计每种疗法以解决疾病的根本原因,并开发深入有效的分析方法来了解公司的慢病毒载体技术的安全性并推动基因治疗领域向前发展。
创始人(Andrew)
Andrew是一位热衷于改善患者及其家人生活的生物技术商业领袖,他的职业生涯致力于推进罕见疾病的治疗。于2016年加入bluebird,担任欧洲负责人。然后于2021年被任命为首席执行官。如今,安德鲁是bluebird慢病毒载体基因治疗平台的拥护者,因为该公司正准备推出三个一流的疗法。在加入bluebird bio之前,Andrew 在Shire担任法国和比荷卢经济联盟的总经理,负责包括七种罕见疾病产品的投资组合。Andrew在Genzyme和Sanofi工作八年,在美国和欧洲的业务发展、营销和全球商业运营中担任过职务。
他的职业生涯始于在小型生物技术公司担任顾问,然后成为风险投资人。他于2004年在西北大学凯洛格管理学院获得MBA学位,在达特茅斯学院获得遗传学、细胞和发育生物学学士学位。
科学技术
bluebird bio专注于基因添加。在基因添加疗法中,使用称为“载体”的递送系统将基因的功能拷贝递送至患者的干细胞。bluebird bio使用慢病毒载体 (LVV),因为其具有独特的特性,非常适合治疗一系列严重的遗传疾病。由于每种疾病都有不同的根本原因,通过设计使用的特定LVV和制造工艺来定制每种基因疗法,目的是解决旨在治疗的各种复杂疾病的各自原因。
LVV基因疗法被设计为只进行一次,并使用不同的LVV和定制的制造工艺,使患者的身体能够在身体需要的地方产生正确的蛋白质。LVV基因治疗已被深入研究。
在蓝鸟生物临床试验中,大约170名患者接受研究性LVV基因疗法治疗,随访时间长达7年——这意味着超过500患者年的经验。LVV基因添加的性质意味着这些疗法是可追溯的,提供了在交付给患者后主动识别和跟踪LVV修饰细胞的能力。有一个知识库和工具集,可以让专家评估基因治疗在不良反应中可能发挥的潜在作用。复杂而精确的整合位点分析准确地绘制出的LVV整合到基因组中的位置,能够评估对DNA的影响并监测患者。通过在临床试验中使用的研究性基因疗法对LVV修饰细胞进行15年的跟踪和跟踪,正在推动科学,以了解LVV基因疗法的安全性和有效性。
迄今为止,通过对LVV的深入研究,公司获得独特的见解,并将这些知识应用于改进公司的临床开发计划。
产品管线
公司第一款治疗β-地中海贫血产品Zynteglo欧洲有条件批准、商业化延迟、美国BLA申请延迟,COVID-19对公司管线发展及商业化的影响,同时公司的运营花费很高,导致近2年公司市值严重缩水;BLUE拥有内部慢病毒及基因编辑技术以及内部自有工厂生产能力,管线涉及罕见病(干细胞治疗)、肿瘤(CAR-T)等,公司现金仍然较充分,多发性骨髓瘤的CAR-T已完成美国FDA的BLA。到2022年,公司将有4个上市产品,超过5个以上的临床管线。
图表40 bluebird产品管线

资料来源:Bluebird官网,智银全球医药项目库
5.2 BioMarin Pharmaceutical。
BioMarin Pharmaceutical成立于1997年,总部在美国加州的Novato,是一家专注于罕见遗传疾病治疗的公司。在其成立的年代,医学界对罕见病的研究以及罕见病的治疗都是十分稀少的。罕见病较小的市场规模、和巨大的研发难度,都让医药公司对这一领域望而却步。BioMarin则是逆势而上,他们以治疗粘多糖贮积症 I(或 MPS I)的药物Aldurazyme 为起点,创立的BioMarin并在同年推动该药的临床试验,最终在2003 年Aldurazyme获得批准,成为首个获批的用于治疗粘多糖贮积症I的酶替代疗法。如今,BioMarin已经拥有PALYNZIQ、Brineura、Vimizim、Kuvan、Naglazyme、Aldurazyme等多个治疗罕见病如PKU、CLN2、MPS的药物,以及多个以AAV为载体的基因治疗药的研发管线。
创始人(Bienaimé)
宾夕法尼亚大学沃顿商学院的MBA学位和巴黎高等商业学院的经济学学位。1992年到1998年,Bienaimé先生在Rhone-Poulenc Rorer Pharmaceuticals(现为赛诺菲安万特)担任多个高级管理职位,在全球范围内参与开发Lovenox®(用于预防肺栓塞和治疗不稳定型心绞痛)和泰索帝®(用于乳腺癌和肺癌)。在他职业生涯的早期,他曾在基因泰克公司工作,在那里他参与用于治疗心脏病发作的组织纤溶酶原激活剂(t-PA)的推出。2002年底,Bienaimé先生担任Sangstat Medical Corporation的董事长、首席执行官兼总裁,这是一家专注于免疫学的生物技术公司,在被Genzyme Corporatio 收购之前,他指导该公司实现盈利。2002年11月到2005年4月,Bienaimé先生担任Genencor的董事长、首席执行官和总裁,该公司是一家专注于工业生物产品和靶向癌症生物治疗的生物技术公司。在他的领导下,Genencor 的收入大幅增加至超过4亿美元,股东价值大幅增加,最终在2005年春季将公司出售给丹尼斯克公司,企业价值超过12亿美元。现任BioMarin的董事长兼首席执行官
科学技术
BioMarin处于分子医学的前沿。通过研究人类基因组,设计比蛋白质或RNA更深入的突破性技术,以解决遗传疾病的根本原因:DNA。BioMarin正在研究使用腺相关病毒(AAV)基因疗法将短链DNA传递给细胞,身体可以将其用作模板,使用其自身的天然机制来创建所需的蛋白质。该治疗平台利用数十年的研究和科学进步,具有治疗多种疾病的潜力。
为进一步致力于开发有前景的基因治疗候选药物,其与DiNAQOR AG的临床前合作扩大公司的基因治疗管线,包括用于MYBPC3肥厚型心肌病( HCM )的DiNA-001,这是最常见的遗传性心脏病之一。高达60%的HCM病例起源于遗传,估计其中40%的病例是由于编码心肌肌球蛋白结合蛋白C的基因MYBPC3的突变所致。
BioMarin 的平台专业知识并不仅限于基因治疗。公司与Deep Genomics的临床前合作将利用人工智能(Deep Genomics的AI Workbench)来识别寡核苷酸候选药物,用于治疗具有高度未满足需求的罕见疾病,进一步扩大公司的能力组合,以实现不仅针对DNA和蛋白质,同时针对RNA的治疗工作。
BioMarin作为极少数拥有自己制造设施的治疗开发公司之一,为研究性基因疗法的生产设定黄金标准。这种密集的参与程度可以持续改进工艺,帮助我们建立纯度和效力的高规格。BioMarin的研究性基因疗法的安全性和有效性目前正在针对多种情况进行评估。随着在多个领域不断扩展平台专业知识,BioMarin致力于为每种独特条件寻找最佳方法。
产品管线
通过利用公司独特的AAV载体技术,公司目前开发针对多项罕见病适应症的产品,包括血友病A,遗传性血管性水肿,苯丙酮尿症,高草酸尿症,Alpha-1抗胰蛋白酶缺乏症等,其中针对血友病A的产品的近期已获EMA批准上市。
图表41 BioMarin产品管线
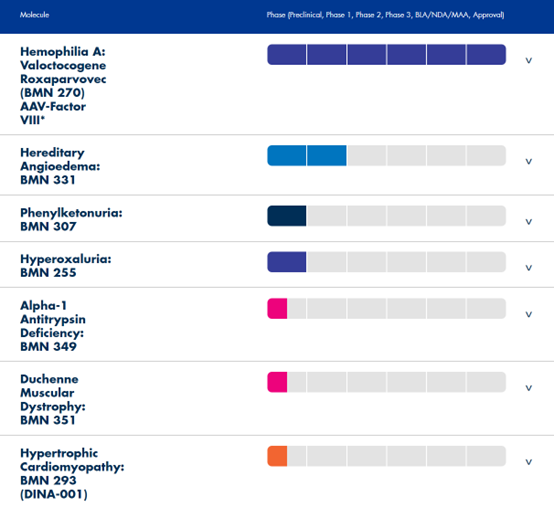
资料来源:BioMarin官网,智银全球医药项目库
5.3 纽福斯生物
纽福斯成立2016年,是李斌教授团队于华中科技大学同济医学院附属同济医院自2008年起十几年来对眼科基因治疗技术探索和积累的成果。作为一名眼科医生和视网膜疾病专家,李教授带领团队成功完成从实验室到临床应用的转化研究,通过一系列国内和国际多中心临床试验证实腺相关病毒(AAV)载体技术在眼科基因治疗的应用价值。借助于成熟的AAV基因治疗技术平台,纽福斯已建立丰富的产品管线,包含针对视神经损伤疾病、血管性视网膜病变等多种眼科疾病的10余个在研项目。公司专注于眼科疾病方面的基因治疗。
创始人(李斌)
纽福斯创始人,董事长,首席执行官
李斌教授从事眼科临床工作和基础研究20余年,于华中科技大学同济医学院取得眼科学博士学位并于中山大学中山眼科中心取得博士后学位,历任中山大学眼科中心临床医师、华中科技大学同济医院眼科教授和主任医师,研究方向为眼遗传病、神经眼科及眼底病。近年发表相关论文50余篇,其中在SCI收录的杂志上发表30余篇,主持国家自然科学基金5项。
李教授于2008年在华中科技大学附属同济医院开始进行基因治疗的研究,2011年完成全球首个基因治疗Leber’s遗传性视神经病变治疗探索性临床试验,并于2016年创办中国首家眼科基因治疗公司纽福斯。团队于2017-2018年间继续针对该基因治疗药物(NR-082,NFS-01)进行更为全面的探索性临床研究。至今已积累全球基因治疗领域最长随访记录和最大样本量数据,充分证明基因治疗技术临床应用的长期安全性与有效性。该研究成果在国内外引起轰动并被国内外几十家媒体和网站报道或转载。
联合创始人(肖溯)
联合创始人,首席技术运营官
肖溯博士在转化科学、基因治疗产品开发和生物制品生产方面拥有近十年的工作经验。她致力于推动基因治疗的普及和应用,专注于基因治疗工艺技术突破和技术运营管理。在加入纽福斯前曾任美国维真生物GMP生产副总监,美国辉瑞制药基因治疗工艺开发及放大的资深科学家及美国国立卫生研究院生物技术中试平台研究员,领导或参与多个罕见病基因治疗项目的工艺开发,临床药物生产及申报。
肖溯博士现任纽福斯联合创始人及首席技术运营官。肖博士曾任纽福斯首席执行官,于2019年主导公司成功完成A轮融资1.3亿元,并深度参与战略和运营层面全方位的管理决策,确保纽福斯的成功与快速发展。肖博士拥有约翰霍普金斯大学化学与分子生物工程博士学位及清华大学化学与工业生物工程本科学位, 并于圣路易斯华盛顿大学奥林商学院攻读工商管理硕士学位。
科学技术
公司目前共开发有三大技术平台,分别为基因治疗,研发平台和CMC平台。
基因治疗
眼睛是密闭的球体,药物仅注射局部眼球对全身影响小,适合基因治疗。此外,与眼科相关的基因多达220余种,任何一个基因突变都可能引起视力丧失和致盲。
全球第一款治疗眼科基因缺陷的药物是由美国的Spark Therapeutics公司研发,并用于治疗Leber先天性黑朦(LCA2,RPE65基因突变)的药品LUXTURNA®,于2017年12月获美国FDA批准上市。这被视为人类基因疗法的重要里程碑。利用安全的病毒载体递送核酸药物来矫正基因异常或表达正常基因产物的基因疗法是治疗致盲性眼科疾病最有前景的策略之一。
纽福斯作为中国首家眼科基因治疗公司,致力于以腺相关病毒为载体的基因治疗药物研发及产业化,为全球眼科疾病患者探索和开发新的疗法。
研发平台
研发平台主要包括三大模块,分别注重于基因,载体和递送。针对不同模块研发具有针对性的产品。
图表42 纽福斯研发平台示意图
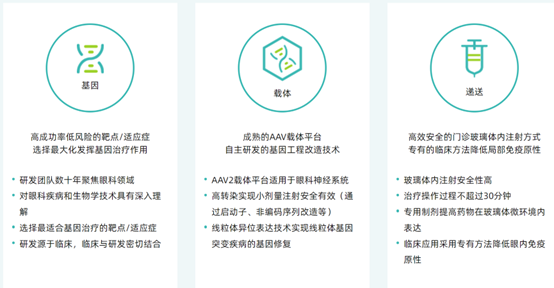
资料来源:纽福斯官网,智银全球医药项目库
CMC平台
而对于基因治疗工艺,公司建立专有的高产细胞系,并开发高产稳定易放大工艺。同时做到生产成本和产品质量的控制,稳定灵活的工艺开发与中式平台。以便快速推进至GMP阶段。同时公司今年也同步在苏州开启8000m2商业化生产基地
图表43 纽福斯CMC平台概况

资料来源:纽福斯官网,智银全球医药项目库
产品管线
通过一系列国内和国际多中心临床试验证实腺相关病毒载体技术在眼科基因治疗应用价值。借助于成熟的AAV基因治疗技术平台,纽福斯已建立丰富的产品管线,包含针对视神经损伤疾病、血管性视网膜病变等多种眼科疾病的10余个在研项目。公司首个候选药物NFS-01旨在治疗莱伯氏遗传性视神经病变(LHON)。该疾病是一种可导致严重视力损伤的退行性疾病,迄今为止尚无有效的治疗方法。2011年,团队应用该候选药物开始全球首个LHON基因治疗探索性临床研究,参与临床试验的9例患者已持续随访8年,至今无严重不良反应且其中5例患者视力显著提高。此结果为全球基因治疗最长随访记录,发表于《自然》子刊、《柳叶刀》子刊及眼科领域顶级杂志《眼科学》,充分证明基因治疗技术临床应用的长期安全性与有效性。在首项研究取得可喜成果后,李教授团队于2017-2018年间进行一项更为全面的临床研究,研究入组受试者达159例(其中包括来自阿根廷的10例),这也是目前全球整个基因治疗领域样本量最大的临床试验。同样,十二个月随访结果显示NFS-01疗效显著,且未发现严重不良反应。NR082于2020年9月获得美国FDA孤儿药资格认定,于2021年3月成为国内首个获得1/2/3期无缝临床试验许可的眼科体内基因治疗药物,已在今年6月完成首例患者入组给药。
图表44 纽福斯产品管线
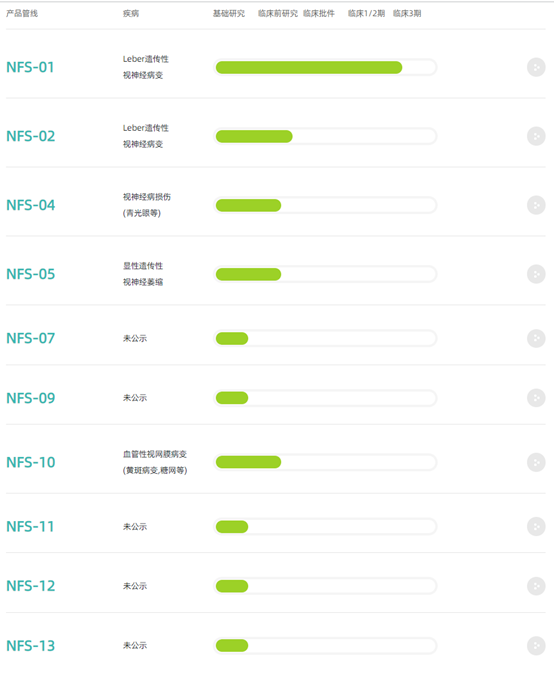
资料来源:纽福斯官网,智银全球医药项目库
投融资
纽福斯生物非常受资本青睐,2021年11月获得近4亿元人民币C轮融资。本轮融资由国投招商及红杉中国共同领投,阳光人寿、招银国际资本等共同参与投资。同年2月,纽福斯B轮融资4亿人民币,该轮融资由国方资本及华新投资共同领投,园丰资本、元禾控股、惠远资本等投资机构参与,红杉中国和北极光创投则持续加注。且此前纽福斯于2020年4月完成1.3亿元人民币A轮融资,由红杉中国、复星星未来资本领投,北极光创投跟投。两年之内即完成9.3亿元融资。
5.4 尧唐生物
尧唐(上海)生物科技有限公司成立于2021年,是一家专注于结合mRNA体内递送技术和基因编辑技术,开发新一代mRNA药物和基因编辑药物的高科技生物技术公司。尧唐生物通过对CRISPR、碱基编辑和其他新一代基因编辑工具的持续开发和优化,对新一代mRNA生产平台和脂质纳米载体组装工艺的创新型改进,致力于开发针对遗传性疾病和心血管疾病的体内基因编辑药物。公司创始团队源于学术界和产业界的有机融合,来自美国知名mRNA和基因编辑医药公司的核心骨干负责生产工艺优化和放大,共同组建中国领先的基因编辑和mRNA药物研发和生产平台。
创始人(吴宇轩)
尧唐生物创始人、CEO。华东师范大学生命科学学院研究员,是基因编辑领域知名科学家,回国后,吴宇轩于2020年领导全球首次通过体外CRISPR-Cas编辑技术治疗β0/β0型重度地中海贫血的临床成功案例。吴宇轩于2012年在武汉大学获博士学位,同年进入中国科学院上海生命科学研究院生物化学及细胞生物学研究所工作,研究如何应用CRISPR/Cas9技术在动物个体水平进行遗传疾病的修复和治疗,以及结合小鼠单倍体孤雄干细胞和CRISPR library快速高效地制备基因修饰小鼠。2014年晋升为上海生化细胞所副研究员。2015年加入哈佛大学医学院从事基于CRISPR/Cas9技术和造血干细胞的基因治疗,并推动用于治疗地中海贫血及镰刀状贫血的临床研究;另外,应用基于CRISPR/Cas9的全基因组文库筛选和研究影响红细胞分化的基因以及非编码区。2018年加入华东师范大学生命科学学院,入选“紫江优秀青年学者”,从事胚胎干细胞,造血干细胞等干细胞及血液相关疾病的基础和转化研究,课题组围绕造血干细胞的基因治疗及干细胞增殖和分化的信号网络及表观遗传调控开展研究。已发表相关研究论文10余篇,其中包括国际著名学术期刊《Cell Stem Cell》,《Cell Research》《Nature Genetics》等。
产品管线
尧唐生物以碱基编辑(Base editing)为主要工具的体内基因编辑(In vivo genome editing;全球一流的基因编辑科学家及全球一流、具备完整mRNA-LNP经验的工业界科学家;曾领导国内CRISPR领先公司核心项目完整开发——基因编辑治疗重度地贫,世界领先的临床突破;覆盖删除、替换、插入等多种功能的编辑工具集合,开发自主专利的新型碱基编辑工具;头部管线实现动物体内通过LNP靶向肝脏的高效基因编辑, 全球领先水平的体内编辑效率;预计为中国首家体内基因编辑进入临床的公司-2023年第一个管线可进入IND;
尧唐生物运用其独特的基因编辑技术开发多款针对罕见病领域的产品,开发较快的主要为肝脏领域针对家族性高胆固醇血症的YT001产品和针对转甲状腺素蛋白淀粉样变YT002。
图表45 尧唐生物产品管线

资料来源:尧唐生物,智银全球医药项目库
投融资
2022年2月25日,“尧唐生物”已完成数千万级别的天使轮融资,由险峰旗云独家投资。尧唐生物成立于2020年下半年,它主要通过持续开发和优化CRISPR-Cas、碱基编辑和其他新一代基因编辑工具,以及对新一代mRNA生产平台和脂质纳米载体(LNP)组装工艺的创新型改进,开发针对遗传性疾病和心血管疾病的体内基因编辑药物。
六、行业发展挑战与趋势
技术挑战
基因治疗的两大技术路径,基因增补和基因编辑虽然在治疗罕见病等遗传病领域展现出巨大潜力,但依旧存在各自的技术挑战。例如,由于目的基因的制备相对容易,因此基因增补的技术挑战集中于递送载体本身,包括如何提升转导效率,提高靶向组织特异性,AAV载体容量小,以及可能面临的免疫障碍(适应性免疫反应和先天免疫反应)等。而基因编辑面临的最大技术挑战即脱靶效应——CRISPR编辑系统对体内非目标区域的DNA双链进行错误切割——可能引发的安全性问题。
一、 递送载体技术的挑战
由于AAV载体由基因组和衣壳蛋白两部分组成,为克服递送载体的技术挑战,往往从这两部分着手。为提高转导效率,采用“基因表达盒工程”。为提高靶向组织特异性,采用“衣壳工程”,因为AAV衣壳蛋白决定其靶向组织特异性——AAV进入细胞的过程依赖于细胞表面糖基化受体识别AAV衣壳蛋白。针对AAV载体容量较小的问题,有两类改进方案,一是将大体积的目的基因分包到两个(或多个)载体,再利用ITR序列的同源重组合并AAV基因组,二是只截取保留目的基因的功能性片段。为克服机体的免疫障碍,也可以从“基因表达盒工程”和“衣壳工程”着手。
图表46 衣壳工程流程示意图
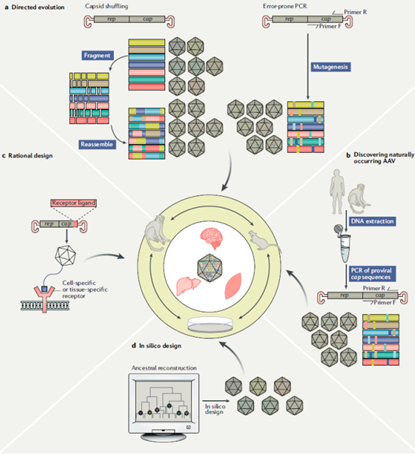
资料来源: Adeno-associated virus vector as a platform for gene therapy delivery,智银全球医药项目库
二、 基因编辑的技术挑战
基因编辑的大势所趋是从体外到体内基因编辑,降低治疗费用;从单基因到多基因编辑,为更广泛的适应症提供治疗方案。以下,重点阐述为克服基因编辑系统的“脱靶效应”的相关发展趋势。由于CRISPR/Cas9系统由Cas蛋白和sgRNA两部分组成,当前大部分改进策略基于Cas蛋白,其中以Cas9的系列突变体居多,而基于Cas13的 RNA 单碱基编辑近年也成为研发的热点。
载体生产挑战
病毒载体生产的上游主要包括转染和细胞扩增培养,其中,转染方式包括瞬时转染和稳定转染,细胞扩增培养方式包括贴壁培养和悬浮培养。目前,转染工艺以多质粒共转染的瞬时转染为主,目前约 70%产品使用贴壁细胞,包括FDA批准的两款基因疗法;而细胞扩增以贴壁培养工艺更为成熟应用。由于病毒载体的产能极度短缺,从提高产量并降低生产成本的商业化角度出发,未来“稳定转染+悬浮培养”将占据主流趋势,且二者本身互相验证,稳定转染通常更适应悬浮的细胞系。病毒载体生产的下游包含环节众多,其中最核心的环节是层析纯化,当前面临DSP回收率低的问题,未来应当从降低空壳率角度改进生产工艺,例如应用分析型超速离心技术AUC)等。
商业化的挑战
EMA于2012年和2016年批准的两款基因治疗产品Glybera和Strimvelis,均因商业化销售堪忧,分别于2017年被迫退市和2018年被GSK出售。定价100万美元的 Glybera,这一药物的适应症十分罕见(用于治疗脂蛋白脂肪酶缺乏症,这种疾病在欧洲仅有约1200名患者),获批5年只有一名患者使用,商业化失败,最终在2017年以退市告终。
基因治疗产品商业化失败的案例,源于罕见病患者基数较少,以及商业化定价极其高昂两方面原因。因此,为解决商业化困境,一方面,基因治疗的适应症将逐渐从罕见病拓展至肿瘤以及慢性病(乙肝/三高等)等常见病,另一方面,在病毒载体的生产工艺不断优化,基因治疗产品的研发成本降低的背景下,加之保险支付体系的完善,未来能够负担基因治疗费用的患者将大幅提升,市场推广前景更为广阔。
在研发以及生产方面,与传统药物相比,基因治疗需要的研发投入更高。主要瓶颈之一即是病毒载体工艺及大规模GMP生产的工艺复杂、产能短缺和周期较长,这也限制整个基因治疗行业的发展,同时也是生产方面上基因疗法标出“天价”的原因之一。未来的基因治疗商业化生产关键是工艺技术的连贯性,可放大性,能够有效平台化和全功能化,但目前相应的制药工艺设备上下游还无法完美达到其中要求。
高昂的售价,较少的适应症人群,复杂的技术机制、高门槛的工艺开发、大规模生产、严苛的法规监管要求、有限的产业化经验这都促使基因治疗商业化是一条艰难险阻之路。






