由于腺相关病毒 (AAV) 的现有成功案例和巨大的潜力,对临床试验和获批治疗应用中AAV的需求正在增加。与给药策略相关的高剂量要求正在挑战生物工艺工程师,以开发更有效的技术和创新策略,提高单位体积生产率。在这项研究中,我们比较交替式切向流 (ATF) 和切向流深层过滤 (TFDF) 技术在以下方面的潜力:1) 使用哺乳动物 HEK293 细胞和瞬时转染实施高细胞密度灌流工艺,以生产 AAV8,以及 2 ) 将 AAV 收获和澄清单元集成到一个步骤中。在第一项研究上,获得的结果表明 AAV 表达通过培养基置换策略得到改善。这首先在小规模灌流模拟研究中得到证实,随后在以灌流模式运行的 2 L 生物反应器中得到验证。调节 ATF 和 TFDF 中的剪切速率证明有助于维持高细胞活性,最重要的是,提高 AAV 特异性滴度(7.6 × 10^4 VG/cell),是未优化的灌流培养的 4 倍,批次操作模式的 2 倍。关于第二个目标,TFDF 在基于灌流的细胞外病毒连续收获和裂解液澄清过程中,实现了最高的回收率。这项研究表明,ATF 和 TFDF 技术有可能支持 AAV 的生产和连续收获,并实现集成的澄清步骤,有助于简化操作,提高生产效率。
简介
Luxturna (Spark Therapeutics) 和 Zolgensma (Novartis) 等基因疗法的获批将腺相关病毒 (AAV) 推向了更多的临床试验。然而,此类应用所需的 AAV 数量从 1 × 10^13(例如,莱伯氏先天性黑蒙)到 5 × 10^20 (例如,杜氏肌营养不良症)病毒基因组不等,这给生产工艺带来了巨大压力。尽管有多种技术可用,但 AAV 的上游工艺仍然是临床级 AAV 生产的主要瓶颈之一,具体的生产滴度和载体质量(即完整颗粒百分比)是其中的两个最具挑战性的瓶颈,需要大量的参数控制和/或优化。通过对单克隆抗体的成功案例研究,已经证明工艺强化策略的实施可以克服这些挑战。这些方法可实现高细胞密度 (HCD) 培养、提高生产率并缩短获得更高目标数量所需的工艺时间。
补料分批培养已被广泛证明可以改善细胞生长和活性,同时提高蛋白质和病毒样颗粒生产的产量。此外,灌流已成功被实施用于提高细胞密度和生产力。这是通过使用能够截留细胞并同时进行培养基置换的设备来实现的,其可在去除生长抑制化合物的同时,防止营养耗尽。在可用的不同细胞截留装置中,ATF(交替式切向流)已广泛用于生物工艺强化。ATF 系统使用隔膜泵来创建由交替加压和排气组成的循环。与传统的切向流过滤相反,ATF 中的流体流动方向在排气循环期间反转。这促进了膜的潜在反冲,减少了污染,同时在较长时间内保持了稳定的通量。
最近,开发了一种新的过滤技术 - 切向流深层过滤(TFDF)。它由一个细长的管状深层过滤器组成,平均孔径为 2–5 µm,以切向流模式运行,可实现两种过滤策略(即切向过滤和深层过滤)的优势。因此,考虑到中空纤维和相关设备的特性,已经对其在原液澄清中的适用性进行了一些研究。TFDF 过滤器的切向性质和孔径大小增强了它们在灌流细胞培养中作为细胞截留装置的用途,理论上能够连续收获 AAV。除此之外,相同的过滤装置可用于澄清细胞裂解液,从而将 AAV 生产和澄清整合到一个单一的操作中。可以设想使用这些技术,即 ATF 和 TFDF,实现连续抽取滤液而驱动连续 AAV 收获程序。这种策略应该平衡 AAV 表达的瞬态阶段的持续时间、膜筛分效应以及由于施加灌流而导致的出口物质流的稀释。重要的是,它们还有助于减少设备和步骤操作的占地,从而对工艺经济性产生积极影响。
在这项工作中,我们评估了两种不同的细胞截留装置(XCell ATF® 和 Krosflo TFDF®)实施连续、集成的 AAV 生产工艺的潜力。我们首先进行批次 2 L 生物反应器,以使用标准策略对 AAV 生产和澄清进行基准测试。鉴于特异性细胞滴度的结果,在批次和灌流模拟场景中进行了摇瓶实验,以研究培养基置换对细胞培养动力学的影响、实现高细胞密度的潜力以及这些变化对基于细胞培养的病毒生产的影响。AAV 生产随后在受控搅拌罐生物反应器中放大到 2 L 灌流培养,以评估 ATF 和 TFDF 在促进高细胞密度和活性、以优化 AAV8 生产方面的性能。最后,评估了将 AAV8 生产与下游工艺的初始步骤(收获和澄清)相结合的适用性。
详细的试验操作步骤和结果,请参考原文。
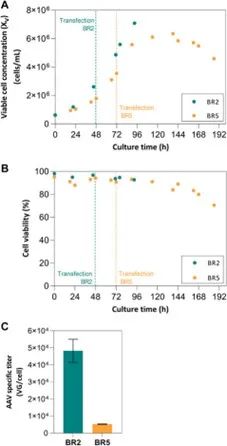
图 1. 批次搅拌罐生物反应器 (2 L) 分析。(A) 使用 2 × 10^6 cells/mL (BR2) 的 VCC^TOT 和 5 × 10^6 cells/mL (BR5) 的 VCC^TOT 进行批次运行的细胞生长曲线;(B) 生物反应器批次运行 BR2 和 BR5 的活性趋势;(C) 每次运行的特异性滴度。
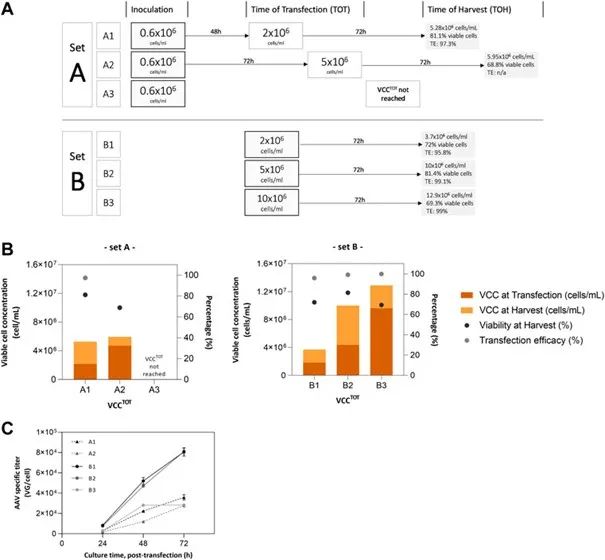
图 2. AAV 生产的小规模实验。(A) 批次培养条件(A 组)和模拟灌流条件(B 组);(B) 细胞培养参数(转染和收获时的 VCC、细胞活性和转染效率);(C) A 组和 B 组的累积病毒产量(内部 + 外部);没有可用的 VCC^ToT 数据 - 10 × 10^6 cells/mL 的 A 组,细胞没有达到定义的转染浓度值。对于 A 组,细胞以 0.6 × 10^6 cells/mL 接种,并维持至转染时达到指定的活细胞浓度。对于 B 组,在培养基置换和离心浓缩后,在各自的 VCC^TOT 时接种培养物。A 组在 VCC^TOT 进行转染,B 组在接种后 1 小时进行转染。AAV 在转染后 72 小时收获。
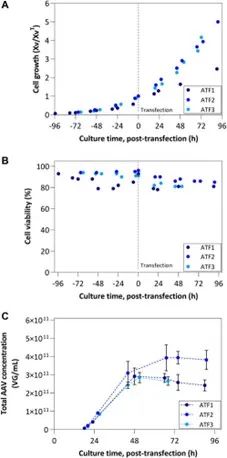
图 3. ATF 工艺结果:(A) 细胞生长趋势和 (B) 活性趋势;ATF1 以 10 × 10^6 cells/mL 转染,而其余运行以 5 × 10^6 cells/mL 转染;细胞生长由转染时基于VCC 的标准化活细胞浓度化来表示。(C) 考虑细胞内、细胞外和滤液组分中的总 AAV 的浓度。
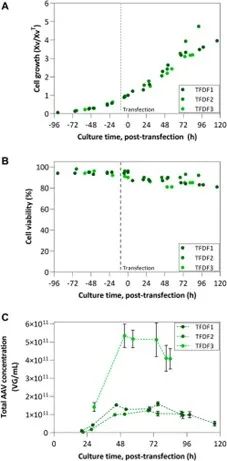
图 4. TFDF 工艺结果:(A) 细胞生长趋势和 (B) 细胞活性趋势。细胞生长由转染时基于VCC 的标准化活细胞浓度化来表示;(C) 考虑细胞内、细胞外和滤液组分中产生的总 AAV 的浓度。
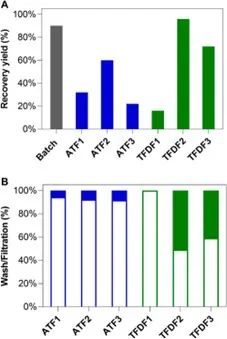
图 5. TFDF 和 ATF 澄清工艺结果:(A) 批次培养(灰色条)、ATF(蓝色条)和 TFDF(绿色条)运行的澄清产量;(B) 在洗涤和过滤阶段回收的 AAV 的百分比。空条和实条分别代表 AAV 在洗涤和过滤阶段的回收百分比。
讨论
这项工作的主要目标是评估用于实施灌流细胞培养的 ATF 和 TFDF 设备,并促进 AAV 生产的集成式收获和澄清策略。
在以批次模式运行的 2 L 搅拌罐生物反应器中进行的初始实验证明了增加培养时间、培养基饱和度和更高细胞密度对 AAV 生产的影响。这些结果与使用批次操作的其它 HEK 293 培养相当。营养物质的潜在限制和/或有毒副产物的积累对比生产率有负面影响,这在 VCC^TOT 较高时更为明显,与 BR2 相比 (VCC^TOT = 2.61 × 10^6 cells/mL),BR5 中的特异性生产率低 5 倍(VCC^TOT = 5.57 × 10^6 cells/mL)。小规模实验研究中获得的结果证明了培养基置换对实施灌流策略的优势。对于在 A 组(批次模式)和 B 组(灌流模拟模式)中进行的转染,转染时的培养基置换与更高的 AAV 产量之间的相关性很明显。尽管在批次培养中获得的 AAV 滴度在该生产系统的报告范围内(0.1 – 3.58 × 10^4 VG/cell),但这些滴度比灌流模拟中获得的结果要低得多(达 3 倍)。这组实验显示了实施灌流方法的潜在优势,并证实了有关该主题的其它报告研究。尽管如此,仍然可以通过以下方式进行一些优化:1) 优化培养基置换率,以维持 10 × 10^6 cells/mL 的 VCC^TOT, 并平衡与转染后细胞浓度翻倍相关的营养消耗,2) 探索不同的质粒比率、单个细胞的总质粒 DNA 和转染试剂的百分比,3)工程细胞系或使用不同的表达系统,和/或 4) 评估不同的生物反应平台,表明在其它载体中,其会影响颗粒的数量和质量。
已经有文献描述了 ATF 和 TFF 灌流方式的特征和比较。有关剪切应力对细胞生长影响的报告表明,TFF 装置更容易诱导细胞死亡,并且考虑到与 ATF 的双向流动相比,TFF 的单向流动更容易堵塞膜柱。这可以通过使用离心泵,而不是蠕动泵,来缓解,类似于 TFDF 系统中使用的泵。在我们的研究中,最初在 ATF1 中使用的错流流速对细胞活性产生了负面影响,但在将错流减少到初始设置的三分之一后,活细胞的百分比恢复到初始值。这种效果在任何其它 ATF 运行以及 TFDF 运行中都不可见,尽管有些具有相似的剪切率(即 TFDF1 和 TFDF2)。关于 AAV 生产,在使用工程相关性错流微调后,ATF 和 TFDF 设备获得了类似的结果,即将 VCC^TOT 更改为初始值的一半(从 10 到 5 × 10^6 cells/mL) 并结合较低的错流,可将每个细胞的 AAV 滴度提高 3-4 倍。TFDF 的特殊性,具有较大的孔径 (2.0–5.0 µm),可以克服标准中空纤维 TFF 的局限性,因为它能够连续滤出较大的杂质,并收获在较高细胞密度下活性可能受到损害的产物。鉴于获得的结果以及 TFF 中空纤维操作更简单的文献报告,TFDF 设备可能是 AAV 生产的更强大的替代方案。
ATF 和 TFDF 系统也被评估用于集成式澄清中的主要过滤阶段。对于在灌流培养或洗涤步骤中产生和滤出的细胞外病毒的连续收获,ATF 和 TFDF 分别实现了 61% 和 100% 的回收率,表明 TFDF 具有更好的性能。对于裂解液的澄清,进一步证明了 ATF 和 TFDF 特性的差异,尤其是在降低浊度方面。事实上,ATF 实验可以降低最终浊度值(<10 NTU),但这是以在定义的澄清程序的过滤阶段所获得的 AAV 回收率降低为代价的。文献中报道的针对不同孔径的研究,类似于 ATF,证实了这些结果。重要的是,尽管这些膜的孔径为亚微米级别,但过滤性能与收获时的细胞浓度无关。未对所有 TFDF 运行进行验证,由于收获时的高细胞浓度(约 50 × 10^6 cells/mL vs. 23 × 10^6 cells/mL ATF1)和/或高浓度杂质,TFDF1 过滤器在细胞裂解后严重污染。降低转染时的细胞浓度(TFDF2 和 TFDF3)会导致收获时细胞浓度和杂质降低,从而对澄清步骤产生积极影响(即无过滤器堵塞/污染)。
结论
本文报道的工作证明了使用 ATF 和 TFDF 在 STB 中使用哺乳动物 HEK293T 细胞和瞬时转染获得高产 AAV8 的潜力。剪切率是 ATF 或 TFDF 工艺实施中的一个关键因素,对细胞生长和病毒表达动力学产生负面影响,因此需要微调、以最大限度地提高 AAV 产量。将 ATF 中发现的表观剪切率与 TFDF 中的表观剪切率相匹配,TFDF 中的 AAV 特异性滴度可提高近 4 倍,并超过摇瓶中进行的 ATF 和灌流模拟实验。澄清一下,ATF 和 TFDF 都能在生产和洗涤阶段连续收获细胞外病毒,但 TFDF 的性能更好。细胞裂解液的过滤只能通过 TFDF 实现。总之,使用 TFDF 获得的 AAV 滴度和澄清产量证明了该技术在集成式连续生产、收获和 AAV 澄清方面的能力,将促进了高细胞密度和强化工艺的进一步发展。
原文:J. P. Mendes, B. Fernandes, E. Pineda, et al., AAV process intensification by perfusion bioreaction and integrated clarification. Front. Bioeng. Biotechnol., 2022.






