哺乳动物细胞培养技术中的灌流生物工艺的特点是:在生物反应器运行过程中,富含营养物的新鲜培养基连续流入,无细胞的耗竭培养基不断流出。因此,细胞需经过“开放”或“封闭”的细胞截留装置。这种方式可获得连续的产品液流,使灌流特别适合作为集成在自动化、完全连续的生物生产工作流中的极具价值的单元操作。通过增加培养时间、而不是体积扩增,来实现总蛋白质产量的提升,这可使生物反应器设备和实验室占地更小。也就是说,相同的既定工艺可用于生产不同数量的治疗性蛋白,以满足不同临床阶段的需求。由于生物反应器体积小,这样的工艺可以在定制的一次性使用设备中进行。这种高度灵活的操作模式通过连续清除含有有毒副产物的培养基,使细胞处于健康的生理状态。收出的液流体积以一种丰富、但均衡的灌流培养基所补偿,以持续补充所需的营养物。
针对灌流工艺而优化的培养基的特点是可在最小的培养基消耗率下、获得高细胞密度和产量。这样的培养基的质量属性可以通过支持关键培养基特性(如渗透压、pH值和缓冲容量)的均衡营养物混合来实现,其目的是通过最小的细胞特异性灌注率(CSPR,表达为每细胞每天微微升(pL)),以支持高细胞活性和特异性产率。CSPR可以作为比较不同灌流培养基性能的基准值。开发灌流培养基的方法包括混合使用不同培养基添加物的基础培养基,并结合耗竭培养基分析,来确定和克服特定的营养限制。因此,已经优化的补料分批补液溶液可重新调整后用于灌流工艺。
由于操作的复杂性以及长时间的运行,灌流工艺开发通常非常耗时。另一个阻碍快速灌流培养基及工艺开发的问题是,缺乏适合在高通量条件下使用的规模缩小模型。过去,在每天不连续的批次式补液操作中,通过人工模型,成功地进行了灌流培养基优化的尝试。但是,目前已经开发了自动化平行多罐系统,且已商品化。此类小规模平行生物反应器系统最早应用于模拟灌流模式时,采用沉降作为细胞分离策略。目前,AMBR250系统的工作体积可达250毫升,可运行在真实灌流模式下的24个平行微型生物反应器。然而,这类设备通常需要很高的投资成本,因此,对于业界的广泛应用来说,还不太现实。
培养基开发通常需要在多种不同条件下进行多个平行筛选。因此,实验设计至关重要,以减少实验次数和实验员人数,并提取到最大的信息。实验设计(DoE)和响应面方法(RSM)是识别、建模和优化可影响所谓响应的不同“因素”的合适方法。可以选择不同的培养基添加物来代表不同浓度的这些因子(“因子水平”)。检测到的感兴趣的响应可以定义为产品滴度或细胞总浓度的不同值。相对于一次只考虑一个因素的方法(“OFAT”),这种DoE策略的优势在于因素相互作用的检测、减少实验支出、以及提高统计置信度。
不同因素水平对响应的影响的建模是必须的,因为真正的关系是未知的,在现实中,只有所选的因素水平的子集以及检测的响应可以被执行。在全因子试验设计中,将所有因子组合相互比较,以找出主要因子的影响和因子的交互作用(图1a)。部分设计可用于减少实验投资(图1b)。在一个典型的DoE实验中,第一步是确定一个初步的“筛选”实验设计或一个更详细的“响应面”设计。“筛选”实验设计在给定的响应基础上,确定几个主要因素及其相互作用。“响应面”设计通过中心复合设计中的回归分析,来鉴定和建模所选定量因素和检测的响应之间的关系(图1c)。后一个选项代表了一个“优化”实验,以找到最优方案,即,不同因素水平的最优组合,以使在所选设计空间内的响应最大化。
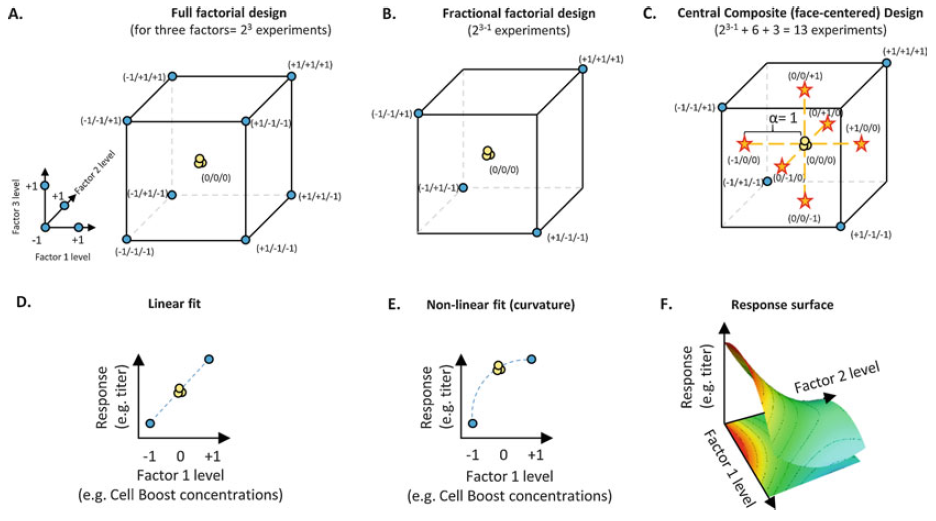
图1. 结合不同的实验设计,建立了中心复合(面心立方)设计,以进行最终响应面模型的计算。两个水平下的三个因子(23个实验)的全因子设计绘制成立方体(a)。 (半)部分因子设计 (23-1 实验)用于降低实验运行数(b)。进行主-、互作-和二次效应建模时,通过面心设计中的中心点(黄色)和α=1星距时的轴向星点补充部分因子设计,应用中心复合设计(c)。中心点(黄色)非常适合检测线性(d)或非线性因子响应关系(e)。后者由两个或两个以上因素的响应面表示(f)。
通常,一个或几个因素的影响不能用简单的线性关系来描述(图1d)。此外,在特定因子水平上的检测的响应通常用一个因子的曲线(图1e)、或两个或多个因子的“响应面”(图1f)来描述。这意味着在这样的实验中,必须探测到响应面的曲率。这是通过使用中心点(比较图1d, e中的黄色中心点)来完成的,并最终用二阶多项式(“二次”)函数正确地建模响应面。这可便于计算(1)线性(主要)效应、(2)因子交互作用以及(3)二次效应,并最终确定所研究的实验空间的最优因子组合。
原文介绍了使用DoE方法,将不同的商用HyClone™Cell Boost™添加物加入到HyClone™CDM4NS0基础培养基中,以在小规模摇管中实现最佳半灌流的方法。这个工作流程非常适合在实验操作员不知道专利成分的情况下,通过经验,优化培养基组成。
方法
本案例中,选择HyClone™ Cell Boost™添加物作为研究的DoE因子,研究其对稳态平均滴度和平均总细胞浓度响应的影响。四种高性能HyClone™ CellBoost™添加物(CB1 3、7a和7b)已经在第一个DoE筛选设计中,通过将全因子设计(图1a)降低到两个水平的部分因子设计(图1b),而进行了预选。在这里,作者介绍了预实验计划,以确定因子水平和设计空间,实际的细胞培养处理,以及使用中心复合面心设计进行的实验后回归分析,以模拟响应并找到四种HyClone™Cell Boost™添加物的最佳组合(图1c)。
实验设计DoE
实验将滴度响应最大化的最佳“因子水平”组合确定为主要实验设计目标。可以假设因子-响应关系中存在曲率,因此,选择合适的实验设计来建立响应面。进而,在中心复合设计中,采用中心点和轴向“星点”相结合的部分因子设计,以检测和估计响应面中该曲率。最后针对四种不同因子(即Cell Boost™)的实验设计由总共23次运行组成,包括3个复制中心点,8个星点,以及12次部分因子设计运行 (表1)。
表1. 用于中心复合(面心)设计的所用DoE矩阵的概况
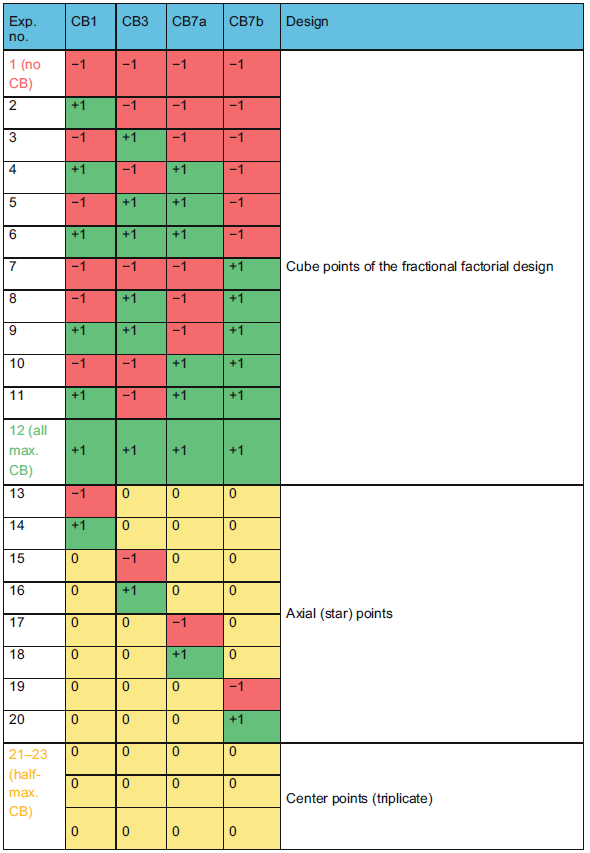
DoE水平 -1、0和+1的定义
应仔细选择每个因子的DoE水平,以免最终输出产生负面影响(即响应)。在这个实验中,总氨基酸浓度和渗透压被选择作为定义三种不同DoE水平 -1、0、和 +1的标准。按照厂商的建议,所有Cell Boost™均以粉末配方配制成原液。因此,Cell Boost™1、3、7a和7b分别配制为10%、5%、18.1%和9.5%的原液。下一步,分别测定了各原液中总氨基酸的摩尔浓度。然后将4种Cell Boost™混合,并标准化至其总摩尔氨基酸浓度,这意味着每种Cell Boost™对氨基酸的摩尔贡献是相同的。然后在CDM4NS0基础培养基中加入该Cell Boost™混合物,使渗透压最大达到400mOsm/kg。该临界渗透压阈值是为这一特定细胞系所选择的,其它细胞系应根据经验确定。对于每种单独的Cell Boost™,最高达到400 mOsm/kg的峰值浓度被定义为+1水平。水平 -1被定义为没有Cell Boost™ 添加,水平0定义为一半添加。重要的是,这一标准化策略适用于市场上任何其它专利基础培养基/补液培养基系统,前提是添加物的总氨基酸浓度已知或可通过直接的标准HPLC进行分析。相应的,对于所有处于+1水平的Cell Boost™溶液,在10ml的基础培养基中加入1.106 mL Cell Boost™1、1.99 mL Cell Boost™3、0.381 mL Cell Boost™7a和0.076 mL Cell Boost™7b。详细操作步骤,请参考原文。
细胞培养实验(“半灌流”培养)
小规模摇管培养是一种适合的培养系统,可以由一个操作员同时处理20多种不同的条件。每天进行一次完全的培养基置换,以模拟培养管中的灌流工艺,为细胞提供新鲜培养基,而去除含有抑制毒性副产物(如乳酸和氨)的耗竭培养基(图2a)。因为使用离心进行细胞截留,可以达到相当高的细胞密度,>50x10^6cells/mL (图 2 b),所以需要严格按24小时的时间间隔进行取样和培养基置换。计划进一步优化建议包括,取样时间应尽量短,这样细胞就不会沉淀,以确保悬浮液的均匀性,并获得有代表性的细胞计数。因此,建议在将其返回到摇床培养箱之前,只同时取样4根管。离心后培养物也应快速处理,因为局部pH值和溶氧(DO)在短时间内会急剧下降,特别是当细胞数量较高时。使用这种方法,可在5天后达到50x10^6 cells/mL的细胞密度,每次培养基置换后,每日收获的上清液中的抗体滴度>0.8 g/L (图2 c)。详细操作步骤,请参考原文。
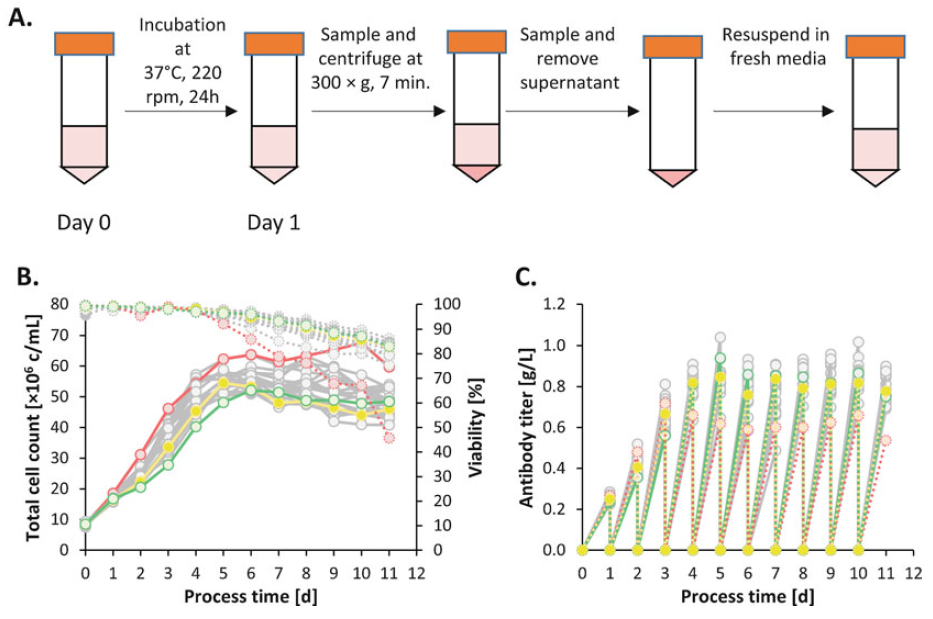
图2. 在摇管微型生物反应器中进行的半灌流运行。按DoE矩阵进行的培养以10x10^6cells/mL的密度接种,每日取样、离心及培养基置换(a);使用这种方法,可在5天内,达到>50x10^6cells/mL的高细胞密度,同时保持高活性(b);每日抗体生产>0.8g/L(c)。
使用响应面方法进行回归分析
(部分)因子设计与中心点、星点的结合称为“中心复合设计”。利用轴向(“星形”)点和重复中心点(图1c)扩展部分因子设计,可以通过建立二阶(二次)多项式回归模型来估计二次效应。对于包含4个因子的响应面,建议一个二次(2阶)多项式函数,以得到15个模型系数(即β0-β14),包括截距(β0)、主因子效应(β1-β4)、因子交互(β5-β10)以及二次效应(β11-β14):
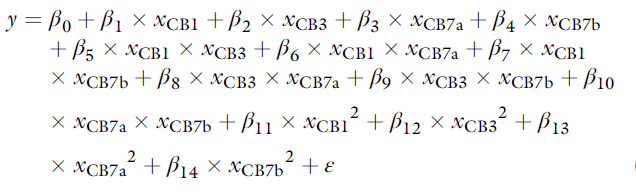
y=响应(抗体滴度或总细胞计数)
β=模型系数
x=因子水平 -1、0或+1(即Cell Boost™ 浓度)
ε=误差
通过软件模型对系数进行最优变化,使模型对实验数据点的拟合达到最优。可以对多个关键的细胞培养属性(响应)进行详细的分析和模型生成,考虑多天的峰值或平均值。峰值容易出现异常值,应仔细评估。利用这种半灌流方法,可以得到稳定的稳态值。建议在达到稳态后(第4天到第11天)计算平均值。详细操作,请参考原文。
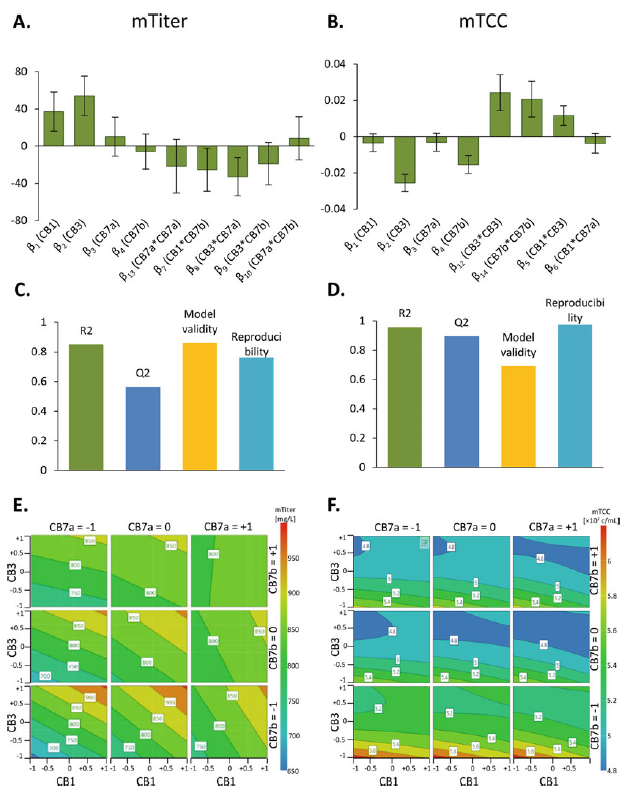
图3. MODDE软件提供的模型输出。使用中心复合设计,可以计算平均低估(mTiter)(a)和平均总细胞浓度(mTCC) (b)的二次模型系数。这些值通过系数除以各自响应的标准偏差,实现“中心和缩放”。因此,不同范围的响应系数具有可比性。mTiter (c)和mTCC (d)的模型质量由R2(绿色)、Q2(深蓝色)、模型有效性(黄色)和重现性(浅蓝色)表示。最大预测mTiter (e)和mTCC (f)的最优因子水平组合可用等高线图表示。
本文节选自下文,由于水平有限,不足之处,还请谅解和指正,详细内容,请参考原文。
原文:P.Mayrhofer,R.Kunert, Screening of Media Supplements for High-Performance Perfusion Cultures by Design of Experiment. Animal Cell Biotechnology: Methods and protocols, 2020, https://doi.org/10.1007/978-1-0716-0191-4_3.






