预计包括单克隆抗体 (mAb)、疫苗、干扰素、激素和生长因子在内的生物制药市场将在 2018 年至 2025 年间实现 13.8% 的复合年增长率,使市场从 2017 年的 1,860 亿美元增长到 2025 年的 5,260 亿美元。单克隆抗体继续主导全球生物制药市场。2018年,6种单克隆抗体产品(阿达木单抗、纳武单抗、派姆单抗、曲妥珠单抗、贝伐单抗和利妥昔单抗)销售额超过60亿美元。此外,新药不断获得 FDA 批准,2018-2019 年美国批准了 18 种新的 mAb 产品。这些单克隆抗体已用于治疗骨质疏松症 (Romosozumab)、镰状细胞性贫血并发症 (Crizanlizumab)、癌症 (Polatuzumab) 和许多其它疾病。最近,发现了新的单克隆抗体,可用于阻断 SARS-CoV-2 感染(人 47D11 mAb)。许多可能用于治疗 SARS-Cov-2 感染的抗体已进入临床试验,包括 Regeneron 的 REGN-COV2 双抗体鸡尾酒、阿斯利康的 AZD7442 双抗体鸡尾酒,以及 Eli Lily、Amgen 和AbCelera 的bamlaniimab (LY-CoV-555)。重磅生物药的到期也在刺激生物仿制药的出现,这将继续推动对产品开发和生产能力的需求。
CHO 细胞:工业蛋白质生产的主力军
多种表达系统可用于生产重组蛋白:细菌、酵母、丝状真菌、昆虫细胞、植物细胞和哺乳动物细胞。然而,哺乳动物细胞培养,更具体地说是中国仓鼠卵巢 (CHO) 细胞,仍然是大规模生产用于临床应用的重组蛋白的主要平台。哺乳动物细胞比其它表达系统更受青睐,主要是因为它们具有无与伦比的能力,能够产生具有类人翻译后修饰的克级生物制品。CHO 细胞培养已得到广泛优化,现在通常可以达到约 3 g/L 的产量,有时甚至高达 10 g/L。另一个促成 CHO 细胞流行的因素是它们在悬浮培养中生长良好的能力,这可以更好地控制培养环境。
适当混合以获得均匀的培养条件对于维持理想的生产代谢状态很重要。然而,由于与施加在细胞上的剪切应力水平有关的问题,单靠提高混合速度并不总是能实现细胞培养的均质性。细胞壁的缺乏使动物细胞比微生物细胞对剪切应力更敏感。尽管如此,CHO 细胞对温度、pH、DO 和压力的变化表现出相对较高的耐受性,使其适用于大规模的生物生产应用。
工艺开发中的规模放大、规模扩展和规模缩小
细胞培养工艺的建立从细胞系开发开始,在此过程中将所需基因转染 CHO 细胞,形成稳定的转染细胞库。从稳定的细胞库中分离出单个细胞,然后根据生长和生产力特征以及产品质量属性,从中选择生产克隆。这些克隆筛选步骤传统上是在简单的小规模培养系统中进行的,例如摇瓶、静态烧瓶、微量滴定板或深孔板,体积通常低于 20 mL。然而,全仪表化的微型生物反应器正变得越来越容易获得,并且最近越来越受欢迎,因此在上游开发的许多步骤中,培养板和摇瓶正在迅速被取代。一旦选择了合适的候选生产克隆,通常会逐步完成从实验室到工业规模生产的工艺开发(图 1)。细胞培养工艺首先转移到台式生物反应器 (1 L–10 L) 以优化工艺条件。台式生物反应器用作工艺原型,以进一步优化各种培养条件,包括 pH、温度、溶氧 (DO)、培养基、补液方式、培养添加物(例如消泡剂和表面活性剂)、搅拌速率和通气策略。然后将细胞培养工艺转移到中试规模的生物反应器(50 L - 200 L),最后放大到商业规模的不锈钢生物反应器(250 L - 30,000 L)或一次性生物反应器(250 L-2,000 L)用于批量生产。由于在生产规模上可能遇到的许多问题,包括培养环境的异质性、溶解的 CO2 积累以及与通气和混合条件相关的过度剪切应力,工艺放大是一个重要的关键步骤。理想情况下,这些问题中的大多数应该在转化至商业化规模生产之前在中试规模上得到解决。中试规模的生物反应器通常也用于提供临床前和临床试验所需的生物材料。在整个培养放大、缩小模型中,通常使用 2 L-5 L 台式反应器或小型生物反应器,用于故障排除以及提高对工艺理解并优化工艺。
另一种增加产量而不是扩大规模的方法是规模扩展。横向扩展包括使用多个生物反应器而不是增加生物反应器的体积(例如,使用五个 2,000 L 生物反应器而不是单个 10,000 L 生物反应器)。横向扩展降低了与工艺放大相关的风险,并提供了更大的灵活性来应对产品需求的变化。然而,使用多个培养容器固有地引入了更大的可变性来源,这可能会对培养性能产生负面影响,进而影响产品的一致性。
规模放大的挑战
尽管台式生物反应器和小型生物反应器广泛用于上游工艺开发,但在这些系统中观察到的细胞培养行为和性能(细胞密度和活性、最终滴度和产品质量、细胞代谢)可能并不总是能够帮助预测大规模工艺。一方面,这可能归因于剪切应力水平和气体传输能力的关键差异,另一方面,可能是由于大型容器中存在不希望的浓度梯度(营养物质、气体和 pH 值)。在生物反应器工艺设计中,操作参数可大致分为两个不同的组:与规模无关的变量和与规模相关的变量。与规模无关的参数包括温度、溶氧、pH、营养浓度和补液方案。原则上,这些参数可以在不同的生产规模上匹配。相比之下,与规模相关的参数可能随生物反应器的大小而有很大差异。这些包括,叶轮叶尖速度、传质系数 (kLa)、表面积与体积的纵横比、气体停留时间、混合时间、混合功率输入、雷诺数(Re) 和表观气体速度。可以认为生物反应器放大包括保持所有与规模无关的参数恒定,同时优先考虑哪些与规模相关的参数保持恒定。由于它们相互依赖,在整个放大过程中保持所有与规模相关的参数恒定几乎是不可能的。例如,如果搅拌速度在所有规模上保持不变以试图保持混合时间,则叶轮叶尖速度将随尺寸增加,从而可能导致细胞损坏。另一方面,如果叶轮叶尖速度在所有规模上保持恒定,大型生物反应器容器的搅拌速度会显著降低,从而增加混合时间。除了放大过程中的混合差异外,气体传输特性也将受到显著影响。随着培养规模的增加,表面积与体积之比降低,从而减少了顶部空间对整体气体转移的贡献。顶部空间中气体传输的减少意味着更大的鼓泡气体流速以满足氧气需求,这也可能由于气泡引起的剪切应力而导致细胞损伤。因此,没有一种显而易见的方法可以进行生物反应器的放大,因为必须做出关键的权衡。工业中使用的最佳放大实践通常是保密的,这一事实使情况变得更加复杂。因此,细胞培养系统的放大仍然是一门通常依靠反复试验来确定最佳工艺参数和操作策略的艺术。
在本文中,我们将重点关注 CHO 细胞培养的放大,以及可用于解决这一具有挑战性任务的程序和工具。首先,将介绍最常见的培养系统,从非仪表化的摇瓶到大型搅拌罐,以及它们在放大生物制药生产中的作用。其次,将讨论培养规模放大对关键工艺参数的影响。第三,将介绍在跨规模放大中采用的基本原则和最近的策略。最后,将讨论放大的有用工具,例如计算流体动力学 (CFD) 和规模缩小模型。
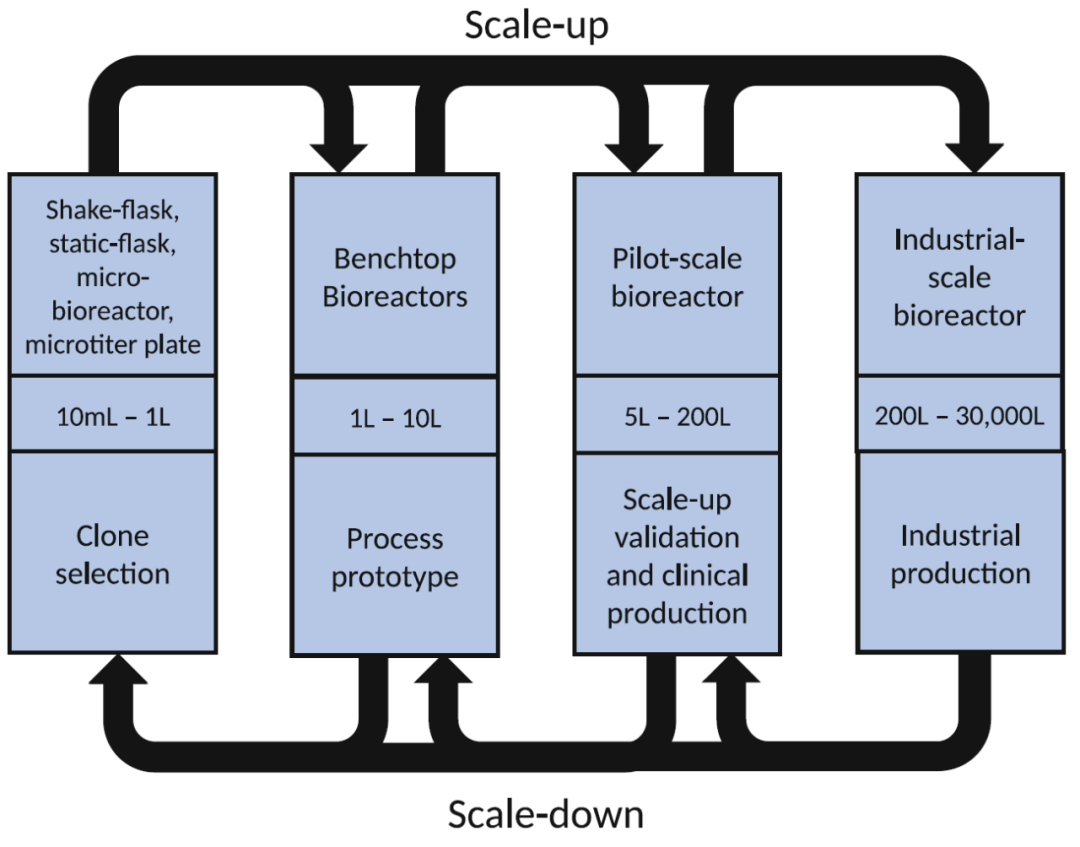
细胞培养工艺开发和规模放大。
针对CHO细胞的培养系统
非仪表系统
许多不同的非仪表培养系统可用于哺乳动物细胞培养,包括锥形瓶、静态瓶、滚瓶、多孔板、TubeSpin 和转瓶。非仪表系统主要优势在于它们的易用性、低成本和高通量能力。它们的主要缺点在于无法监测和控制培养条件,例如 pH 值和溶氧水平,尽管适用于这些培养系统的新传感器技术现在越来越多。摇瓶是最广泛使用的非仪表培养系统,其尺寸通常从 25 mL 到 5 L 不等。较小的烧瓶可用于克隆筛选和种子培养,而高达 5 L 的较大烧瓶通常用于快速生产。这些容器可以由玻璃或塑料制成,并且可以带或不带有挡板,以改善通气和混合。它们可以通过轨道或线性运动来实现搅拌,并且通常保持在温度和二氧化碳控制的环境中。容器尺寸、容量、结构材料、挡板几何形状、过滤器盖设计、振荡器轨道和搅拌速度等操作参数都可能影响细胞培养性能,因为它们对混合和气体传输有影响。它们的主要限制是对表面通气的依赖,与搅拌罐生物反应器相比,导致氧气传输率较低。因此,它们支持高细胞密度培养的能力有限。挡板的存在增加了氧气的传递,但高混合速度可能导致过度飞溅,从而堵塞烧瓶的透气帽。转瓶类似于摇瓶,但用磁力搅拌叶轮搅拌,由于其几何形状更类似于生物反应器,因此更容易规模放大。
孔数从 4(25 mL/孔)到 3,456(1–2.2 μL/孔)的板也可用于细胞培养。这允许进行对筛选活动特别有用的高通量甚至超高通量小型化培养。这些板可用于荧光和磷光测量,并允许堆叠,以最大限度地利用培养箱中的空间。值得一提的是,24 深孔板和摇瓶之间的生长速率、活性和蛋白质产量相当。
静态培养瓶和滚瓶的功能与摇瓶类似;然而,它们提供了一个贴壁细胞附着的表面。滚瓶具有更大的表面积,以增加细胞密度。增加表面的滚瓶具有与标准瓶相同的尺寸,但通过在瓶内添加褶皱设计,进一步增加了细胞可用的表面积。滚瓶优于静态培养瓶,不仅因为它们具有更高的表面积,而且还增强了气体传输能力,并提高了培养基的均匀性。滚瓶可以堆叠并整合到一个用于培养接种、补液和收获的全自动系统中。
为了更密切地监测和控制细胞培养,已开发出与小型培养设备兼容的新传感器技术。例如,PreSens 的 Shake Flask Reader® 可以监测 pH 值、溶氧水平和氧气吸收率 (OUR),从而可以调整摇动速度,以避免氧气限制。此外,现代化的培养箱可能具有三气(二氧化碳、氧气和氮气)控制,因此可以在缺氧或高氧条件下进行细胞培养。Kuhner 的 RAMOS®(呼吸活动监测系统)和 TOM®(传输率在线测量)允许测量顶部空间中的溶氧和二氧化碳水平。这可以提供氧气吸收率(OUR)、碳释放率 (CER) 和呼吸商 (RQ) 的实时测量。直到最近,这些参数只能在搅拌罐生物反应器中可靠地测量。虽然非仪表化的烧瓶过去大量用于上游工艺开发,但它们正越来越多地被能够更好地模拟大规模条件的微型生物反应器所取代。
微型和迷你生物反应器
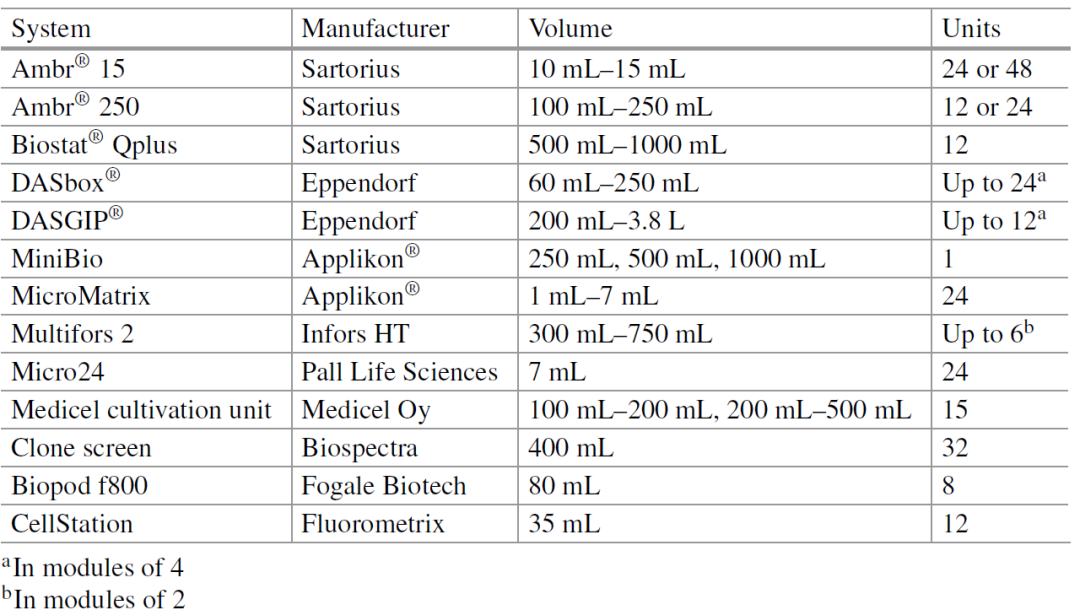
微型生物反应器系统为快速优化细胞培养参数提供了强大的工具,包括 pH、DO、温度、营养浓度、预培养年龄、接种密度、通气、混合等。微型生物反应器系统允许高通量细胞培养,同时监测和控制溶氧、pH、搅拌和通气。由于易于设置和较短的周转时间,此类系统非常适合实验设计 (DoE),从而提高了设计空间的分辨率和准确定义,并缩短了克隆筛选时间,加速了工艺开发。许多不同的微型和迷你生物反应器系统都可以在市场上买到(表 2),并且可以批次或补料分批模式运行,有时甚至可以在灌流模式下运行。这些微型和迷你生物反应器系统的体积范围从 10 mL 到 1 L,可并行运行1-48 个培养(取决于制造商),并且都具有 pH、DO 和温度控制。Ambr® 15 和 Ambr® 250 是两个最常用的微型和并行微型生物反应器系统。后者具有针对单独单元的温度和混合能力,可以在补料分批和灌流模式下操作,并且在几何形状上与大规模系统更相似,而前者的温度和搅拌控制仅限于一个由 12 个微生物反应器容器组成的区块。
可用于哺乳动物细胞培养的自动化微型和迷你生物反应器系统
微型和迷你生物反应器系统是非常宝贵的工具,不仅可用作大规模生物反应器的缩小模型,而且还大量用于克隆筛选。与摇瓶相比,Ambr®15 中的细胞培养性能更接近于实验室规模或更大的生物反应器。例如,据报道,Ambr® 15 和 2 L 或 5 L 生物反应器的细胞活性、细胞浓度和产品滴度相当。同样,在 Ambr® 250 生物反应器中进行的细胞培养显示出与在 5 L 生物反应器中获得的结果相当的最终产品滴度、代谢物特征和产品质量属性。
搅拌罐生物反应器(玻璃和不锈钢)
搅拌罐生物反应器的使用是生物制药行业生产重组蛋白的首选方法。对于细胞培养应用,玻璃和不锈钢生物反应器的尺寸从 1 L 台式到 20,000 L 工业生物反应器不等。通常,生物反应器配备溶氧和 pH 探针以及温度传感器。氧气水平通过鼓入空气、纯氧以及有时是氮气来控制。pH 设定点由碱添加和二氧化碳通气控制。温度可以通过加热毯和冷却盘管组合来控制,也可以通过使用夹套容器来控制。混合是通过连接到轴上的叶轮的旋转来实现的,其旋转由位于搅拌罐顶部或底部的机械或磁力电机驱动。
一次性生物反应器
一次性生物反应器 (SUB) 构成了可重复使用的玻璃或不锈钢生物反应器的替代品,并且由于其众多优势而越来越多地被生物制造行业采用。与可重复使用的生物反应器相比,SUB 允许更快的设施设置、减少停机时间、降低污染风险并且还具有更低的初始投资成本。工艺验证和操作也大大简化,因为 SUB 是预先灭菌的。然而,这些系统的尺寸有限(一般最高为 2,000 L),每批次的运营成本可能高于可重复使用的生物反应器。尽管如此,一次性生物反应器的性能已被证明与各种规模的可重复使用生物反应器的性能相当。市售的 SUB 主要有两种类型:搅拌罐和波浪式生物反应器。搅拌罐 SUB 由放置在硬性生物反应器容器或包含集成搅拌器的刚性塑料容器内的塑料袋组成。驱动器以机械方式或磁性方式连接到搅拌器。搅拌 SUB使用钻孔鼓泡,可实现高达 20 W/m3 的功率输入和 3-8 h-1 的氧气传质系数,这些值与传统生物反应器中常见的值相当。波浪式 SUB 是放置在摇摆混合器上的袋子,因此不包含搅拌器。它们通常在大规模生产的种子培养扩增过程中以灌流模式使用。波浪式SUB 具有更均匀的能量耗散和较低的泡沫形成,并且还显示出与搅拌 SUB 相当的细胞培养性能。一次性生物反应器的尺寸范围从 15 mL(例如 Ambr® 15)到2,000 L(针对搅拌罐)以及 50 mL 到 500 L(针对波浪式)。可重复使用的生物反应器中的所有传感器和控制回路都可以在搅拌罐 SUB 中找到,并以一次性传感器或非侵入式光学传感器或超声波传感器的形式出现。
本文为以下文献内容简介,详细内容,请参考原文。本文旨在知识、信息分享,转载请注明出处和原文。
原文:L.Lemire, P.L.Pham, Y.Durocher, et al., Practical Considerations for the Scale-Up of Chinese Hamster Ovary (CHO) Cell Cultures. Cell Culture Engineering and Technology, 2021.






