驱动体内疫苗抗原表达的一种策略是利用遗传指令的天然载体,例如病毒。在感染期间,病毒通过“劫持”宿主细胞机制进行自我复制来繁殖。因此,病毒本质上具有进入靶细胞、将遗传指令传递到关键细胞内区室并驱动有效蛋白质表达的能力。在许多领域– 包括基因治疗、免疫治疗、疫苗设计等一直在追求的一个想法是利用病毒的这些内在特征来指导体内基因表达。简而言之,将编码这些目的基因的转基因盒插入病毒基因组中,通常是通过替换关键病毒基因来实现的。这种替换具有双重目的:(1)出于安全目的,使病毒无能力复制或毒性降低,以及(2)释放空间,以插入基因而不显著改变固有的基因组大小。在过去的几十年中,不同的病毒已被开发成载体,包括Ad、巨细胞病毒、腺相关病毒 (AAV)、痘病毒、疱疹病毒和逆转录病毒。
Ad载体
Ad通常会导致轻微或无症状的呼吸道感染,尽管在免疫功能低下的个体中感染可能更严重,甚至危及生命。Ad组成为包裹在蛋白质衣壳中的双链 DNA 基因组。衣壳结构包括从核心延伸并与宿主细胞上表达的受体结合的纤维突起,介导细胞进入。
Ad最初是作为基因治疗的一个有前景的平台,可以在患有遗传疾病的患者中提供和诱导缺失或突变基因的持续表达。Ad感染多种细胞类型(包括肝细胞、成肌细胞以及上皮细胞和内皮细胞)的独特能力对于广泛诱导基因表达特别有益。1992 年首次使用 Ad 载体治疗两种遗传疾病:α-1抗胰蛋白酶缺乏症和囊性纤维化。在这些研究中,Ad 载体被证明可以有效地将治疗性遗传物质递送给宿主细胞。然而,Ad 载体触发了识别外来病毒结构模式的炎症宿主先天免疫途径。这种先天免疫的触发限制了 Ad 载体转导以及转基因的表达。它还诱导了针对载体的适应性免疫反应,这限制了持续治疗基因表达所需的后续载体给药的效率。因此,Ad 载体在基因治疗中的使用受到其强大的免疫原性的限制
Ad载体疫苗的免疫源性
尽管 Ad 载体的内在免疫原性对其在基因治疗中的应用提出了限制,但这些特性促进了 Ad 载体作为疫苗平台的发展。在疫苗的背景下,先天免疫激活和抗原表达是促进疫苗功效所需的抗原特异性 T 细胞和 B 细胞下游扩增的关键。强调基于载体的疫苗的这一特征的事实是,其它平台,例如基于亚单位或蛋白质的疫苗,通常需要额外的佐剂或成分来引发强劲、有效的免疫反应。相比之下,Ad是自佐剂,简化了疫苗的组成和配制过程。Ad通过激活检测病毒成分的细胞传感器,内在地诱导宿主先天免疫反应。Ad 载体的主要先天免疫触发因素是病毒基因组,其中包含宿主遗传物质中不常见的外来模式和序列。研究已显示,缺乏 DNA 的Ad衣壳可诱导的先天反应降低。因此,TLR9 和环磷酸鸟苷-AMP 合酶(cGAS) 等外源 DNA 传感器在 Ad 载体先天免疫中起关键作用。这种先天的传感器激活会导致炎症、干扰素等细胞因子的产生以及免疫细胞在接种部位的组织浸润。在这种炎症环境中同时表达抗原可以上调 APC 上的共刺激标志物。因此,APC 推动了适应性 T 细胞和 B 细胞的扩增,这些细胞对疫苗免疫和免疫记忆至关重要。
除了它们的自佐剂能力之外,使 Ad 成为适合疫苗载体的另一个特性是它们的向性。它们具有内在的细胞转导能力,可以在分裂和非分裂细胞中有效表达转基因抗原。这种灵活性增加了跨多种细胞类型成功、高水平转基因表达的可能性,从而导致有效的原位疫苗抗原产生,这是强劲的抗原特异性疫苗免疫所必需的。
预先存在的免疫力
尽管 Ad 载体有效地介导细胞中疫苗转基因的广泛和有效转导,但这种能力取决于宿主中缺乏大量预先存在的 Ad 免疫。在人群水平上,如果人们已经感染了用作疫苗载体的 Ad 类型,那么成功的 Ad 载体免疫可能会因先前存在的免疫力而受阻。大多数人类Ad在世界各地无处不在,并已感染了大多数成年人口。这会诱导针对 Ad 疫苗载体的中和抗体 (NAb) 并干扰细胞进入。已经制定了各种策略来解决这个问题,包括使用少见的人类或非人类Ad以及载体衣壳工程来逃避中和。
人类Ad可分为 A-G 七组,并包含至少67 种不同的血清型。尽管这些血清型中的大多数是常见的,但罕见的人类 Ad,如 Ad26 和 Ad35,在人类中的血清阳性率低于 Ad5。两种血清型都已被证明可以逃避普遍的 Ad5 免疫并诱导强大的、保护性抗原特异性细胞和体液免疫反应。在发展中国家,基线 Ad26 免疫很常见,但基线 Ad26 中和抗体滴度仍然很低,似乎不会抑制基于 Ad26 的疫苗。
Ad26和其它几种Ad 血清型的初始克隆和载体化允许比较各种候选 Ad 载体平台的血清阳性率和免疫原性。除了低滴度的基线载体特异性抗体和高免疫原性外,Ad26 载体还可以生长到高滴度,从而实现大规模生产。Ad26 疫苗已成功从临床前研究推进到针对 HIV 和其它病原体的临床试验,这为利用 Ad26 开发针对 SARS-CoV-2 和其它病原体的疫苗奠定了基础。
同样,非人类Ad也被用作疫苗载体来解决抗载体免疫问题。非人类血清型在基因和结构上与人类 Ad 相似,因此它们很容易用作疫苗载体。常用的非人类 Ad 包括黑猩猩 (ChAd)、大猩猩(GAd) 和恒河猴 (RhAd) 血清型。ChAd 疫苗载体的安全性和有效性已在针对 SARS-COV-2、HIV 和狂犬病的临床前和临床研究中得到证实。然而,在发展中国家,某些 ChAd 的基线血清阳性率已被证明高达 20%。这激发了人们对发现替代载体的兴趣,例如 RhAd,它们与人类 Ad 的系统发育距离更大。RhAd 已在 HIV 和寨卡病毒的临床前研究中进行了评估。
此外,也出现了重新设计载体以规避预先存在的免疫力的策略。这些策略旨在识别和替换预先存在的免疫所针对的特定区域、序列或表位。抗载体抗体和 T 细胞主要靶向 Ad 载体的表面抗原以抑制疫苗效力。在表面抗原中,六邻体蛋白是 NAb 的主要靶标。因此,可以通过替换暴露表位的六邻体序列来规避预先存在的免疫。该方法已应用于 Ad5 并允许增强转基因表达。
Ad载体设计、生产和应用
Ad包含 34-43 kb 的双链 DNA 对,这是一种相对较小的病毒基因组,可以轻松进行操作(图 3)。腺病毒载体的构建通常涉及关键病毒基因 E1 敲除,以使病毒复制缺陷。如上所述,这种修饰增强了安全性并允许插入目的疫苗抗原转基因。进一步的设计改进已将 E3 区域确定为敲除的额外目标,从而释放空间以容纳更大的转基因。因为已证明 E3 蛋白可抑制理想的细胞先天免疫反应,基因的敲除也提供了最佳的载体先天免疫原性。一旦构建了 Ad 疫苗基因组,就可以将其用于转染包装细胞,例如 HEK293,以制备针对抗原表达和功能进行筛选的初级病毒库。包装细胞转染或补充 E1 基因,以允许病毒载体复制。最后,初级库经过大规模生产和纯化,以供临床使用。
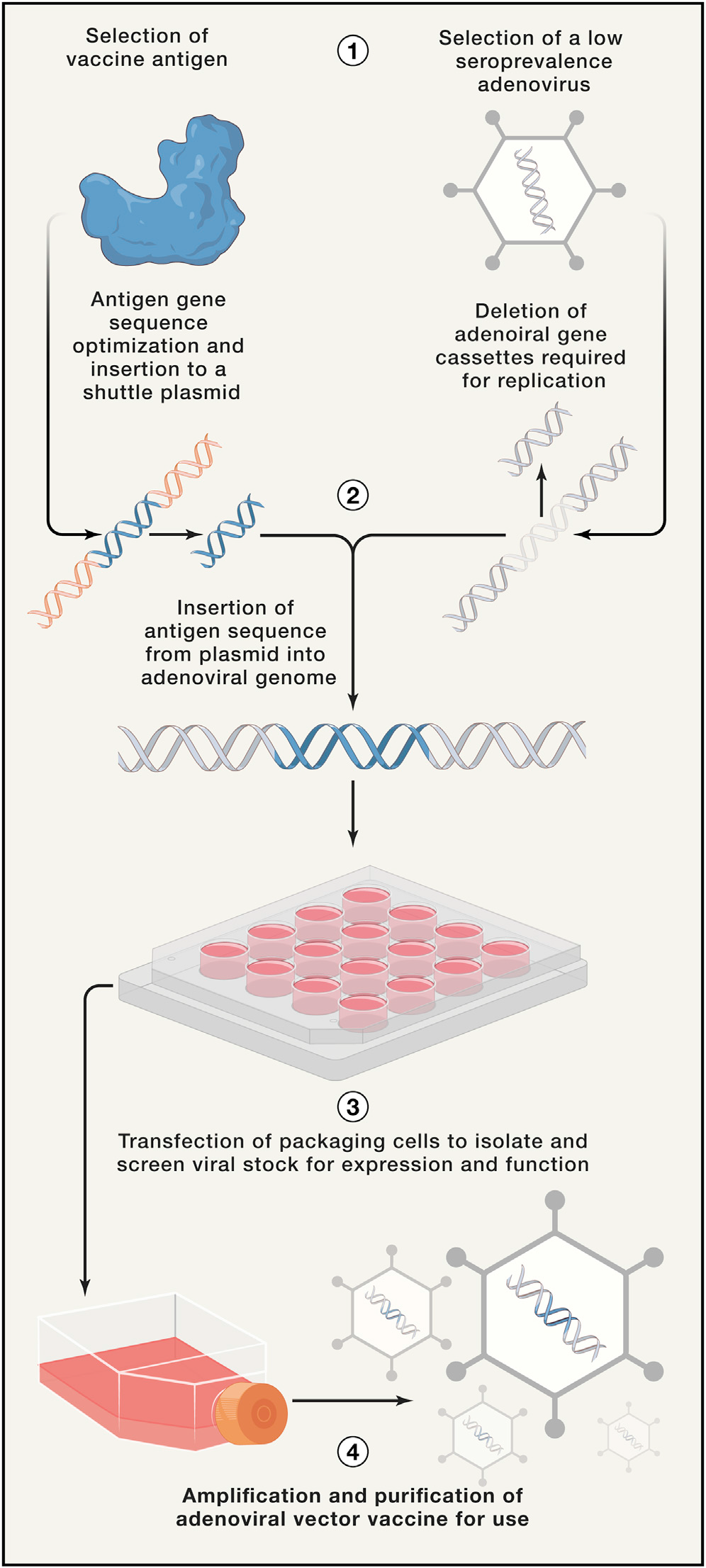
图3. 腺病毒载体疫苗开发的过程。(1) 首先鉴定出具有低血清阳性率的疫苗抗原和腺病毒载体。(2)优化病毒抗原基因序列,克隆到穿梭质粒中。该质粒用于将抗原序列插入腺病毒骨架中以代替病毒基因盒。(3) 在病毒包装细胞中制备初级病毒原液并筛选抗原表达和功能。(4) 最后,扩增和纯化病毒原液用于免疫。
至关重要的是,这种将遗传指令整合到 Ad 基因组中的方法能够灵活、快速地开发疫苗。例如,Ad 载体提供了整合和筛选同一抗原的不同序列变体、以快速识别最佳候选疫苗的潜力。除了疫苗开发的简便性和速度外,Ad载体的生产还具有良好的可放大性,并且不需要高水平的生物安全措施和基础设施,特别是与需要在灭活之前大规模生产高传染性和毒性病原体的疫苗方法相比。例如,杨森 (Janssen) 的 AdVac 和PER.C6 高密度细胞生产技术能够加速大规模生产数百万剂 Ad26-埃博拉病毒疫苗,该疫苗已在刚果民主共和国 (DRC) 和卢旺达广泛使用,并且最近在欧洲获得了监管部门的批准。
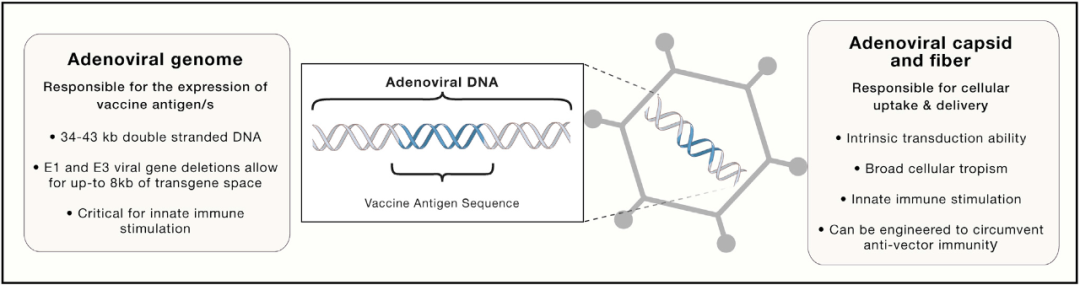
图4. 腺病毒载体疫苗的特点。腺病毒疫苗载体包括病毒基因组,该基因组含有用于表达的目的抗原基因以及用于细胞递送的病毒衣壳和纤维。
Ad载体的这些优势使其成为适用于多种病原体的有前景的疫苗平台(图 4),包括 HIV 等持续性感染疾病。对于 HIV,Ad 疫苗允许使用 HIV 抗原的多价或镶嵌序列,其可以一起表达以引发显著增强的免疫反应。Ad载体疫苗也已开发用于其它持续性感染,例如丙型肝炎和流感。大多数 Ad 疫苗是针对病毒性疾病开发的,因为这些载体通过触发类似的先天免疫传感器并诱导有效的抗体以及 CD8 细胞毒性反应来模拟病毒感染,这对于清除病毒和裂解病毒感染的细胞至关重要。然而,Ad疫苗也被开发用于细菌和寄生虫病,如肺结核和疟疾。基于 Ad 载体的疫苗的快速、可放大开发潜力也使它们非常适合应用于快速疫苗开发和广泛分发至关重要的爆发性流行病场景中。因此,针对埃博拉病毒和寨卡病毒等爆发病毒开发了腺病毒疫苗。
本文节选、翻译自以下文章,由于水平有限,详细内容,请参考原文。文章旨在知识分享,如有任何问题,请联系处理。
原文:M.S.Gebre, L.A.Brito, L.H.Tostanoski, et al., Novel approaches forvaccine development. Cell, 2021, 184.






