基因治疗中的病毒载体和临床应用
2022-11-09 14:32:07
基因治疗的发展,加上基因组测序的进步和对 DNA 序列的更深入了解,已经产生了一个令人兴奋的研究领域。在过去的几十年中,在基因治疗中使用病毒载体已成为一项非常有前途和快速发展的技术。尽管此前曾遭遇挫折,但全球范围内病毒载体疗法的批准,以及许多处于后期临床试验阶段的产品,导致基因治疗领域的研究显著增加。逆转录病毒、腺病毒、腺相关病毒和慢病毒载体都是目前正在研究和用于临床试验的重要载体。使用病毒载体存在许多尚未克服的挑战,包括生产成本、免疫反应和精确调节转基因表达的能力。然而,随着越来越多的临床试验显示出疗效及其安全性和不断增长的金融投资,病毒载体在基因治疗中的未来应用前景越来越大。基因治疗,定义为将特定基因递送到靶细胞以治疗疾病的方式,是一种很有前途的分子技术,已迅速成为一个突出的研究领域。可以使用基因疗法治疗的临床疾病包括严重联合免疫缺陷 (SCID)、血友病、色素性视网膜炎、糖尿病和各种类型的癌症。随着我们对基因功能和相互作用的了解不断加深,以及基因组测序的可用性越来越高,我们对 DNA 序列如何用于治疗或治愈由遗传功能障碍引起的疾病的知识有了很大的发展。将特定遗传物质递送至宿主细胞需要使用载体,以通过病毒或非病毒方式将转基因转移至特定细胞类型。用于递送的非病毒载体技术包括电转、脂质转染和 microRNA,这些都是有用的基因治疗方法,因为它们降低了生物风险,提供了降低的免疫原性,并且与病毒载体相比,生产成本和时间成本更低。然而,非病毒载体通过转染进入细胞的能力不如病毒载体有效,因此,过去几十年的研究更多地集中在病毒载体的使用上,这是本文的重点。已用作载体的常见病毒包括腺病毒、腺相关病毒、逆转录病毒和慢病毒。虽然这些病毒的使用存在局限性,但进一步的研究和对其结构的改进可能会允许它们在临床环境中使用。事实上,目前有多项临床试验在全球范围内使用病毒载体进行基因治疗。在后期临床试验和实验室环境中成功使用病毒载体促进了风险投资公司不断增加的投资以及制药公司对基因治疗初创企业的收购。在基因治疗中对病毒载体的日益关注和投资是它们未来使用的一个非常有希望的迹象。下文将总结目前正在研究用于基因治疗的不同病毒载体,并回顾这些病毒载体的不同临床应用,阐述它们使用的优点和局限性,讨论使用这些载体观察到的成功案例以及该领域当前面临的限制。病毒已经进化出特定的结构特征,使它们能够有效地进入宿主细胞并有效复制。我们的定位是利用这些特性来生产用于临床的安全载体,同时仍保持携带转基因的病毒进入宿主细胞的能力。这为一系列疾病的有效疗法提供了巨大的潜力。病毒载体大致由三种不同的成分组成,这些成分会根据其来源的病毒类型而有所不同。这些基本成分包括囊膜、所需的转基因(被囊膜包裹)和一个由一组控制转基因表达的基因组成的调节盒。图 1 概述了如何将所有这些成分结合起来形成一个载体系统。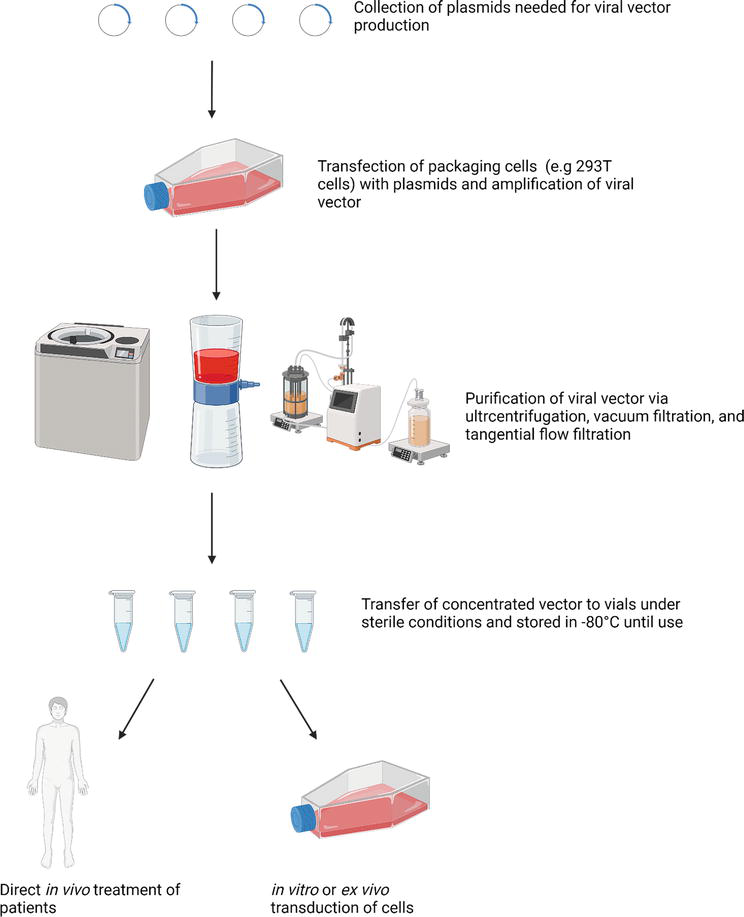
图1. 生产用于体内和体外应用的病毒载体。质粒数量和包装细胞可能因生产的病毒载体类型而异。在过去的四十年中,病毒载体已用于临床试验,并取得了不同程度的成功。1999 年,一名临床试验参与者在接受腺病毒载体治疗部分鸟氨酸转氨甲酰酶 (OTC) 缺乏症后死亡。患者出现全身性促炎反应,导致多器官系统衰竭。在另一项临床试验中,当一名患有 X 连锁严重联合免疫缺陷 (SCID X1) 的患者通过逆转录病毒介导的基因转移至 CD34 骨髓细胞进行治疗时,获得了成功。然而,在试验中的其他患者中,这种治疗引发了白血病的发展。这些负面结果降低了对基因治疗的资金和信心,尤其是腺病毒和基于逆转录病毒的载体系统。尽管如此,研究仍在继续更好地了解病毒载体的安全性和有效性,使其成为可行的临床选择。研究最深入的病毒载体是逆转录病毒、腺病毒、腺相关病毒和慢病毒载体。逆转录病毒具有单链 RNA,编码病毒蛋白;组抗原 (gag)、DNA 聚合酶 (pol) 和病毒囊膜(env)。RNA 链被糖蛋白囊膜包裹,允许该病毒进入靶细胞。一旦内化,病毒基因组就会整合到宿主 DNA 中,形成前病毒。然后病毒蛋白能够被转录和翻译,之后离开细胞。由于它们能够有效地进入靶细胞,逆转录病毒载体是基因治疗中使用最广泛的病毒载体之一。逆转录病毒载体是从一种失能的鼠病毒发展而来的,只能转导分裂细胞。逆转录病毒载体在基因治疗中是有益的,因为它们可以整合到宿主细胞基因组中,从而实现持续的基因表达。然而,病毒蛋白的产生具有发生插入突变的风险,可能导致肿瘤发展。这在 2003 年发现了明显的证据,当时这种类型的载体被用于治疗 (SCID)-X1 疾病的临床试验,其中四名参与者在治疗 3 年后患上了白血病。这是由于逆转录病毒载体整合过程中细胞癌基因的激活。这引发了对该载体的生物安全性的担忧,并导致重新评估逆转录病毒载体在基因治疗中的使用,从而将重点转移到替代性病毒载体系统上。腺病毒是无囊膜的双链 DNA 病毒,属于腺病毒科。至少存在 47 种人类腺病毒类型,通常会导致结膜和呼吸道疾病。人类腺病毒在环境中无处不在;因此,大多数人都会对病毒产生免疫力。感染通常只是轻微的,但在免疫抑制的个体中,它可能很严重。与逆转录病毒载体不同,腺病毒载体可以将基因递送到分裂和非分裂细胞中,并具有相对较大的基因盒容量(8 kB)。它们还可以高滴度生产并以高感染复数递送基因。由于这些特性,它们已成为体内实验和基因治疗临床试验中最常用的病毒载体之一。然而,由于过去的暴露会产生免疫记忆,腺病毒载体会引发强烈的炎症反应,这会显著限制其临床应用。此外,腺病毒载体不能整合到宿主的染色体中,这意味着转基因的表达是附加型的,因此是短暂的。由于这一限制,腺病毒载体不常用于需要持续基因表达的疾病,但更常用于产生短期基因表达。例如,腺病毒载体可用于癌症研究,以递送自杀基因来杀死肿瘤细胞。腺相关病毒 (AAV) 是小的、无囊膜的病毒颗粒,含有单链 DNA 分子。这些病毒是依赖病毒属的成员,因为它们需要与其它病毒共同感染,并且可以转导具有长期表达的分裂和非分裂细胞。腺相关病毒表达病毒基因 rep(复制)、cap(衣壳)和aap(组装)病毒基因,但在开发 AAV 载体时会去除这些基因,从而提高其安全性。AAV 在不借助病毒蛋白的情况下进入宿主细胞并产生重组 AAV 分子的能力是有利于其使用的关键组成部分,并将其与其它载体系统区分开来。病毒引起疾病和/或不良事件的风险较低是近几十年来 AAV 成为越来越受欢迎的选择的主要原因。它们整合的特定位置性质进一步提高了它们的安全性,因为它限制了潜在的致癌后果。然而,这些载体的基因载荷容量有限(4.8 kB),而且许多人已经预先存在针对 AAV 变体的抗体,这可能会对基因递送和表达水平产生影响。一些 AAV 血清型无法达到足够高的表达水平以实现有效治疗,这是 AAV 广泛用于临床应用需要克服的限制。慢病毒是逆转录病毒科成员的 RNA 病毒。慢病毒感染可导致多种疾病,包括神经系统疾病、关节炎和免疫缺陷。慢病毒在其表面具有糖蛋白,使它们能够进入多种细胞类型。与逆转录病毒载体一样,它们拥有允许慢病毒存活和复制的病毒基因 gag、pol 和 env,以及增强病毒基因转录和传播的 tat 和 rev 基因。作为一种毒性很强的病原体,对通过使用慢病毒载体形成具有复制能力的载体的担忧减少了它们在过去的应用。慢病毒载体可以转导分裂和非分裂细胞,从而使其成为一系列基因递送应用的理想选择。此外,慢病毒载体不会引起强烈的免疫反应,因此,这些是临床应用的有利选择。这些载体允许长期转基因表达,因为它们整合到宿主基因组中,并且插入不太可能发生在靠近原癌基因的位置,因此限制了插入诱变的风险。大多数慢病毒载体是从人类免疫缺陷病毒 (HIV) 发展而来的,这导致了一些生物安全问题。为了提高慢病毒载体的安全性,第二代载体具有一个编码gag、pol、rev和tat基因的包装质粒,并去除了额外的辅助毒力因子。尽管删除辅助因子代表了对原始载体系统的重大改进,但仍然存在产生重组病毒的风险。为了解决这个问题,在第三代慢病毒载体中,包装质粒进一步分裂,gag 和 pol 基因包含在一个包装质粒中,rev 包含在另一个包装质粒中,env 包含在第三个质粒中。通过这样做,重组病毒形成的机会极低。由于载体质粒中 3'LTR 的缺失,第三代载体也会自我失活,从而阻止病毒的持续复制。与第二代载体相比,使用第三代自灭活慢病毒载体可通过去除长末端重复启动子显著降低病毒复制和 HIV 发展的生物安全风险。本文为以下文献内容简介,详细内容,请参考原文。本文旨在知识、信息分享,转载请注明出处和原文。原文:A.L.G.Mahoney, N.T.Nassif, B.A.O’Brien, et al., Viral Vectors in Gene Therapy and Clinical Applications. Molecular Cloning, 2022.



