随着生物制药行业的飞速发展,各大药企将会布局越来越多的研发管线以及开发多样化的药物分子。近些年,随着药品审评审批制度的改进,使得大批生物药进入临床的步伐大大加快。对于生物制药企业而言,机遇与挑战并存,生物制药的竞争将会愈演愈烈,一方面,如何有效降低成本,造福更多的患者;另一方面,如何提高产品质量,赢得更多的市场份额,已成为生物制药企业的生存法则。
为了有效地降低生产成本,提高厂房利用率,需要新技术的变革。越来越多的生物制药巨头已转向连续生物生产工艺。例如,早在2016年4月,美国强生公司药品生产基地的连续制造生产车间工艺变更获得FDA批准,这是FDA第一次批准批次制造向连续制造的生产工艺变更,目前有三个抗体品种已开始使用连续制造工艺。
此外,还有礼来制药将爱尔兰建设全球连续制造中心,葛兰素史克在新加坡建立了连续制造工厂,安进在新加坡也建立了单克隆抗体的连续纯化制造车间;以及此前Biosana Pharma宣布其开发的奥马珠单抗生物类似药获批进入临床试验,是目前第一个使用全连续生产工艺开发的单克隆抗体药物。
生物制药目前都是以批次生产的方式,即从工艺起点开始,经过多个有停顿的中间步骤,最终获得终产品的过程。连续生产工艺即连续生产,在食品,石化和化学品生产上已经被使用多年,和批次生产不同的是,连续生产中原料在工艺起点持续加入,终产品在终点持续收获,理论上中间没有停留的步骤,所以被称之为连续生产。在这一过程中,药品质量在生产过程中可以被很好的控制,而不是只依靠终产品达标来进行质量放行。
蛋白产物完成初级回收后,需要进一步捕获和精纯。
系统缺陷: 常规柱层析以批次模式运行,缓冲液和介质的利用率低。其次,受柱压影响,层析柱体积无法扩大,蛋白类产物易失活且处理效率及回收率低;
连续纯化技术主要有以下优点:
开发了连续环状层析(continuous annular chromatography,CAC),径向流层析(radial flow chromatography,RFC) ,膨胀床吸附层析(expansion bed adsorption chromatography,EBA ) ,多层逆流溶剂梯度层析( multi-layer countercurrent solvent gradient chromatography,MSCGP)、周期性逆流动层析(periodic counter-currentchromatography,PCC) 、连续逆流切向层析(continuous countercurrent tangential chromatography,CCTC)、模拟移动床层(simulated moving bed,SMB) 等连续多柱层析技术。
2.1 周期性逆流动层析
PCC是由Cytiva(原GE医疗生命科学事业部)开发,用来连续捕获蛋白质的方法。如下图所示为3柱PCC,所有的吸附柱串 联连接形成吸附列。
物料从第一列开始加载,当第一 列饱和时,根据流向切换其位置,物料加载位置变为第二列,然后对第一列单独进行洗涤,洗脱,再生和平衡操作(洗脱液连续加载到第三列,进一步捕获第一列未结合的目的蛋白),平衡后的第一列通过位置切换变成第三列,整个过程以此方式循环运行。与常规(单柱)层析相比,PCC 的树脂容量和利用率更高但缓冲液的消耗更低。
基于其工作原理,PCC系统的设计必须确保蛋白质加载时间大于或等于第一列洗脱和再生的时间。
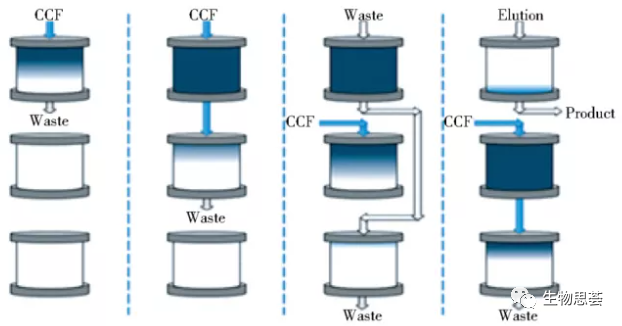
这种3柱周期性逆流层析(three columns periodic counter-current Chromatography,3C-PCC)工艺,对比常规蛋白A批次处理,PCC系统的处理效率提高了60%,缓冲液和层析填料消耗量降低了60%。
其次,PCC系统与批次处理对比发现在相同条件下PCC系统最高可降低75%的层析填料消耗,这也意味着缓冲液消耗也减少,有效降低了工艺成本。基于其原理PCC多柱层析常应用于mAb的初始捕获,当使用PCC处理高滴度产品时,其捕获柱的加载时间会急剧缩短。
2.2 模拟移动床层析
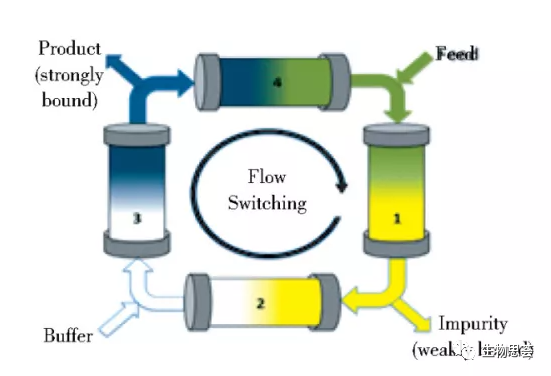
SMB系统是利用差示色谱来连续(循环)分离二元混合物,SMB系统使用多个填充柱,以模拟逆流(但没有固相运动)的方式定期切换进料、流动相、回收端口,以此来增加两相之间的传质推动力。
如下图所示为典型的4列配置,系统运行时,物料(产品和杂质的二元混合物)被加载到右上角的第1列。两种组分都随着柱子迁移,然后从柱子出口处的端口开始回收结合力较弱的物质(此时为产品),与此同时,在第2列和第3列之间可添加额外的流动相,从第3列中回收结合力较强的成分。
随着大部分产物随第1列迁移,进料位置,流动相位和回收端口顺时针旋转(与流动方向相同)以此来模拟固相的逆流运动,这种运行模式可极大的降低缓冲液的消耗,同时增加树脂的利用率,有效降低工艺成本。
SMB技术主要用于蛋白质脱盐,病毒纯化,核苷纯化和融合蛋白重折叠。工业上主要用于石化和制糖行业的大规模分离。
目前,它还被应用于制药工业中手性药物及其对映体的分离。利用以亲和层析为基础的SMB系统对单链抗体可变区片段(scFv)进行纯化,结果显示相比批次处理SMB的产量提高了 9%,生产率提高了 11倍。
为了提高系统处理效率及回收率,在操作过程可将部分产物重新混入进料进行回填操作。还设计了一种快速驻波用来优化其操作参数(流量和端口切换时间),使其过程性能(如解吸剂使用量和产量)保持最佳状态。SMB为多柱串联模式对二元以上的混合物具有较好的分离效果,但其串联模式使得产物的纯度和回收率之间容易形成制衡。
2.3 连续逆流切向层析
连续逆流切向层析系统由3列CCTC体系组成,层析柱由多个独立模块代替,每个独立模块由一个或多个阶段组成,每个阶段包括相互连接的切向流过滤器和静态混合器,静态混合器控制物料停留时间,中空纤维膜保留大的树脂颗粒,同时让所有溶解的物质,包括蛋白质和缓冲剂组分通过膜进入渗透物。
系统运行时物料与浆液形式的色谱树脂混合,按一定顺序通过每个模块,每个模块对树脂进行类似的操作(结合,淋洗,洗脱,再生和平衡)。在结合,淋洗,洗脱和再生步骤中使用的缓冲液在每个步骤内以多级配置与树脂浆液逆向流动,实现高回收率和高纯度回收,同时降低缓冲液消耗。
利用CCTC系统对蛋白A操作后的抗体进行精纯,将CCTC用于捕获后抗体纯化步骤。在蛋白A操作之后,使用具有两种不同粒度的混合模式阳离子交换-疏水作用层析树脂来减少宿主细胞蛋白质(HCP) ,浸出的蛋白A,DNA和来自mAb中的聚集体。
最终结果显示其生产率高达100g/L填料/小时,比批次处理高了10倍,随后在(pH 4~4.5)内对洗脱pH进行优化,使产量增加了5%.最后还将实验结果进行了放大设计,预测了500L和2000L批次的简洁型CCTC流动路径。利用CCTC成功从澄清的细胞培养液中初始捕获和纯化了两种单克隆抗体,其产品质量与用填充柱蛋白A层析法得到的相似。
目前预想中的完全连续式生产是从生物反应器到药物原液 (DS) 的产出,密闭式系统、无菌、全自动、总体的生产工艺控制,以及能够长时间的操作。高密度细胞培养、细胞滞留装置、分离细胞后的收获液直接经过不同柱子的连续纯化技术进行捕获和纯化、TFF进行浓缩和透析、以及病毒去活化、病毒过滤、无菌过滤等步骤,利用过程分析技术即时监控产品质量,最后产出药物原液。
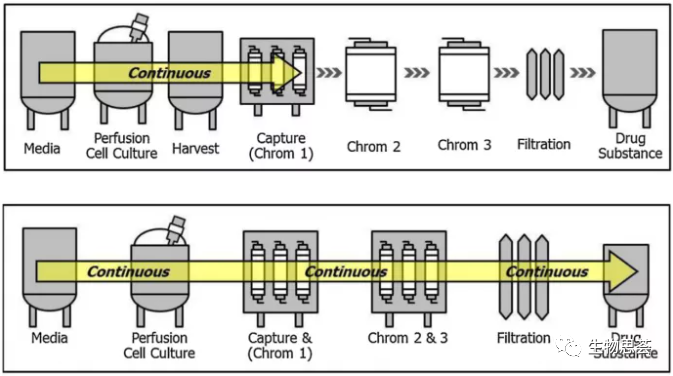
批次生产与连续生产对比图
现在能够利用上游灌流式培养将生物反应器与下游2个PCC单元结合,可以做到捕获和下一步的离子交换纯化步骤,虽然不是完全的连续式生产,但使得完全式的连续式生产的开发又更进一步。这套连续式系统,包含了一个12L生物反应器、ATF、和2个PCC系统,其中PCC系统是定制化的AKTA层析系统,最多可以用4根柱子,搭配了5个UV监测器,3个泵、多个阀、和酸碱度及电导度仪。如下图。
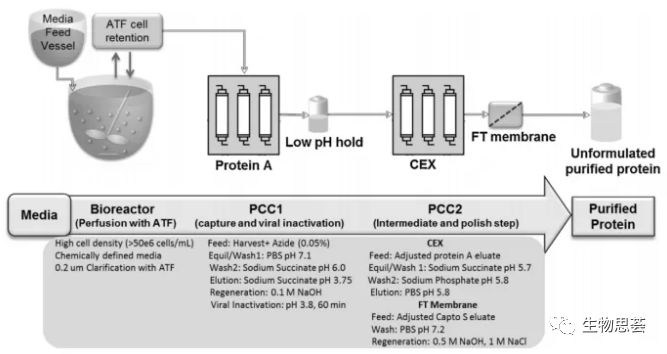
这套系统一共连续运行了31天,产出31个原液批次(以时间定义批次,一天一批次),抗体的产率约为10g/day(CHO细胞),并且持续送往亲和性管柱和离子交换管柱进行纯化,最后原液约为8g/day (回收率约为80%),循环时间从澄清的收获液到原液约为7小时。
连续式下游纯化的结果与用批次纯化的方式具有可比性,宿主细胞蛋白清除约4log,残留protein A小于1ppm,聚集体的比例小于5%。关键产品特性也符合指定规格与批次纯化也具有可比性。此套系统证明连续式生产的产品与用批次生产的产品皆能符合产品规格,此外,与批次生产的工艺相比,此连续式工艺,上游产率超过10倍,下游纯化超过6倍,缓冲液的使用和层析柱尺寸也有明显降低。
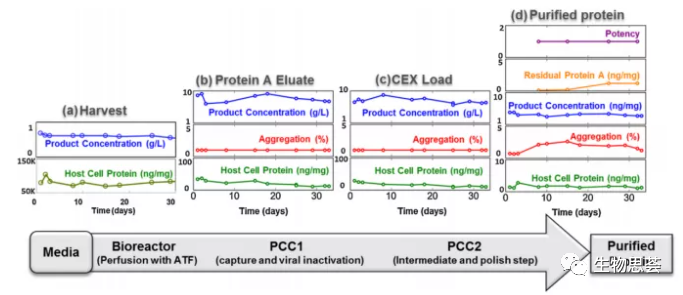
31天内工艺性能指标和原液关键质量属性(a)细胞培养收获、(b)蛋白A洗脱液、(c)阳离子交换(CEX)负载、(d)纯化蛋白质与聚集和残余蛋白A相关的变异性是由于未优化的Q膜操作造成的。这些趋势在相应的批量和连续操作结果均在分析变异范围内。
连续多柱层析具有诸多优势,在许多行业中将批处理转化为连续处理已经取得成功,但其在生物制剂生产中的应用目前相对慎重。主要原因是从批量生产转向连续生产过程中的监管要求的不确定性导致。
其次,对比批次处理,从经济角度来看连续处理的优势明显,它能在更短的加工时间内提高生产率,同时降低总成本,减少设备占地面积并保证产品质量。
但是,连续处理的操作和过程控制复杂,而且连续系统的初始设备成本及维护成本较高,普遍适用性较低,通常只针对特定的产物有较好分离纯化效果。因此连续技术的广泛应用仍面临巨大挑战。
连续技术可有效降低生物制品的下游纯化成本,提高生产效率。未来想进一步降低生物药物的开发成本,可在连续模式的基础上对下游纯化工艺中的核心技术“层析”进一步优化或者开发新型技术。
随着生物药品全球销售额的增加,卖的最好的药都是来自于生物药工艺,加上生物相似药的竞争,价格会是未来生物药的决战点,而成本决定了药品的价格,如何提升产量、降低成本则成为生物制品开发的重点,根据模型计算,整合式连续生产工艺可以比传统批次生产工艺降低约55%的成本,显示整合式连续生产有机会能同时达到高产量和低成本,而接下来会着重于如何整合上游和下游工艺,从细胞培养开始到原液产出,密闭式系统和使用一次性产品,减少污染,加入自动化操作,减少人为因素,实时监控生产过程,完整的风险控制策略,以及法规单位的考量等等。






