根据我国2007年出台的《药品注册管理办法》界定,新药是指没有在中国境内上市销售的药品。2016年国家药品监督管理局《关于发布化学药品注册分类改革工作方案的公告》中,将化药新药分为创新药和改良型新药,创新药是指含有新的结构明确的、拥有药理作用的化合物,且具有临床价值的药品。2020年国家药品监督管理局《生物制品注册分类及申报资料要求》,将治疗用生物制品(生物药)分为创新型生物制品、改良型生物制品和境内或境外已上市生物制品。
相对于大分子药物,小分子药物是拥有单一明确有效成成分、分子量在1000道尔顿以下的有机化合物分子。广义上讲,当前临床上使用的大部分化学药品都是小分子药物。随着生命科学与生物技术的快速发展,单克隆抗体、重组蛋白、基因与细胞治疗等具有较大分子量的治疗用生物制品在市场中的份额越来越大,但化学药仍然是药品开发中的主角。和大分子生物药对比,小分子药物有着分子量小、不涉及免疫原性、易吸收、工艺成熟、可穿透细胞膜、易于储存和运输等优点。
第1阶段:1860s-1960s
随着生理学和化学工业的兴起而诞生化学合成药物有明确的结构和治疗效果药物发现主要依靠经验。代表∶抗生素、盘尼西林。
第2阶段:1960s-1990s
随着分子生物学和细胞生物学的兴起,针对特定病理、生物机制和生理效应而开发的化学药物。有明确的结构和作用机制,可针对病因寻找新药。代表:抗炎药,诺氟沙星。
第3阶段:21世纪
随着生命科学研究深入到基因层面,可针对—个生物机理相对明确的“靶点”,筛选得到可以调节该靶点的化合物,进开发出的化学成药物。药物有明确的结构、作用靶点和机理,可针对靶点开发新药。代表:伊马替尼(格列卫)。
化药创新药在完成临床前研究后可申请临床试验(IND),以开展Ⅰ期~Ⅲ期临床试验。

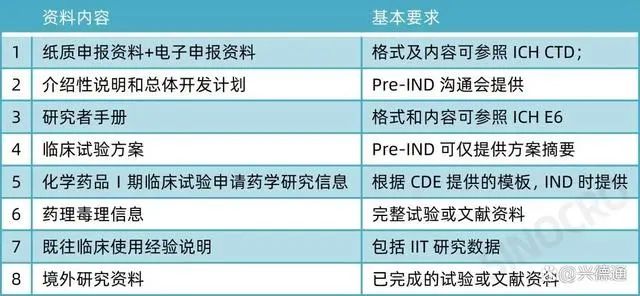
来源:NMPA《新药I期临床试验申请技术指南》2018年第16号)
1. pre-IND会议
递交新药临床试验申请前,申请人可按照《药物研发与技术审评沟通交流管理办法》所规定的要求与工作程序提供沟通交流会资料,向药审中心提出沟通交流会申请。沟通交流资料主要包括药品基本信息、开发计划、所需沟通交流问题的背景和数据,并提出拟解决问题的建议和想法等。
如药审中心与申请人召开了Pre-IND会议,IND申报时需要提供沟通交流会议相关资料,包括会议申请资料、会议纪要、药审中心的各种反馈信息(含来往邮件截图或书面反馈)以及根据会议纪要的完成情况。
2. 建立药物警戒及质量管理
《药物警戒质量管理规范》要求:与注册相关的药物临床试验期间,申办者应当建立药物警戒体系,药物警戒体系及质量管理可参考上市后相关要求,并可根据临床试验期间药物警戒要求进行适当调整。
申请人是临床试验期间药物警戒责任主体,根据工作需要可以委托受托方(如CRO公司),依托受托方(如CRO公司)的药物警戒体系及系统开展药物警戒活动,但相应法律责任由申请人承担。
3. 伦理审查
《药品管理法》规定开展药物临床试验的前提是取得临床试验默示许可与伦理审查,现行法规并没有规定两者的先后顺序,因此临床试验申请IND可与伦理审查并行,这将为申办者节省时间,有助于加速临床试验的开展,加速新药上市。
(参考《化学药品创新药I期临床试验申请药学共性问题相关技术要求》)
1. 避免简单提供样品试制信息
常出现的共性问题:提供的样品试制信息非常有限,处方工艺信息(特别是涉及复杂原料药或者复杂制剂时)过于简单。
2. 避免简单提供质量标准和分析方法
常出现的共性问题:仅简单提供质量标准,缺少提供部分关键项目的分析方法、未提供关键项目分析方法必要的验证信息。
3. 避免缺少杂质谱分析或者分析过于简单
常出现的共性问题:未进行杂质谱分析或者分析过于简单,缺少对生产过程中用到的有毒有害试剂、金属催化剂等残留杂质的汇总分析。样品中的杂质记录不够详细,提供的检验信息中仅简单说明合格、未提供具体检测数据。未分析说明杂质限度拟定的初步依据。
4. 避免缺少致突变杂质分析
常出现的共性问题:未进行致突变杂质分析,或者对于潜在的致突变杂质仅凭经验简单分析和界定为不具有致突变性。仅说明致突变杂质含量符合要求,未提供具体的分析方法以及必要的方法学验证信息、检测数据等。
5. 避免提供不足以支持药品质量的、非常有限的稳定性试验信息
常出现的共性问题:提供的稳定性试验信息非常有限,不足以支持药品质量在计划的临床试验研究期间符合要求。对于注射剂以及一些具有特殊使用要求的制剂,未提供临床配伍稳定性的研究资料。
6. 避免不说明临床试验中安慰剂的拟使用情况
临床试验方案中需使用安慰剂,应提供安慰剂的生产厂、处方工艺信息(如适用)、质量控制等研究资料。同时,安慰剂需进行必要的稳定性试验考察(如微生物限度、无菌)。
7. 避免未提供辅料和包材资料
使用全新的辅料和包材时,需提供相关的研究资料。
按照其靶点类型和作用机理,已上市的小分子靶向药物可分为激酶类抑制剂、表观遗传类抑制剂和蛋白酶体类抑制剂三种。
1、激酶类抑制剂
蛋白激酶的失调与癌症、自身免疫性疾病等具有极大的相关性,是最为广泛的疾病治疗靶点,已有大量的蛋白激酶抑制剂被报道。已上市的小分子创新药物中,80%以上是激酶类抑制剂。包括受体酪氨酸激酶抑制剂、受体酪氨酸激酶抑制剂和丝氨酸/色氨酸激酶抑制剂三个类别。
2、蛋白酶体类抑制剂
蛋白酶体是一种大型的多催化酶复合物,在所有真核细胞的细胞核和细胞质中表达,负责人类细胞中超过80%的蛋白质降解。泛素-蛋白酶体系统(UPS)在细胞存活、信号转导、DNA修复和抗原呈递等多个维持细胞蛋白稳态和调节许多生物过程中具有重要作用。UPS的功能障碍与多种人类疾病有关。
3、表观遗传抑制剂
表观遗传学是遗传学的一个分支学科,研究在不改变基因核苷酸序列的情况下基因表达的遗传变化,受到各种化学修饰酶和识别蛋白的严格调控。
异常的表观遗传调控与肿瘤、免疫性疾病和许多罕见疾病等密切相关。虽然许多表观遗传调控蛋白已被确定为潜在的疾病靶点,但目前批准临床使用的表观遗传药物较少,可能是未来小分子创新药研发的方向。
在生物大分子药物快速崛起的当下,小分子药物虽受冲击但仍是药物研发的主要方向。2021年全球药企财报显示,销量前十的药物中除去两款新冠疫苗,小分子药物仍占据半壁江山。
小分子药物主要是指化学合成药物,是由化学合成或从自然物质提纯而来。小分子药物具有使用广泛、理论成熟等优势,在常用药物中占据98%。本文梳理小分子创新药IND申报要点,以供参考。
1. 非临床研究综述
遵循药物非临床研究质量管理规范(GLP)的声明。系统呈现动物毒理研究及毒代动力学结果,应特别关注可能危害人体安全的信息。
2. 药理学研究
新药的药效学研究应采用公认的体内外试验系统和指标来开展,尽量采用更新的体内模型来开展作用机理相关的有效性研究,并提供药效与暴露关系的研究信息。
3. 毒理学研究
毒理研究结果评价应关注毒性反应相关性的逻辑评价,并说明外推人体的风险预测。I期临床试验申请递交时须获得各研究的最终毒理学报告。
4. 药代动力学
应阐述分析方法的可行性。具体见非临床药代动力学技术研究指导原则。
如已有人体研究,应提供非临床药代动力学研究中动物和人体的代谢和暴露量。
申请者开发创新药时,通常会选择委托注册申报经验丰富的CRO协助撰写整理IND以及NDA申请材料,甚至将药物警戒委托给业内已有成熟药物警戒体系和系统的CRO。
由于药品创新研发具有投入多、周期长及风险高等特点,过去,我国的医药行业一开始是以仿制药物为主,伴随着创新药审批、医保加强控费等政策出台以及经济快速发展带来创新药市场化提速,创新药在医药市场结构的比重逐渐加大,我国也正在经历“仿制药-难仿药-同类最佳-同类首创”的转变与突破。
据公开数据统计,2017年-2021年,中国创新药行业市场规模从1178亿美元增长到1455亿美元,年复合增长率为5.42%。中国创新药前景巨大,占医药市场的比重将明显提升。预计2022年中国创新药的市场规模将达到11484亿元
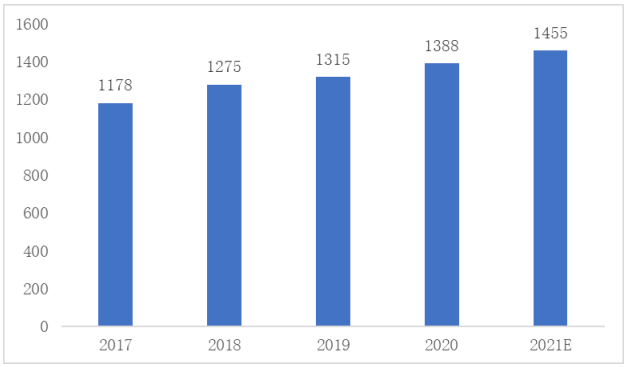
图1 2017-2021年中国创新药市场规模及预测(单位:亿美元)






