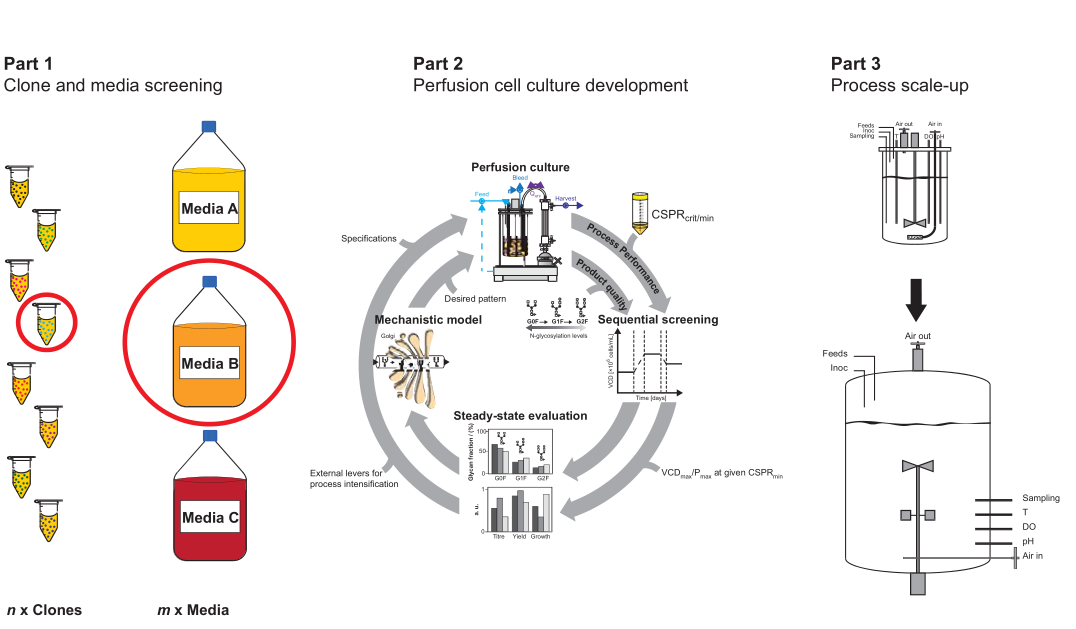
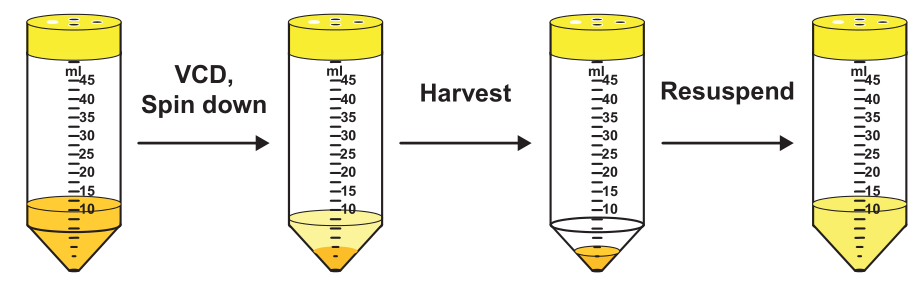
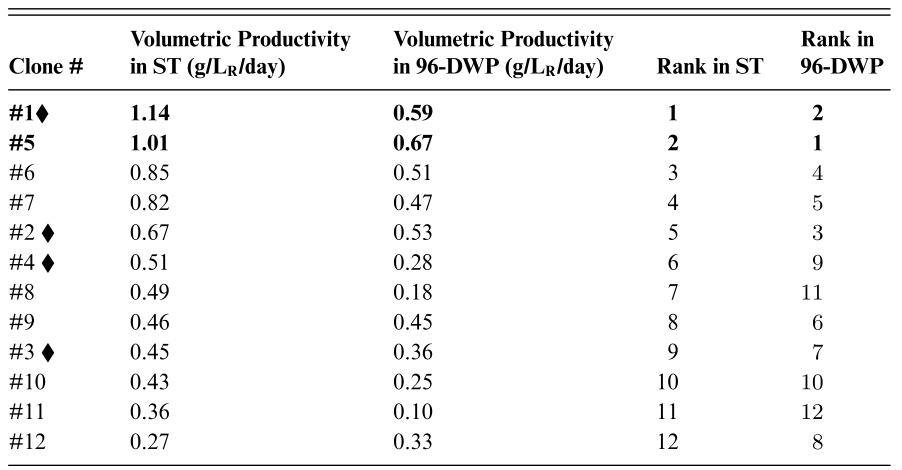
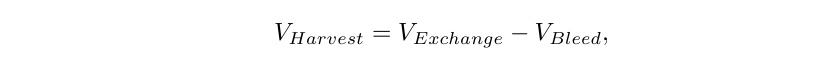对于一个新的商业化项目,perfusion工艺开发包括了多个步骤,细胞培养体积从微升到L规模实验室反应器,最终放大至上千升反应器。上述步骤的基本概念如下图所示:克隆和培养基筛选、灌流工艺开发和工艺放大,每一个步骤均有各自的目标,需要应用不同的技术手段。1 克隆和培养基筛选;2 灌流细胞培养培养;3 工艺过程放大通常,在工艺开发的初始阶段,有来自于Cell line工艺开发的数百个克隆,可以结合多种培养基表达目标蛋白。该步骤的目标是,筛选出两三个或更多的克隆,一两个或更多的基础培养基成分,以继续进行下一步的工艺开发,该步骤考察的参数是细胞的产率和生长速率,并没有考虑产品的质量和灌流工艺条件下的稳定性,这两点需要借助高通量的技术和微型反应器(μL)进行实验研究。该步骤最常用的研究方式是最常用的方式是使用缩小模型,涉及的反应器通常是针对批次或补料分批操作,并不是最适合模拟perfusion操作的,因此考虑使用半连续操作的高通量反应器设备。确定了克隆和培养基后,需要确定灌流工艺的稳定操作条件:最大化灌流速率PR和最小化培养基消耗MC,最终的结果是确认最合适的VCD和灌流速率,产品收率不需要明确考虑,bleeding速率和μ保持一致,更高的PR代表更高的Y,在升级别的反应器执行这些实验,效率低成本高,需要更合适的缩小模型。如果反应器上的细胞培养表现不佳,需要返回来重新考虑一些已经确定的操作条件,例如系统的温度和会改变体系状态的化学添加剂,需要重新对反应器操作条件进行设计;当产品质量不能满足要求,例如N-糖基化,需要重新设计合适的补料添加剂然后重复反应器设计步骤。第三部分的目标是将在台式生物反应器规模开发的工艺转移到更大的临床和商业生产规模。这意味着反应器(如果需要)和辅助设备的大小和形状,以及相应的操作条件需要改变,以重现在实验室规模获得的工艺表现和产品质量属性。这一步并不会去优化工艺参数,为了进行成功的工艺放大,反应器需要确保充分的混合、传质和合适的剪切力环境。Cell line的开发从表达载体转染到宿主细胞开始,感兴趣的外源基因随机整合在染色体上,产生了具有不同生长和蛋白质表达特性的克隆pool。重组蛋白表达水平高且稳定的克隆是首选,然而,在转染的细胞中,只有少数克隆是高表达的,因为蛋白的表达依赖于重链和轻链抗体片段基因的完全整合,由于宿主细胞染色体中支持高基因表达的活性区域完全整合概率很低,选择合适的克隆是一项关键且特别费力的步骤。高表达的克隆通常表现出较低的生长速率,因为细胞内部大多数资源用于蛋白质表达。因此,有必要对大量的克隆进行筛选,以便有很好的机会找到少数具有良好细胞生长特性的高产克隆。这一步骤需要高通量平台,以便同时测试和筛选大量克隆和培养基。如前所述,选择标准完全基于克隆的生长速率和产率。从经验上看,无论是最终工艺时Fed batch还是perfusion,克隆和培养基的筛选都是在batch模式下进行的。采用有限稀释法筛选高表达克隆,从而模拟批次培养模式。然而,最适合Fed batch的克隆和培养基可能不是最适合perfusion的。例如,为了在接种后短时间内积累大量细胞,Fedbatch过程需要快速的细胞生长速度,以便这些高表达克隆在生产阶段产生尽可能多的表达蛋白。而另一方面,perfuison工艺稳态生产阶段需要保持恒定的VCD,但是高生长速率导致高bleeding,因此,导致较低的产物收率Y;此外,较高的细胞生长速率导致了更高的细胞代数,在perfusion长时间运行时,细胞稳定性降低。因此,对于perfusion,稳定的细胞生长速率和较高的细胞表达水平比获得最高产品滴度和细胞密度更为重要。综上所述,我们需要高通量筛选设备,可以模拟perfusion过程,并能够长时间运行,以测试感兴趣的克隆的长期稳定性和产率。高通量系统最重要的是可以模拟perfusion工艺,有两种方式:非稳态和稳态操作,在非稳态perfusion中,没有cell bleeding,VCD按照特定μ持续增加,该方式中只有培养基的添加和无细胞培养液的收获;稳态操作过程需要cell bleeding,以便维持恒定的VCD。缩小模型的高通量系统可以在nL、μL或mL水平操作,允许同时并行操作多个克隆和培养及组合,这部分内容在第3章中介绍过,以下是以深孔板和摇管为例的克隆筛选过程,最终在台式反应器上进行了结果验证。实验以半连续培养形式进行,也称为VCDmax实验,在固定的培养基交换速率下进行换液操作。该实验包括每日活细胞计数、培养基和细胞分离、去除无细胞上清、新鲜培养基替换,整个过程不需要额外的细胞去除。通过每天重复这一过程,细胞浓度会逐渐增加,直到达到最大值-即在给定灌注速率下可维持的最大活细胞密度(VCDmax)。根据深孔板和摇管两种系统中测定的体积产率对不同克隆进行排名。下一步,选择其中的4个克隆在台式生物反应器中(3.5L工作体积)验证,为保证不同克隆间具有足够的多样性,选择的克隆包括:1个克隆在半连续实验中生长速率较高(VCDmax高),单克隆抗体滴度高;1个克隆生长速率较低(VCD max低),单克隆抗体滴度低;3个克隆生长速率较高,但抗体滴度较低;4个克隆生长速率较低,但抗体滴度较高。深孔板和摇管两种比例缩小系统的结果均可以在台式反应器上得到验证:台式反应器perfusion稳态条件下的CSPRmin和表达水平与缩小模型VCDmax实验得到的结果相似。
以上的实验研究展示了缩小模型在克隆/培养基筛选上的应用,此外,VCDmax实验允许对CSPRmin进行初步估计,但另一方面,并不能对克隆进行稳定性测试。⿻ 2 细胞培养灌流工艺的开发
确定了克隆/培养基组合后,在升规模条件下perfusion稳态条件下的最佳操作条件:目标是产率最大化(g蛋白/L/天)和培养基消耗最小化(L/g蛋白)。在L水平进行的perfusion实验需要消耗大量的培养基:例如2 L反应器中以1 VVD的速率运行30天,需要60 L的灌流培养基。如果考虑到为了确定最佳操作条件而必须进行的实验数量,时间和培养基成本都会显著增加,因此需要使用在μL或mL尺度上操作的等比例缩小模型。常规的反应器perfusion工艺优化步骤包括1:确定CSPRmin;2:确定给定CSPRmin下的最佳P(或VCD)。对于一个给定的克隆和培养基,CSPRmin和产率是受限的。如果需要进行进一步的反应器上工艺优化,3 给定的CSPRmin条件下,细胞生长速率μ仍然很高,导致bleeding中产物损失较大,为了提高收率,可以通过改变操作条件来抑制细胞生长。4:产品质量问题,特别是对于生物类似药,它必须与所需的产品质量保持足够相似,可通过引入适当的补料成分来进行调节。在3和4步骤时,灌流速率和活细胞密度的设计过程都需要重复,从而产生如下图所示的迭代过程,当灌流培养的各个方面都已达到预期时,迭代过程就结束了。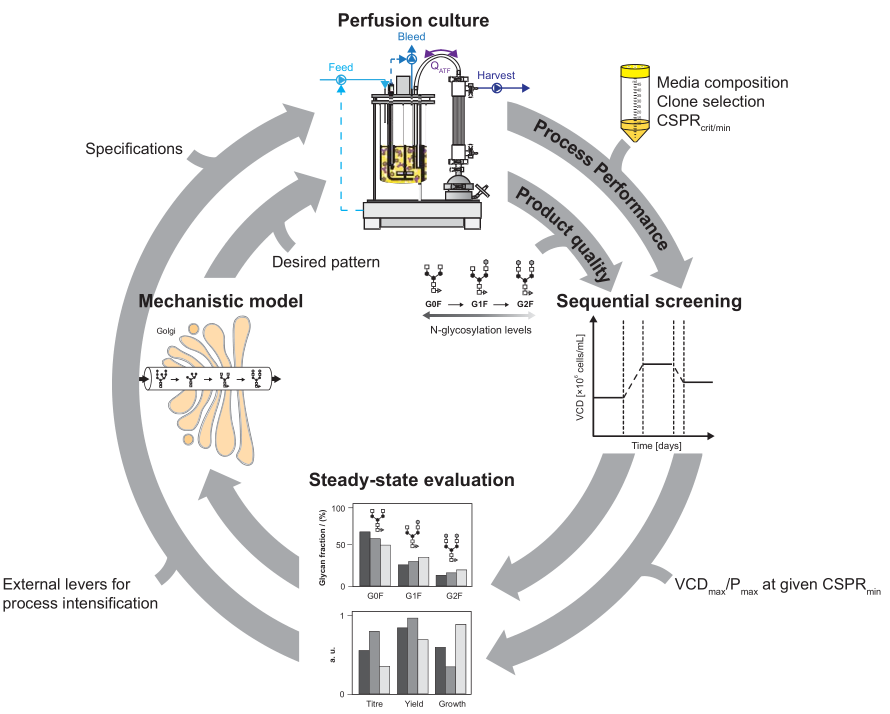
▲反应器perfusion工艺开发步骤:1确定CSPRmin;2 优化获得最大体积产率;3 产物收率的优化;4 产品质量的调节。以上步骤循环操作已达到最佳反应器操作。
CSPRmin的确定:作为整个灌流工艺开发的第一步,由于对表达系统了解较少。通过应用Push to low/Push to high的方法可以最小化CSPR(参见前文),在升尺度下,实验需要非常长的时间和消耗相应数量的培养基,因此需要在mL或μ L尺度下的按比例缩小模型。VCDmax实验参考第一章节中相应内容,通过该试验可以评估克隆和培养基所能达到的最小CSPR,需要注意的是,该实验不包括bleeding操作,因此不能评估perfusion运行的的长期稳定性。因此,该实验得到的最小CSPR称为临界CSPR:CSPRcrit,与CSPRmin不同。例如在VCDmax实验中VCDmax = 27.5M ,但在反应器水平上长期运行时,VCD最高维持在20M;建议不要仅依靠这种小规模的实验来确定CSPRmin,而是在恒定存VCD的情况下,通过长期稳定性实验在更大体积水平上进行验证。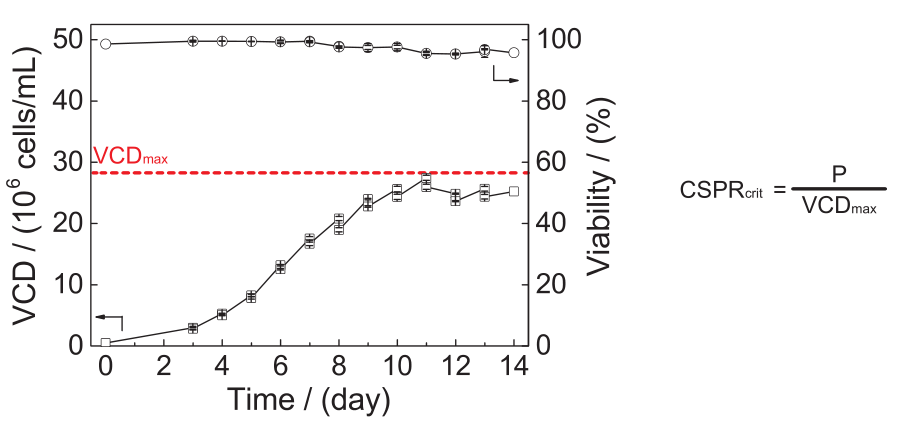
▲缩小模型中的VCDmax实验设计及结果图
2.2 毫升尺度的稳态VCDss实验
评估完VCDmax和CSPRcrit后,就需要确定CSPRmin—稳定培养条件可以长时间内运行的最小可持续CSPR。如前所述,CSPRmin值≥CSPRcrit,可以将CSPRcrit作为实验的起点,在升水平的生物反应器或者缩小模型中进行研究。缩小模型的稳态实验与VCDmax相似,但有两个显著的区别。首先是以较高的细胞密度接种(接近目标VCD);其次是为了在恒定的VCD下操作,引入了cell bleeding步骤,用保持VCD恒定在预定义的目标值(XV)附近,细胞取样计数后的bleeding量计算如下: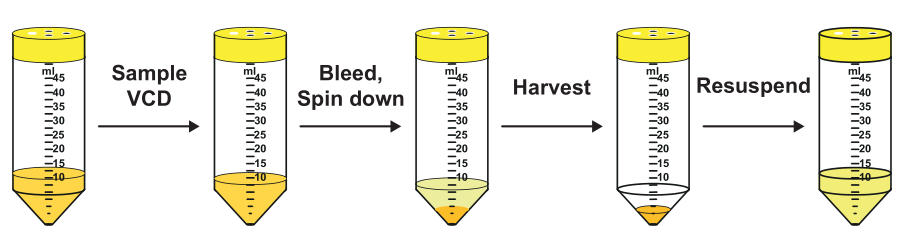
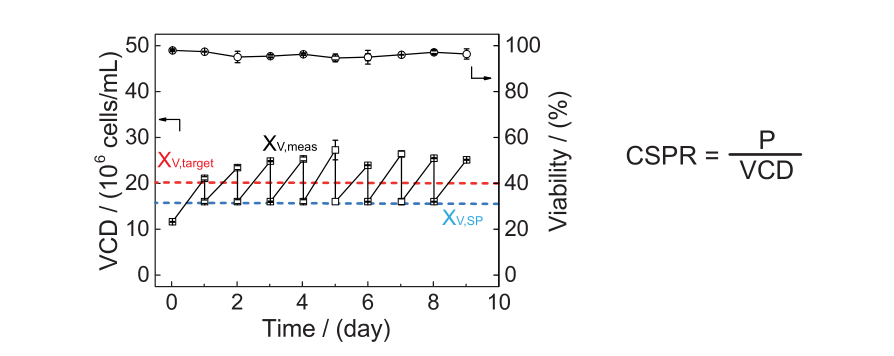
▲缩小模型中的稳态实验设计及结果图
对以上的该模型与在类似VCD和灌流速率下运行的台式生物反应器实验结果进行了比较,如下图所示:相同的VCD预期条件下,两个系统中的bleeding和收获率、谢产物的消耗、细胞特生长速率、滴度、目标产物的电荷异构体等表现出一致的趋势。对于乳酸和产物糖基化的差异,可能是由于缩小模型中较小的气液传质速率导致CO2去除和溶解氧水平降低导致:缩小模型中气液传质是通过滤器进行的,效率低于台式生物反应器中使用的气体分布器,这导致了缩小模型中的酸性条件,细胞通过产生较少的乳酸来保持平衡,以保持pH值在可接受的水平;在糖型分布方面,由于缩小模型中DO控制较差,溶解氧浓度较台式反应器系统低,较低的DO水平会影响抗体的糖基化。
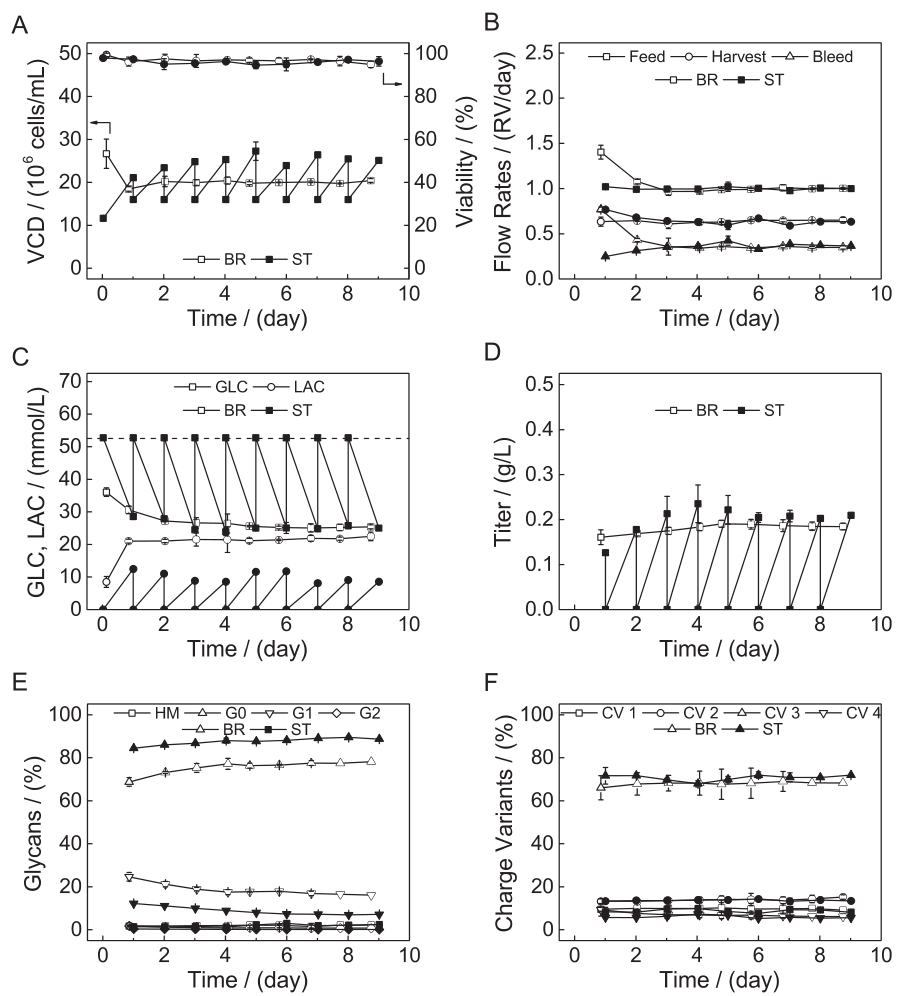
▲缩小模型和台式反应器中进行稳态灌流实验比较
A:VCD设置点为20M,VCD和活率;B:液体置换速率;C:葡萄糖和乳酸浓度;D:产品滴度;E:N-糖基化;F:电荷异构体。
综上所述,可以将前面所述的VCDmax与VCDss实验结合起来,首先估计一个合适的VCDmax和相应的CSPRcrit,然后以此为起点进行CSPRmin进一步研究。这种方法在实践中非常有利,因为简单的VCDmax实验很容易提供关于所选表达系统(克隆和培养基)在给定灌流速率下表现得初步评估,因此特别适合于筛选应用,这个实验的结果是CSPRmin的初步评估,称为CSPR临界值,CSPRcrit需要进一步研究,例如使用台式生物反应器,以获得与长期稳定性相关的CSPRmin。