高浓度蛋白制剂(HCPF):通常指蛋白浓度在50-150mg/ml的制剂;
HCPF通常表现出:粘度增加、高乳光、溶质浓缩和相分离现象、形成蛋白聚集颗粒、产生胶状物质等;
低浓度蛋白制剂通常表现出和安慰剂相似的特性;
HCPF的一些特性对开发冻干药物产品提出了特别的挑战;
本系列文章将涵盖这些方面,讨论潜在的挑战及解决方案.
我们为什么要开发高浓度蛋白制剂?
像单克隆抗体这样的生物制剂,每公斤病人体重几毫克的非常高的给药量,使得我们需要将足够的蛋白剂量“溶解”在这么小的体积中。
高浓度蛋白处方,什么是高?
术语HCPF主要用于单克隆抗体处方,描述高蛋白浓度的处方。
单克隆抗体50-150mg/ml;
多克隆抗体150-200mg/ml
都属于很有挑战性的蛋白浓度,因为分子非常大,流体力学直径可以达到10nm
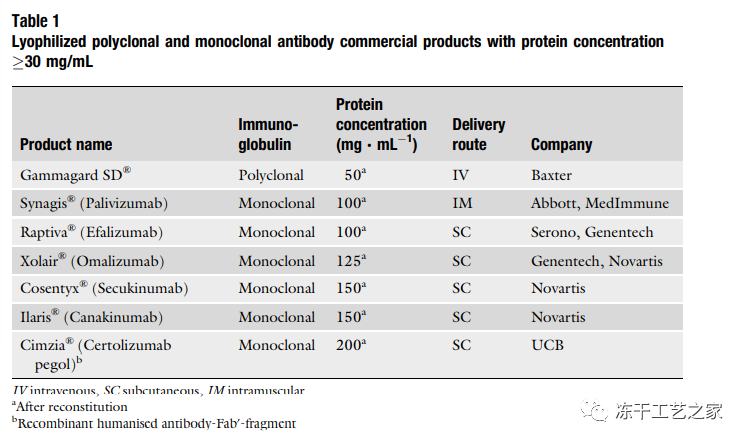
表一:蛋白浓度>30mg/ml的商业化单克隆和多克隆抗体产品

表二:蛋白浓度>30mg/ml的单克隆、多克隆抗体产品处方
开发高浓度蛋白制剂的挑战
溶解度?(一定的温度、压力下,动力学、热力学的溶解度)
粘度: 随着蛋白质浓度的增加,溶液粘度线性或指数型增长 UF/DF?
浊度,乳光颜色:随着蛋白质浓度的增加,蛋白溶液的乳光和颜色也会增加
分析和表征 (稀释步骤?)
蛋白质的物理化学性质(蛋白质溶解度、蛋白质水合、胶体和结构稳定性以及溶液性质)
高浓度蛋白制剂(HCPF)的冻干
HCPF 冻干制剂和非冻干制剂对蛋白聚集的影响:
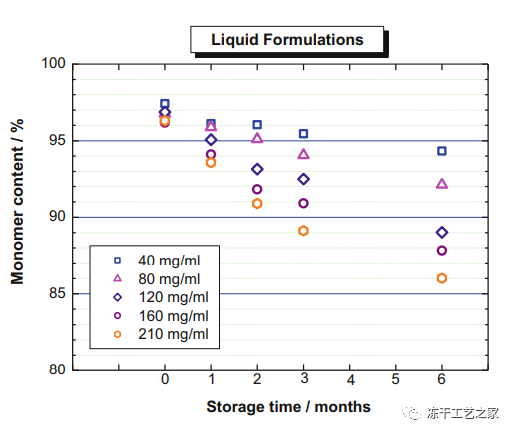
图一:液体配制的单克隆抗体制剂(220mM蔗糖、10mM琥珀酸盐、0.04W%吐温80、pH 5.5、小瓶、1型玻璃)在不同蛋白质浓度下在40℃下的稳定性研究
单体减少通过HPSEC(高效排阻色谱法)进行评估
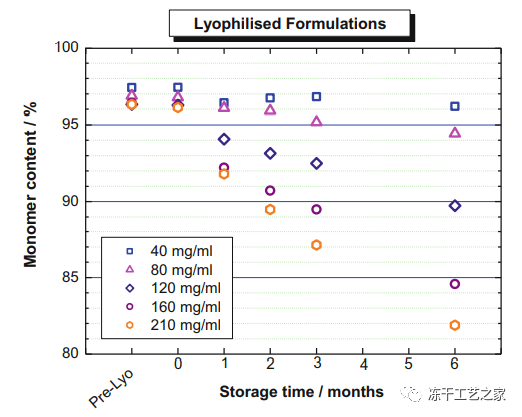
图二:冻干单克隆抗体制剂(220mM蔗糖、10mM琥珀酸盐、0.04w%吐温80、pH 5.5、小瓶、1型玻璃)在40℃下不同蛋白质浓度下的稳定性研究
单体减少通过HPSEC(高效排阻色谱法)进行评估
液体制剂:在40℃条件下做加速实验6个月,蛋白质浓度在40至210毫克/毫升之间变化;
图一显示了作为时间和蛋白质浓度函数的单聚体含量的减少;
蛋白质浓度越高,聚集体形成越快,单体含量下降越大——这是一个常见的观察结果。
冻干制剂:冻干后产品在40℃条件下做加速实验6个月;
对于80–120 mg/mL浓度区间的蛋白质,单体含量随着时间的推移比在相应的液体制剂中下降得更慢(比较图一和图二);
然而,对于高于160 mg/mL的蛋白质浓度,冻干样品中的单体分数降低随着时间的推移比相应的液体制剂中的下降更快;
此结果的原因有待进一步的研究来确认;
高浓度抗体的冻干工艺开发,主要有三个特点:
塌陷温度更高(Tc)
塌陷温度(Tc)和玻璃态转变温度 (Tg')之间,有很大的区间;
复溶时间更长
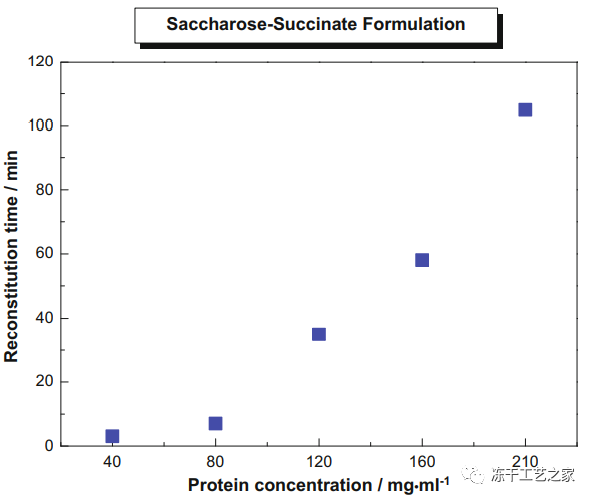
图三:蛋白浓度范围为40-210 mg/mL的冻干单抗处方的复溶时间
所有冻干物用5ml注射用水重新配制,并在25℃下轻轻摇动(200–250rpm),直到饼状固体完全溶解
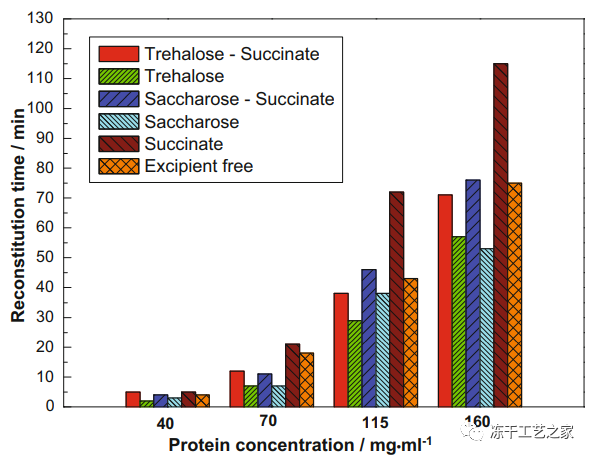
图四:40-160mg/mL蛋白质浓度范围内冻干单抗制剂的复溶时间
所有冻干物用5ml注射用水重新配制,并在25℃下摇动(200–250rpm),直到饼状固体完全溶解。
使用秒表测量重建时间
赋形剂浓度:海藻糖:220mM,琥珀酸盐:20mM,蔗糖:220 mM
外观:开裂

图五:蔗糖琥珀酸盐单抗冻干制剂在20R小瓶进行目视检查
随着蛋白质浓度的增加,会形成更大的裂缝和蛋糕碎片
接下来,我们会分为三篇文章逐一讨论这些特点,以及遇到有那些可以尝试的解决方向。
本篇文章作为开头,讨论一个最简单的特征:塌陷温度更高
关键温度(Tc、Tg’)
蛋白浓度越高,塌陷温度 (Tc)越高;
蛋白浓度越高,Tc和Tg’之间的空间越大;
所以,对于HCPF,除了Tg’以外,测量产品的Tc非常重要。
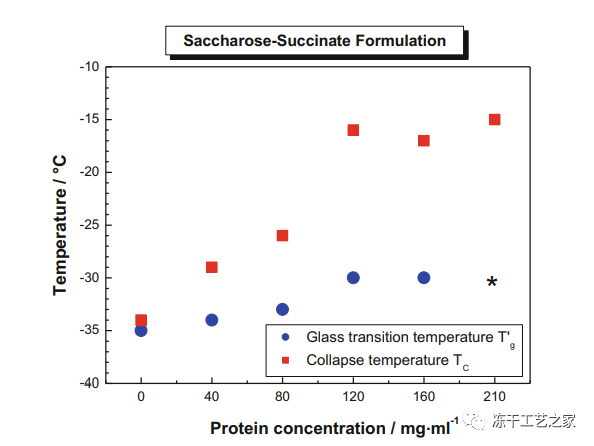
图六:不同蛋白浓度的蔗糖琥珀酸盐处方 Tg’、Tc数据
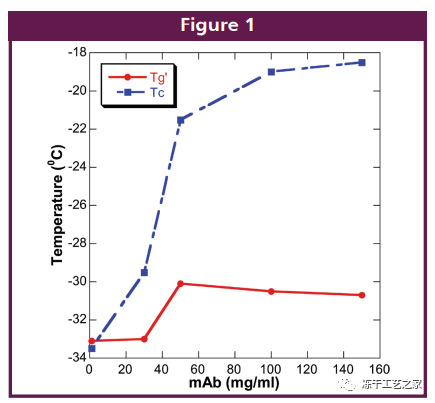
图七:不同蛋白浓度处方Tg’和Tc数值的差异
对于HCPF,我们非常有机会在Tg’之上开发出超短时的冻干工艺;
最后的话
本篇文章开启了HCPF制剂和普通低浓度抗体产品相比,在冻干工艺开发上的一些特征的讨论;
接下来会再写两篇,分别讨论:HCPF的复溶时间、粉饼开裂两个问题;
影响复溶时间的因素非常复杂,对于最终产品为部分结晶或者完全的无定形处方,其影响因素和需要特别设置的冻干条件都非常不同;
“缩短复溶时间” 将是一篇很长很大的文章,目前正在整理中;
最后也许再补充一篇:高粘度样品的灌装解决方案;
这样,高浓度抗体(蛋白)处方产品冻干工艺解决方案系列,算是完成;
TELSTAR中国冻干工艺实验室,也已经完成了几个高浓度抗体的冻干工艺开发,如有需求可扫描以下 二维码 联系实验室。
参考文献:
(1) Constantino HR, Pikal MJ (2004) Lyophilization of biopharmaceuticals. AAPS Press, Arlington, pp 1–686
X.Liao, R. Krishnamurthy, R. Suryanarayanan, influence of the active pharmaceutical ingredient concentration on the physical state of mannitol implications in freeze-drying , Pharmaceutical Research 22 (2005) 1978-1985
(2) Varshney D, Singh M (eds) (2015) Lyophilised biologics and vaccines modality-based approaches. Springer, New York, pp 1–401
(3) Lyophilization Strategies for Development of a High-Concentration Monoclonal Antibody Formulation: Benefits and Pitfalls Akhilesh Bhambhani, Ph.D. and Jeffrey T. Blue (2010)
(4)Patrick Garidel and Ingo Presser . Lyophilization of High-Concentration Protein Formulations
(5) Patrick Garidel and Ingo Presser Lyophilization of High-Concentration Protein Formulations (2018)






