腺相关病毒 (AAV) 已被很好地表征,并被用于为临床和基础研究中的疾病治疗递送治疗性基因。本研究使用 AAV-DJ/8 三质粒瞬时转染作为模型表达系统,开发和优化用于研究和临床前应用的AAV 实验室生产。具体来说,研究测试了各种生产参数,包括宿主细胞、转染试剂、细胞密度、质粒DNA与细胞的比例、基因大小和生产模式,以确定最佳工艺。我们的结果表明,使用 HEK 293AAV 和钙转染的贴壁生产产生了 7.86 × 10^9 gc/ml 的最高单位体积生产力。在转染密度为 0.4 × 10^6 cells/ml、质粒 DNA:细胞比为 1.6 μg:10^6 cells的转染条件下,以及以阳离子脂质体作为转染试剂的转染条件下,使用 HEK 293F 的最佳悬浮生产在无血清培养基中获得了 5.78 × 10^9 gc/ml 的最佳 AAV 生产力。在摇瓶和/或转瓶中以 30 - 450 ml 的规模证实了类似的 AAV 生产力。分别使用细胞系和移植瘤小鼠模型证实了收获的、携带荧光素酶报告基因的 AAV-DJ/8 的体外转染和体内感染效率。在本研究中观察到 AAV-DJ/8 在离子交换层析柱和亲和柱中的回收率较低。总之,我们开发并优化了 AAV 的可放大悬浮生产,以支持研究实验室中的大规模临床前动物研究。
腺相关病毒 (AAV) 是一种小型 (20 nm)、复制缺陷型、非致病性细小病毒。最大为 4.8 kb 的单链 DNA (ssDNA) 基因组包裹在无包膜衣壳中。数百种血清型和变体已被分离和鉴定,它们可以感染人和其它动物不同组织的分裂和非分裂细胞。Kay、Samulski 和Schaffer通过 AAV2、8 和 9 的衣壳进化构建了嵌合 AAV,例如AAV-DJ,以向多种细胞类型递送治疗性基因。
AAV具有作为基因递送载体的巨大潜力,因为它具有免疫原性低、长期转基因表达、无临床不良事件报告、稳定性高以及可感染的细胞类型范围广等多重优势。欧洲药品管理局 (EMA) 于 2012 年批准了首个基于 AAV 的基因疗法,用于治疗脂蛋白脂肪酶缺乏症,美国食品和药物管理局 (FDA) 分别于 2017 年和 2019 年批准了Luxturna 和 Zolgensma,用于治疗罕见的遗传性失明和脊髓性肌萎缩症。目前,有 300 多项正在进行的临床研究,用于治疗多种疾病或病症,例如阿尔茨海默病、帕金森病、囊性纤维化、B 型血友病、HIV 感染、莱伯氏先天性黑蒙、关节炎和癌症。除了临床应用外,AAV 还是一种重要的研究工具,可以为基础研究提供报告基因、CRISPR 核酸内切酶或其它基因。
由于 AAV 在基础研究和临床前转化研究中的广泛应用,因此非常需要开发一种稳健、可放大且符合良好实验室规范 (GLP) 的 AAV 载体生物生产工艺。文献报道了使用贴壁和悬浮培养的多种 AAV 生产方案。例如Grieger等人通过评估辅助质粒、衣壳和表达质粒的四种比例、两种转染密度和三种宿主细胞传代数,开发了一种聚乙烯亚胺 (PEI) 促进的三质粒转染方案,获得了 1 × 109–3.3× 1010 载体基因组(vg)/mL的AAV单位体积生产力(血清型 1-6、8 和 9)。Blessing等人报道了在 PEI 介导的悬浮 HEK 293 培养物的三质粒转染中 AAV2/9 的生产力为 2 × 108 vg/ml。Zhao等人报道了用 PEI 转染的 HEK 293T 悬浮培养物的 AAV 生产力为 3 × 1011 vg/ml。此外,钙和脂转染已被用于递送质粒以生产贴壁 AAV。研究开发的动态数学模型表明,ssDNA 复制和衣壳合成之间的协调是产生完整衣壳 AAV 的关键参数。尽管取得了这些成就,但生产工艺的低稳健性、滴度和生产力的高可变性以及最终产品的低生物活性仍然是研究实验室生产 AAV 的主要挑战。
本研究的目的是开发和优化可放大的高产量生产工艺。尽管对贴壁和悬浮操作模式进行了评估和比较,但我们使用悬浮生产作为模型系统来进行工艺开发。本文研究了各种参数,例如宿主细胞、转染试剂、转染细胞密度、质粒 DNA 量、插入基因大小和可放大性,以确定最佳生产工艺。研究使用肿瘤细胞系和移植瘤小鼠模型证实了生产的 AAV 的体外转染和体内感染效率。除了生产之外,还对纯化方法进行了简要评估,但需要进一步的工艺开发。本研究获得的结果可能有益于 AAV 的内部三质粒瞬时表达。
详细实验操作步骤和结果分析,请参考原文
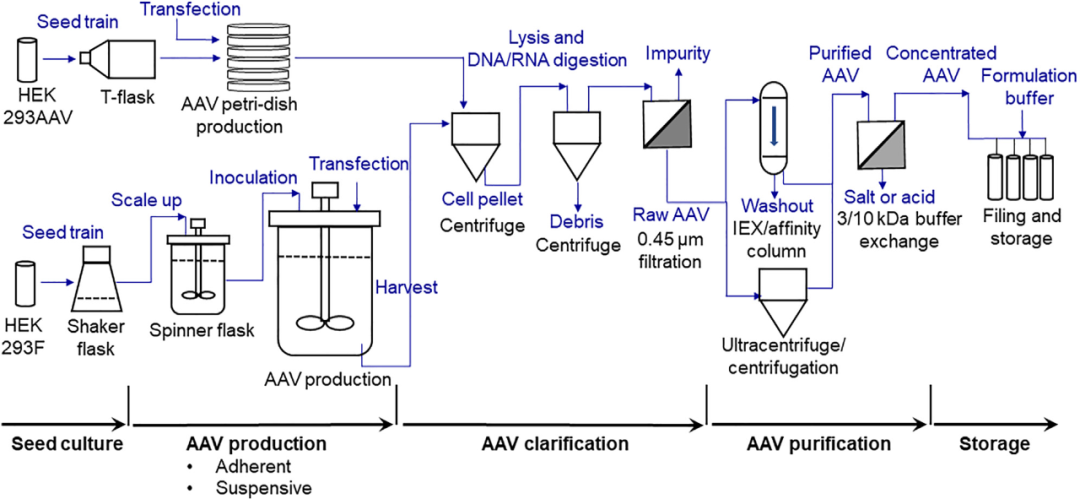
图1. AAV规模化高产量生产的工艺流程图(PFD),包括种子培养液制备、贴壁和悬浮生产、澄清、纯化(本研究采用超速离心)以及储存。
腺相关病毒生物生产
图 1 详细介绍了已开发的 AAV 生物生产过程的概况,包括贴壁生产、悬浮生产、纯化和储存。在贴壁操作模式下,HEK 293AAV 细胞用于接种多个培养皿以生产 AAV。显示具有最高转染效率和 AAV 生产力的钙溶液被用于向 HEK 293AAV 细胞递送3种无辅助表达系统质粒,包括表达 NLuc 报告基因(图 2A)或 eYFP 报告基因(图 2B)的 pAAV 质粒.我们在钙转染中确定的关键参数是转染复合物的 pH 值、转染前的培养基置换以及转染后的培养基置换。在悬浮操作模式下,将 HEK293F 细胞接种在摇瓶或转瓶中的 CD 培养基中,以用于AAV 生产。合成的阳离子脂质体被确定为最佳转染试剂,用于将质粒递送至 293F 细胞。我们在悬浮生产中确定的关键参数是转染细胞密度以及脂质体、质粒和细胞数之间的比例。
在 AAV 生产结束时收获的细胞颗粒经过处理,以通过在裂解缓冲液中的冻融循环来释放 AAV。添加脱氧胆酸钠、Benzonase和 RNase A 可以进一步处理 AAV 裂解液,并去除 DNA/RNA 杂质。使用 0.45 和 0.22 μm PES 过滤器过滤离心后的粗 AAV 上清液,以去除细胞碎片。碘克沙醇梯度超速离心法可用于纯化AAV产品,尽管纯化能力低,且处理过程时间长,但仍可实现高纯度和回收率。离子交换层析柱或亲和层析柱也可用于纯化某些血清型的 AAV。使用特定MWCO的浓缩器进行缓冲液置换和 AAV 浓缩。纯化的 AAV 储存在-80°C 冰箱中,以长期储存。在这项研究中,我们专注于 AAV-DJ/8 生产的工艺开发和优化以及感染生物活性的验证。并对纯化和储存进行了简要测试和讨论。
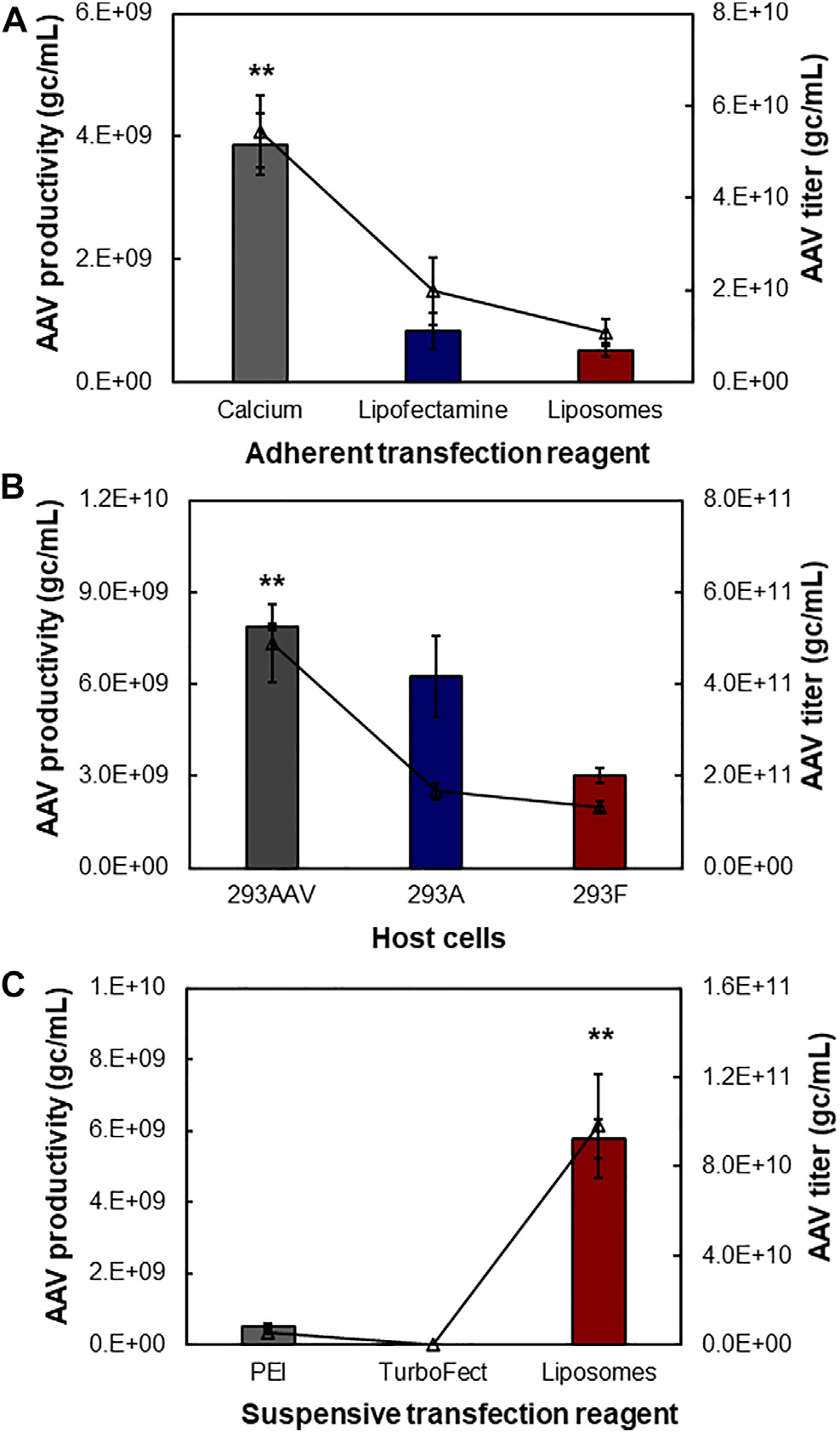
图3. 转染试剂、操作方式和宿主细胞的影响。三质粒(pAAV、pHelper 和 pAAV-DJ/8 Rep-Cap)转染用于生产 AAV。(A) 贴壁 AAV 生产由三种转染试剂介导,包括钙、lipofectamine和脂质体。HEK 293AAV 细胞在 30-ml 高葡萄糖 DMEM 培养基中培养,添加 10% FBS、0.1 mM MEM NEAA、2 mM L-谷氨酰胺和 1% Pen-Strep(数据代表平均值 ± SEM,n = 4 )。(B) 宿主细胞对贴壁培养中 AAV 产生的影响 (n = 2)。用钙转染测试了三种宿主细胞,即 HEK 293AAV、293A 和293F。(C) 由三种转染试剂(包括 PEI、TurboFect 和脂质体)介导的悬浮 AAV 生产。HEK 293F 细胞在添加有 4 mM GlutaMAX 的 30-ml 化学限定 FreeStyle 培养基中以 135 rpm 的搅拌速度培养(n = 4)。**p ≤0.05。
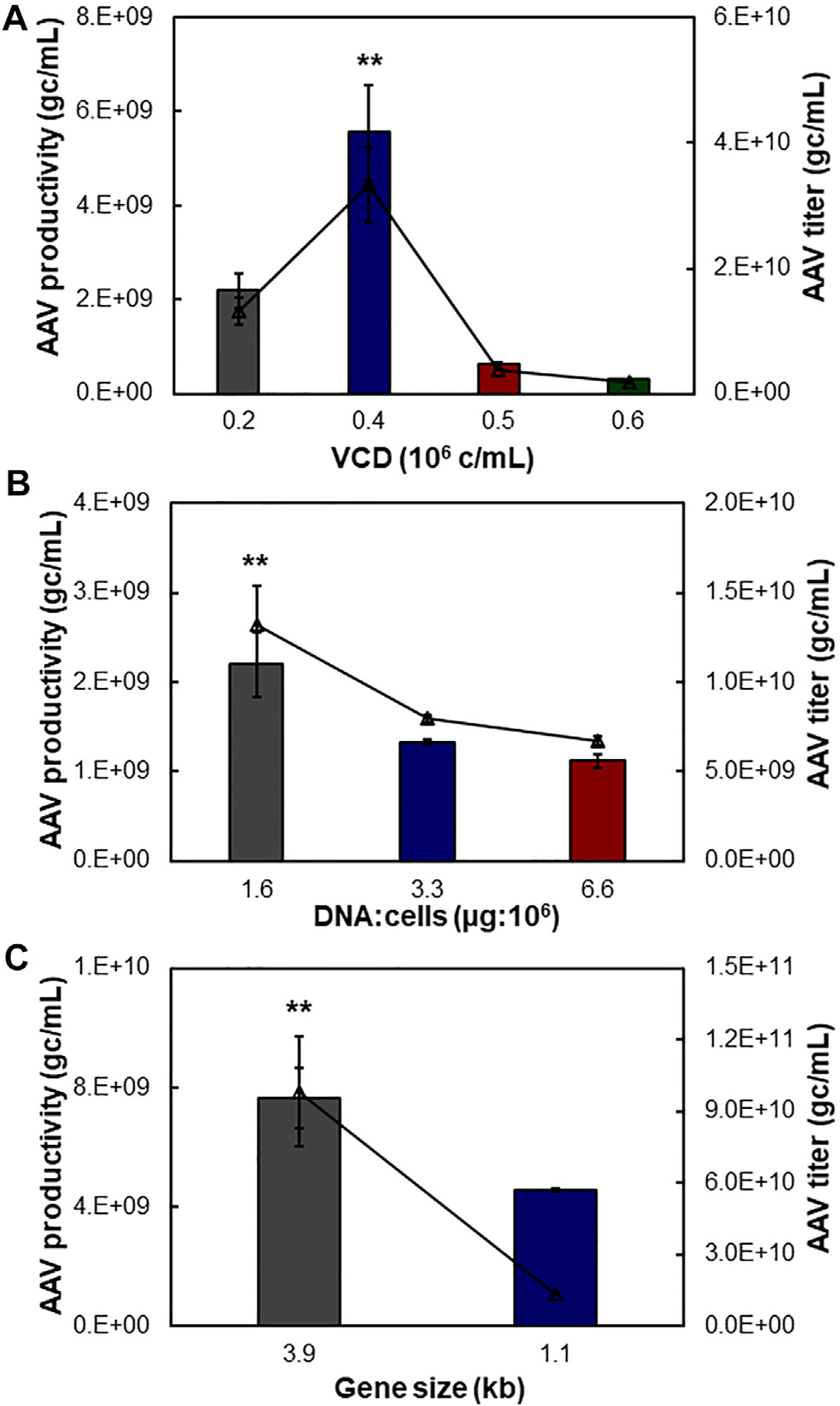
图4. 悬浮 AAV 生产的工艺优化。携带3.9 kb NLuc 融合基因的 pAAV 质粒用于转染HEK 293F 细胞 (A) 转染活细胞密度 (VCD) 对 AAV 产生的影响。(B) 质粒DNA (μg)和宿主细胞数 (106 cells) 的比例的影响。(C) pAAV 表达质粒中克隆的基因大小的影响。测试了 3.9 和 1.1 kb 的插入基因。**p≤ 0.05。
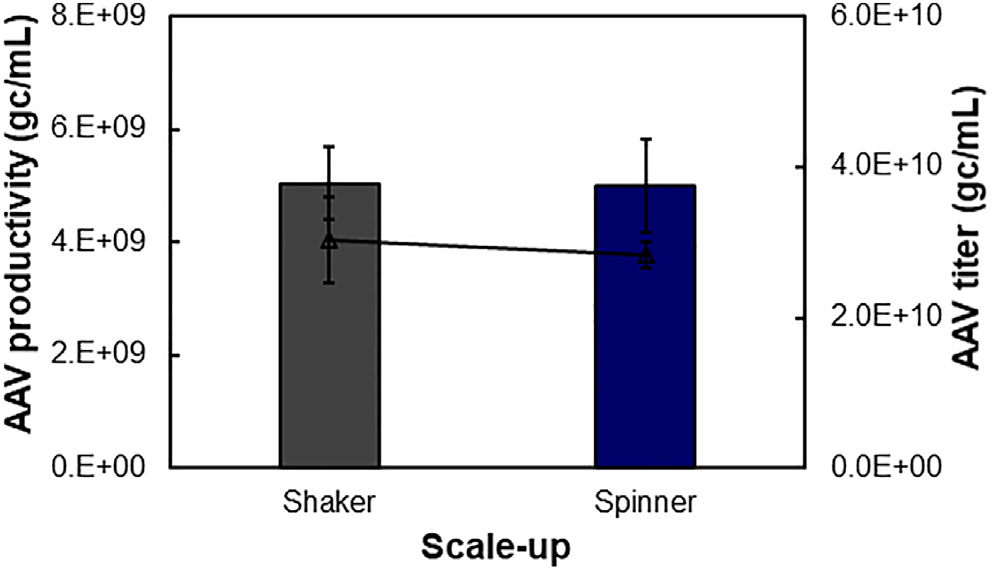
图5. 悬浮 AAV 生产工艺的可放大性。
生产模式、转染试剂和宿主细胞的影响
在 AAV 生物工艺优化过程中,我们首先评估了生产模式(即贴壁和悬浮)、转染试剂和宿主细胞对 AAV 包装和生产的影响。如图 3A 所述,在培养皿中使用 HEK 293AAV 细胞,钙促进的 pAAV-cfos-NLuc-ACC、pHelper 和 pAAV-DJ/8 Rep-Cap 质粒的转染产生了 3.87 × 109 gc/ml 的最高单位体积生产力。使用lipofectamine 3,000 和内部合成的阳离子脂质体转染所获得的 AAV 生产率分别为 8.37 × 108 gc/ml 和 5.29 × 108gc/ml。这三种转染试剂的粗 AAV 裂解滴度分别为5.45 × 1010 gc/ml、1.98 × 1010 gc/ml和 1.09 × 1010 gc/ml。三种宿主细胞之间的比较表明,在培养皿中培养并使用钙转染时,HEK 293AAV 细胞的 AAV 生产力为 7.86 × 109 gc/ml,滴度为 4.89 × 1011gc/ml,高于 HEK 293A,其生产力为 6.25 ×109 gc/ml,滴度为 1.67 × 1011 gc/ml 和 HEK 293F 细胞,其生产力为 3.01 × 109gc/ml,滴度为 1.34 × 1011 gc/ml(图 3B)。在悬浮 AAV 生产中研究了PEI MAX、TurboFect 和脂质体三种转染试剂。如图3C 所示,在摇瓶中进行的 HEK 293F 生产中,脂质体获得了最高的 AAV 生产力,为 5.78 × 109 gc/ml,滴度为 9.84 × 1010 gc/ml。PEI 的 AAV 生产力为 5.38 × 108 gc/ml,滴度为 5.38 × 109 gc/ml,TurboFect 的生产力为 1.70 × 108 gc/ml,滴度为 2.83 × 107gc/ml。
本研究表明,钙在贴壁 AAV 生产中比其它试剂具有更高的转染效率,但很难使用钙进行悬浮转染和转染前后的培养基置换。阳离子脂质体在悬浮 AAV 生产中表现出高转染效率,与 PEI 和 TurboFect 相比,脂质体的低成本可以显著降低 AAV 生产成本。此外,使用 HEK 293F 和脂质体的 AAV 生产力仅比使用 HEK 293AAV 和钙的低约 25%。因此,使用 HEK 293F 和阳离子脂质体进行悬浮 AAV 生产以优化 AAV 生产。
腺相关病毒生物生产的挑战和未来工作
本研究比较并优化了 AAV 的贴壁和悬浮生产。结果表明,这两种操作模式可以产生具有相似生产力和滴度的AAV,这对于小规模生产是可行的。然而,大量 AAV 需要在具有最佳转染条件的搅拌罐容器或生物反应器中进行可放大的悬浮生产。例如,搅拌速度会显著影响转染效率,可能需要在添加转染复合物后进行优化。内部合成的阳离子脂质体的粒径分布为 92.6 ± 0.4 nm,滴度为 3.2 × 1011 颗粒/ml。可以进一步优化阳离子脂质体的粒径以提高悬浮转染效率。尽管具有工程化衣壳、以实现高体内感染效率的 AAV-DJ/8 被用作模式系统,但所开发的生物工艺可用于生产不同的血清型。
纯化挑战和未来工作
本研究旨在优化 AAV 生产生物工艺,因此我们没有关注纯化策略。然而,我们按照已发布的方案对两种层析纯化方法进行了快速测试和评估,以纯化 AAV-DJ/8。使用配备 Cytiva HiTrap™ Q Sepharose XLIEX 柱的液相色谱系统(Bio-Rad)进行离子交换纯化,但回收率低于10%,且纯度也较低。实验还测试了 Cytiva HiTrap™ AVBSepharose 柱的亲和纯化,回收率低于 1% 或接近0%。Andari 和 Grimm 以及 Nass 等人也报道了未能使用 AVB 柱分离 AAV-DJ/8,原因在于血清型的演变。使用 Beckman CoulterL-100K 超速离心机的传统碘克沙醇梯度超速离心虽然操作时间长且难以规模放大,但回收率和纯度最高。我们将在未来的研究中进一步开发和优化基于层析的 AAV 纯化方案。
总结
在这项研究中,我们开发了一种可放大的稳健悬浮 AAV 生产工艺。评估宿主细胞、转染试剂、转染条件(活细胞密度、质粒 DNA 和基因大小)和培养容器以确定最佳工艺参数。此外,所开发的生物生产的可放大性和稳健性在摇瓶和转瓶中都得到了证实。生产的 AAV 在肿瘤细胞系和肿瘤移植瘤模型中显示出具有高转染/感染能力。尽管取得了有希望的结果,但我们需要进一步优化悬浮细胞的脂质体转染,并开发一种用于大规模悬浮 AAV 生产的高效 AAV 纯化工艺。
本文节选、翻译自以下原文,由于水平有限,详细内容,请参考原文。本文旨在知识、信息分享,如有任何问题,请私信联系。
原文:J.Guan, K.Chen, Y.Si, et al., Process Improvement of Adeno-Associated Virus Production. Front. Chem. Eng., 2022, doi: 10.3389/fceng.2022.830421.






