本文将讨论灌流生物反应器从几升的实验室规模放大到数千升的临床和商业规模的挑战。我们考虑实验室和大型反应器系统之间的比较研究,包括多相反应器模型和计算流体动力学工具以及组学研究,以支持可靠且稳健的放大过程。此外,将讨论具体的规模放大问题 - 例如细胞截留装置长期操作的可放大性以及工艺失败情况下的批次定义。最后,我们将评估一次性技术的潜力,并以生物生产未来发展背景下的经济、财务和环境考虑作为本文的结尾。
规模放大的挑战和未来展望
我们在这里考虑灌流生物反应器中的最大规模,即临床和商业化生产。目标是在这样的规模上实施灌流工艺,同时保持在工艺开发阶段时、在升级规模上获得的相同性能。这意味着相同的生产力和产量,以及相同的产品质量规格。从小到大的放大是一个经典的化学工程问题,如图 5.1 所示。这涉及有关气-液-固质量传输、混合和流体动力应力的问题,这些问题在有关多相反应器理论的经典书籍中都有论述。
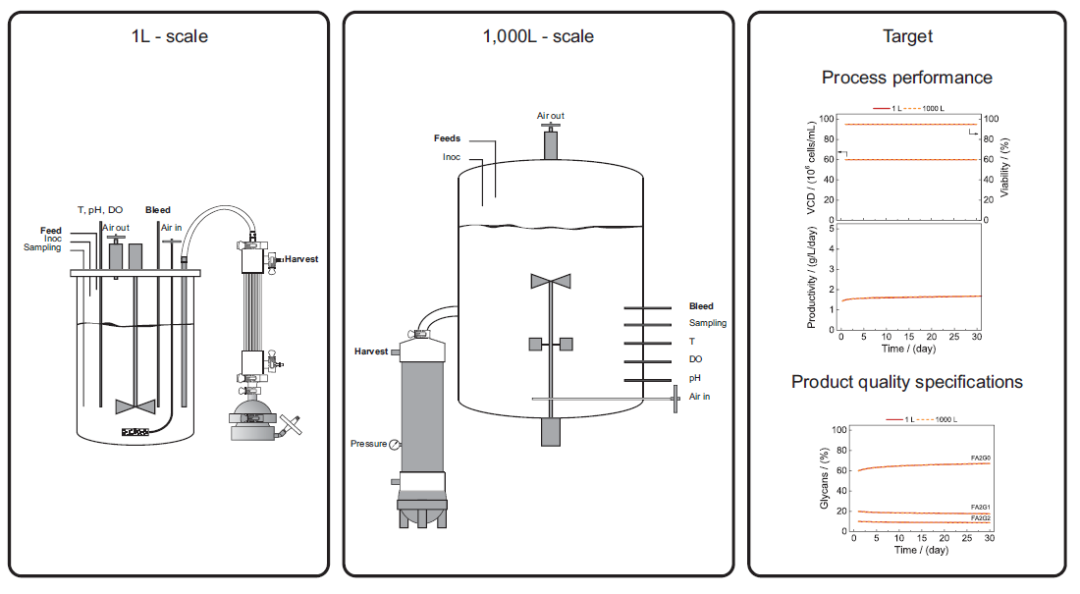
图 5.1 灌流工艺放大示意图:工艺设计和开发以升级规模结束,当进一步放大规模时,工艺条件和设备必须放大到商业化规模(>1,000 L)。理想情况下,工艺性能(例如,活细胞密度、活性、生产力)以及产品质量属性(例如,N-链糖基化模式)应保持不变。
第一步是了解流体动力学并证实不同规模的可比行为,这也受操作模式的影响。虽然最先进的补料分批技术使用 10 - 20×103 L 范围内的生产容器,但灌流技术实际上需要相对较小的生产体积,因为其具有更高的单位体积生产力,一般在 0.5 - 2 × 103 L 范围内。另一方面,必须考虑灌流中的辅助设备 - 特别是细胞截留装置 – 以及增加的系统复杂性。对于这两种操作模式,升级规模的生物反应器通常被认为足以在商业化规模下安全地放大搅拌容器的规模。大型容器中的微环境显然更加不均匀,因为混合强度的局部差异可能会导致空间变化 - 可能导致 pH、氧气浓度和温度差异- 因此也会导致不同的氧气摄取和二氧化氮去除。从细胞在这种异质空间中的行为角度来看,这将转化为使其暴露在不断变化的 pH 值、氧浓度和机械应力条件下,这显然会影响其新陈代谢。特别是在大体积搅拌容器中,细胞会从剪切力非常高的区域(靠近叶轮)移动到更平静的区域(例如,靠近反应器顶部的区域),那里剪切力较低。这导致了一种介于高应力和低应力之间的振荡环境,这会显著影响细胞行为。
除了在化学工程操作中非常常见的搅拌容器外,细胞截留装置也是独一无二的,并提出了特定的相关挑战。特别是,放大问题不仅来自细胞截留装置本身,还来自于整个回路,包括一个泵以及各种管路和阀门,细胞会暴露到一个不同的且很大程度上不受控制的环境。通常,这可能会给细胞施加不同类型的附加应力,例如,与温度控制不佳、缺氧或由于回路几何形状以及外部泵的存在所导致的流体动力学和机械条件有关的影响。因此,截留装置周围的整个回路设计,包括细胞的停留时间,成为灌流生物反应器规模放大的关键组成部分。
由于灌流系统中的细胞密度非常高,刚刚描述的问题变得特别具有挑战性,这不可避免地导致代谢物和营养物质的总体生产和消耗率提高。营养成分供应和气液传质很容易成为反应器运行的限制因素。为了在生物反应器中保持所需的溶氧水平,氧传质率 (OTR) 必须平衡细胞氧气摄取率 (OUR)。这需要足够高的氧气传质速率系数 kLa(根据经验法则高于 5 h-1),这在很大程度上取决于鼓泡的类型和几何形状、叶轮配置、单位体积气体流量以及搅拌速率。氧气消耗与天然副产物二氧化碳 (CO2) 的产生密切相关,CO2是细胞代谢的结果,通常由哺乳动物细胞以相似的摩尔量产生。产生的二氧化碳会影响反应器的 pH 值,这通常通过合适的缓冲系统进行控制,并受混合条件的影响。这会导致一个复杂的环境,需要严格控制特定水平的 pH、pCO2 和渗透压,因为它们可能会对细胞生长和生产力产生负面影响,甚至影响产品质量,尤其是当 CO2 水平增加到约 100 mmHg 以上时。更高的细胞密度也意味着更粘稠的悬浮培养物,这需要更高的搅拌能量来消除生物反应器内代谢物和气体组成的异质性。
前文中描述的挑战表明需要良好的混合,以使整个细胞悬液足够均匀,以及良好地输送营养物质和交换气态物质。这必须符合来自损害细胞活性的压力水平以及跨规模可靠转移工艺的实际限制。为此,有必要制定适当的规模缩小程序,以确定与规模无关的参数的最大操作范围,并模拟大规模条件,以评估对其它参数可能产生的不利影响。这些参数包括能量耗散率、混合时间和气液传质率等。
在详细了解规模对反应器行为的影响之前,我们必须简要提及当今生物生产的一些特点,这将在不久的将来极大地影响商业生产场地的布局和设计。我们生产治疗性蛋白质的方式正处于快速发展阶段,受成本压力、进入发展中市场、日益激烈的竞争和具有新的、更复杂分子形式的临床管线,以及有限的生产能力、对产品质量和工艺日益增加的法规(例如质量源于设计倡议)、生产过程中对更高程度灵活性的需求的推动。通过在生产过程的各个阶段实施连续和集成操作来强化工艺,可能是解决其中一些挑战和问题的答案。以往,连续操作,特别是在发酵水平上,仅限于生产“脆弱”的治疗性蛋白质(如因子 VIII),未得到更广泛的应用。然而,现在已经证明了在单个端到端连续生产过程中集成不同单元操作的可能性,并且建议在许多可能的生产场景中使用这种方式。这代表了一种有吸引力的解决方案,可以缩小生产设施并构建更灵活的生产平台。随着设备尺寸的降低,一次性应用越来越受到关注。纵观整个行业,专家们设想未来的生产工厂将完全一次性使用、封闭并在模块化的宴会厅设施内连续运行,而无需今天使用的大型储罐。这显然不是所有生产情况的解决方案,许多不同的“变体”值得考虑,包括混合技术,具有批次上游工艺或批次精纯单元,并且只有单个单元以连续模式运行。我们将在本章结尾处回到这些方面的内容,以完成生物制药行业当前和未来商业规模生产的图景。
搅拌罐生物反应器的规模放大
连续灌流培养通常使用与内部或外部细胞分离装置耦合的搅拌罐生物反应器。前文已经讨论了细胞分离装置的可放大性,这里将重点关注搅拌罐的放大。哺乳动物细胞培养需要特定的工艺设计和设备布局,因为它们具有独特的特性,主要与对剪切、(非生理)CO2浓度和环境条件变化的高敏感性有关。在下文中,我们将讨论关键的放大条件 - 即适当的混合、充分的氧气传输以及在低剪切率下充分去除CO2。我们将介绍把工艺设备的特性与工艺知识相结合的不同方法,以确定灌流培养的最佳操作范围。
传统的规模放大策略基于经验而不是定量科学考虑。通常,在放大过程中,每个规模都会调整与规模相关的参数,例如搅拌速度和气体流量。这是一种非常费力的方法,因为它需要在每个规模上进行适当的临时实验工作。
另一方面,与规模无关的参数可以在反应器规模缩小模型中定义,然后在规模放大期间实施。这包括最大流体动力应力、最小O2供应和CO2去除率等参数,这些参数可用于定义每个规模的细胞依赖性操作条件范围。搅拌速度和鼓泡强度是纠正放大问题的宝贵工具。然而,有必要通过进行旨在模拟大规模条件的小规模研究,来系统性地解决这些问题,以研究对细胞行为可能产生的不利影响。对此,不同规模的几何相似性可以为相关参数的确定提供适用的工程规则 - 例如平均能量耗散率、混合时间和气体传质率。然而,在实践中,整个生物制药行业所采用的生物反应器通常相当多样化的,这阻碍了简单几何缩放规则的应用,并且需要对关键放大参数进行实验测量或计算评估。
本文为以下文献内容简介,详细内容,请参考原文。本文旨在知识、信息分享,转载请注明出处和原文。
原文:Perfusion Cell Culture Processes for Biopharmaceuticals Process Development, Design, and Scale-up , pp. 100 - 137






