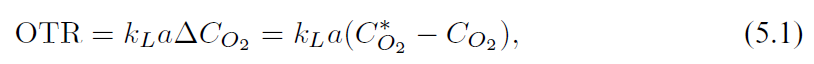

如前所述,随时间变化,每个细胞都暴露在相似的混合强度下。
营养物质、代谢物和副产物均匀分布在整个反应器中,因此细胞不会发生任何变化,并保持其代谢不变。
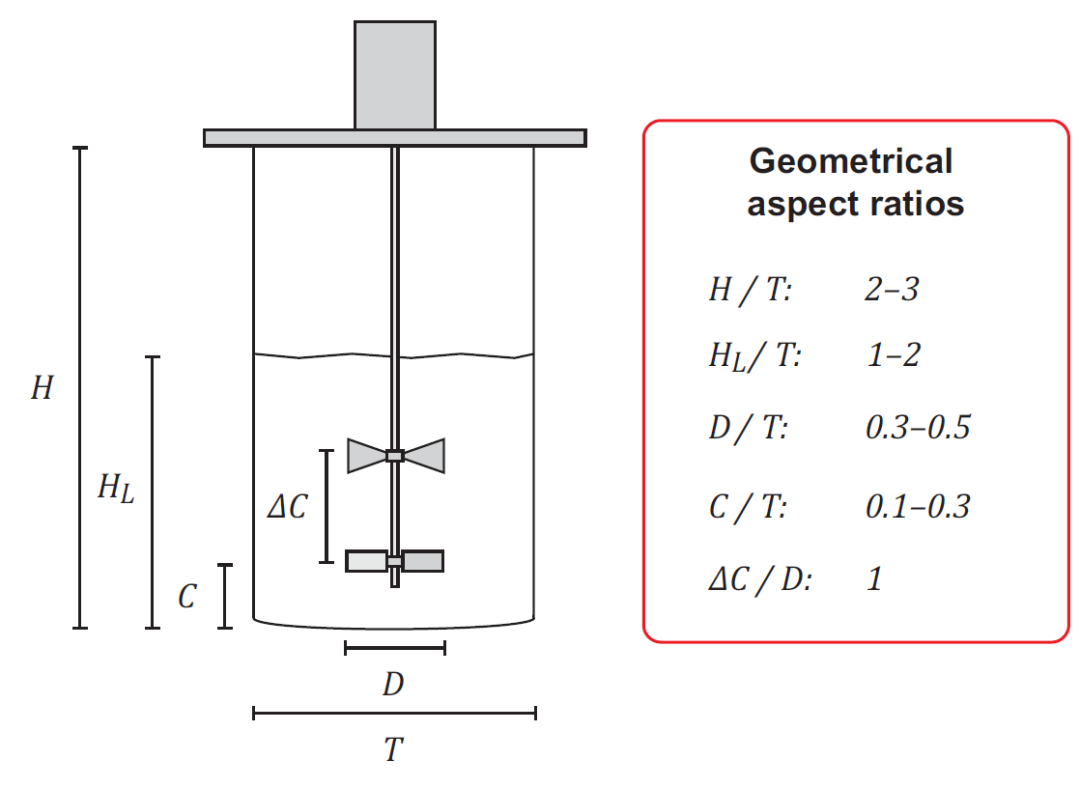
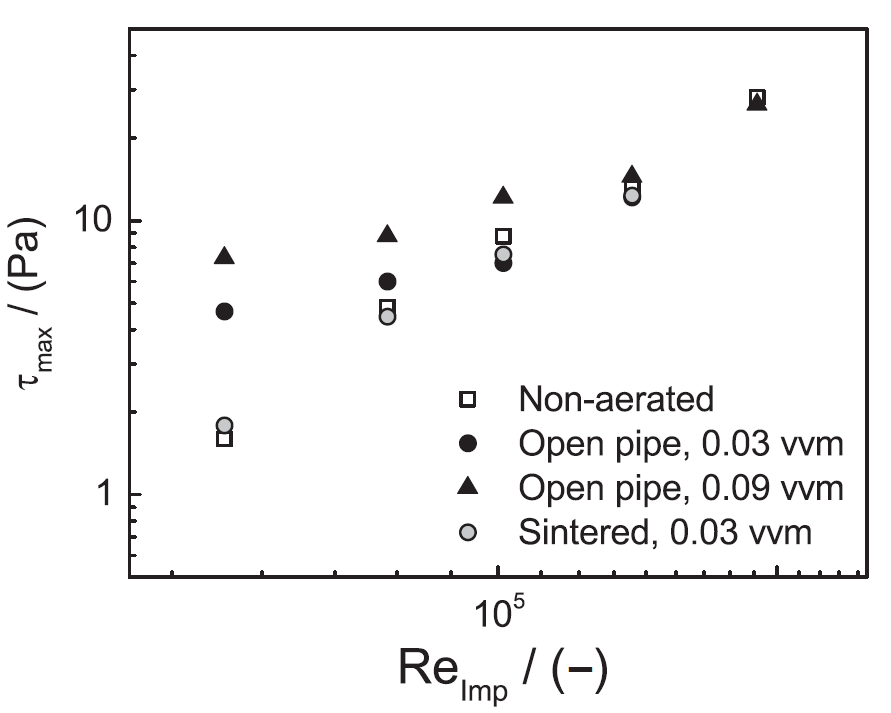
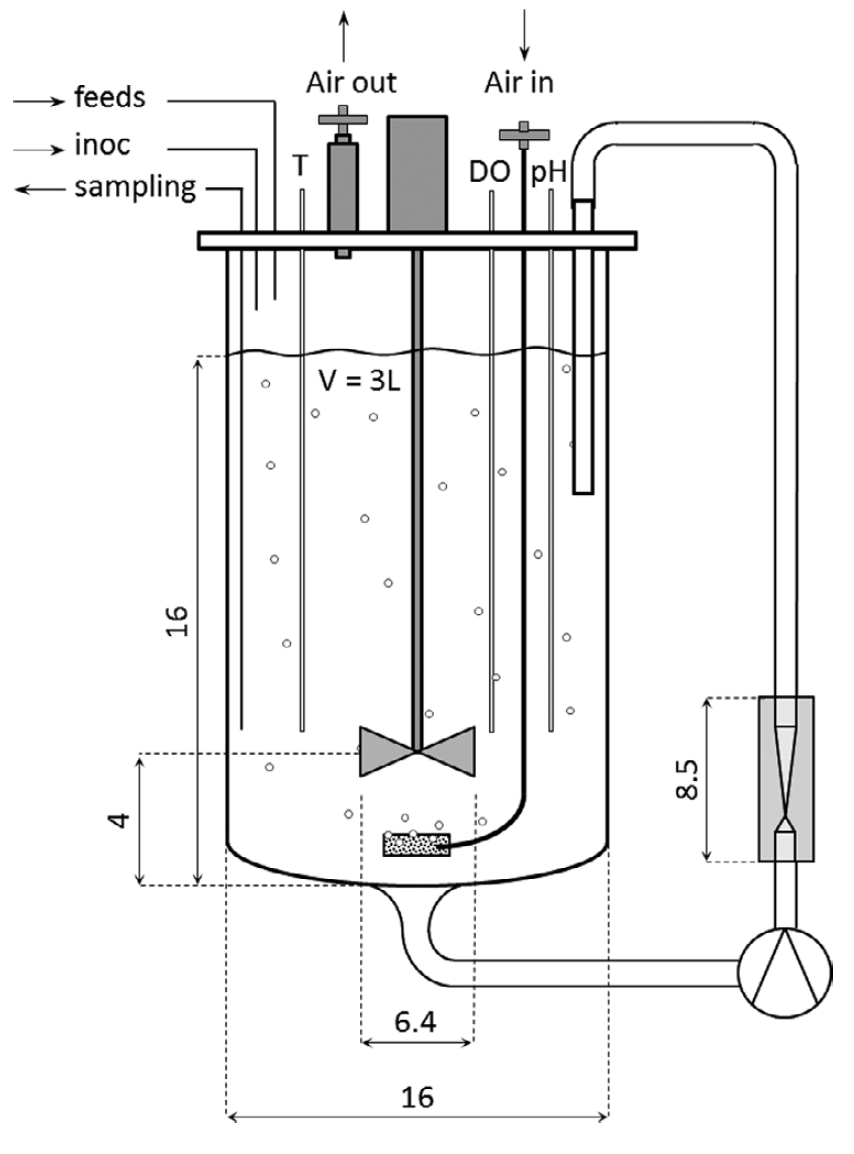
使用适当的网格划分和边界条件以及有关流体特性的信息来构建模型。
通过离散化求解各种动量、质量和能量平衡方程,并以某种便于分析的形式产生结果。
以向量和等高线图的形式解释数据,以提取所需的信息。

如前所述,随时间变化,每个细胞都暴露在相似的混合强度下。
营养物质、代谢物和副产物均匀分布在整个反应器中,因此细胞不会发生任何变化,并保持其代谢不变。




使用适当的网格划分和边界条件以及有关流体特性的信息来构建模型。
通过离散化求解各种动量、质量和能量平衡方程,并以某种便于分析的形式产生结果。

您可以在此处留言您想要和我们说的话,我们会仔细查看的哦。
在此输入您的留言内容
