2021年,FDA批准的抗体药物突破100款,跨越近40年的发展,抗体药物不断从实验室走向商业化,应用领域也得到不断扩展。同时,基于多领域生物技术的突破,从抗体生产工艺来看,无论是其规模还是效率也是发生着翻天覆盖的变化。
抗体单位体积表达量从不到1g突破到10g以上,生产规模从几十升到几万升,纯化收率也是大幅提升,这使得抗体药物的生产成本在过去20年持续得到降低,达到几十美元/克的水平,大幅提升了这些优质药物的可及性。
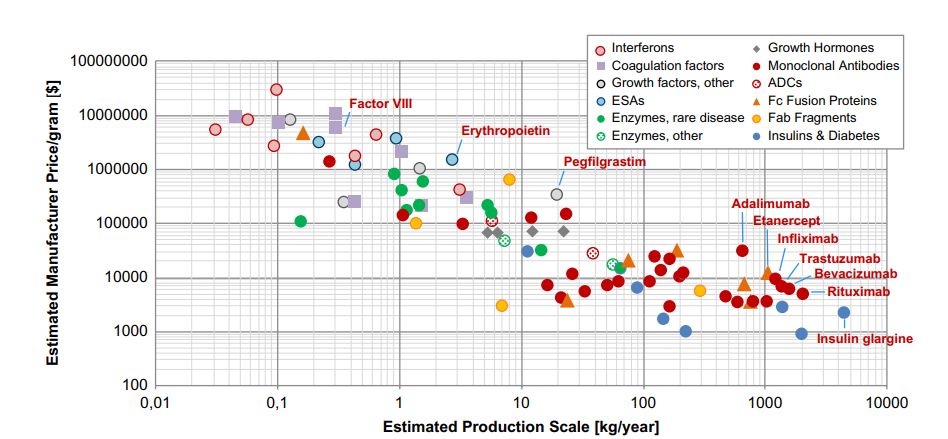
然而,一方面伴随生物类似药的崛起,高剂量抗肿瘤抗体药物的频繁应用,以及慢性病领域的边界拓展,下一代如双抗药物的表达量限制。另一方面,当PD-1抗体药物在中国的使用费用降低至3万/年,当CGRP为代表的偏头痛抗体药物治疗费用突破7000美元/年以下时,抗体生产工艺的成本与效率再一次成为相关药物开发的关键考量点。
即便是抗体药物的生产模式发生巨大的改变,但是上游细胞培养的培养基和下游蛋白纯化的层析填料,仍然是生产成本中两个最关键的因素,原材料性质和生产效率的突破成为重点。
以下游层析为例,以传统树脂填料为主的层析模式是主流的纯化模式。它的传质模式主要是扩散传质,因此,其在实现相对高的动态结合载量的情况下,需要更长的保留时间,通常为4~6分钟,极大的限制了其生产效率。随着材料化学的突破,膜层析生产工艺近年来开始崛起,其基于4~6 μm更大的孔径,表现出对流流通的特性,极大地提高了流速和通量,仅在6~12秒的保留时间下,即可获得相对高的动态结合载量。
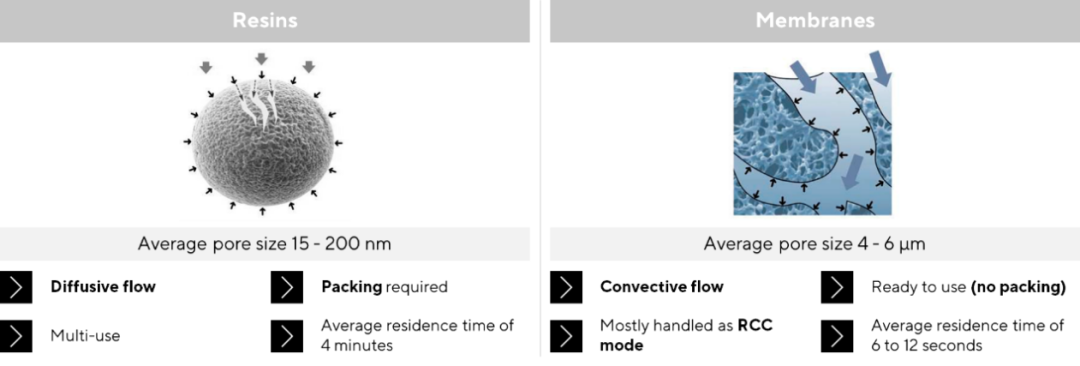
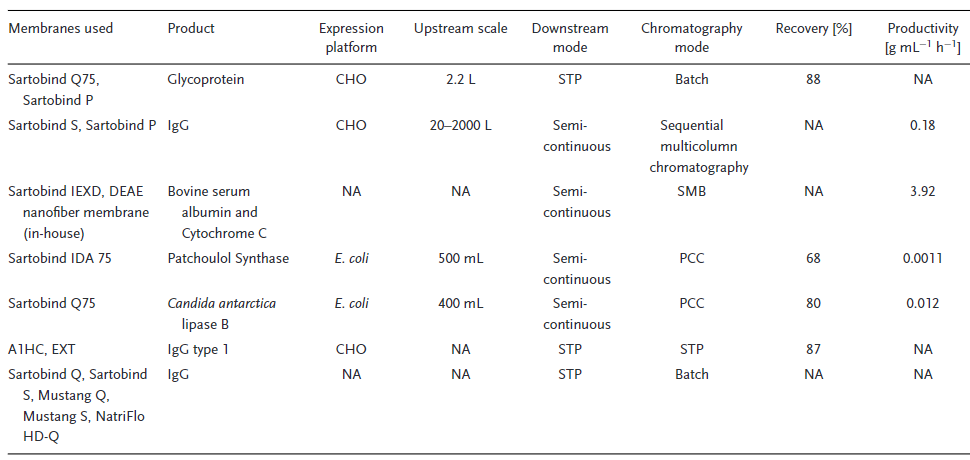
基于膜层析工艺巨大的优势,其已经逐步运用到各类产品的工艺开发和生产过程中。阴离子层析工艺主要去除宿主DNA及宿主蛋白等工艺相关杂质,大多数使用高载量的流穿模式,且其工艺相对简单,是最早使用膜层析的工艺步骤,在糖蛋白和磷脂酶的纯化过程中均有所应用。此外在抗体的大规模生产中,德国克劳斯塔尔工业大学也使用阳离子膜层析工艺,以半连续的方式进行抗体药物纯化,大幅提高了工艺效率。
值得注意的是,Sartobind作为膜层析技术的领航者,以稳定化的再生纤维素为基架,偶联相应的离子交换、疏水等功能配基而形成的一系列膜层析产品,此前已经推出过阴离子交换层析膜(Sartobind® Q, STIC PA),阳离子交换层析膜(Sartobind® S),疏水层析膜(Sartobind® phenyl)等产品。
Protein-A亲和步骤作为抗体药物生产过程中最关键的单元操作,其单批次纯化的循环数是限制抗体整体生产效率的瓶颈,单批次通常为3-6个循环,生产周期达到1-3天。如果选择减少循环数以提高生产效率,在载量不变的情况下则需要扩大生产规模。由于Protein-A填料单位体积的高成本,必然将进一步加剧药物的成本压力。随着非亲和膜层析作为替代传统填料层析的潜力已经体现,Protein-A亲和膜层析工艺的需求也更为旺盛。

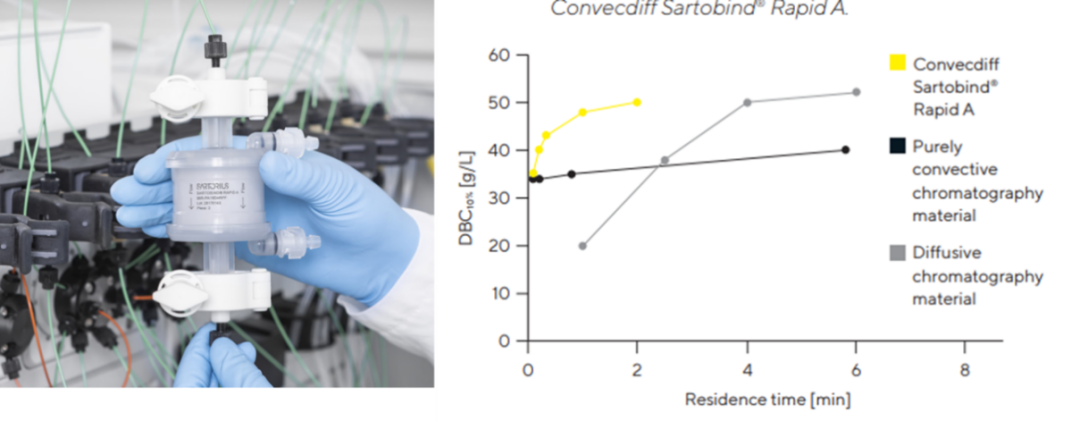
近期,笔者发现Sartobind家族新添Sartobind Rapid A蛋白A亲和层析膜,即刻引起了从业者的关注。与传统树脂层析填料相比,Sartobind Rapid A在10秒左右的保留时间即可实现40 g/L以上的动态结合载量,而前者则需要在2分钟以上的保留时间才可以实现相同的动态结合载量,Sartobind Rapid A将生产效率提高了10倍以上,极大地驱动了抗体药物生产工艺的变革,加速了成本效益的实现。
不同类型的抗体药物开发数据表明,在5个膜柱体积每分钟的高流速下,Sartobind Rapid A均可实现40~50 g/L的高动态结合载量,且收率达到90%以上。同时抗体单体纯度达到95%以上,有效去除工艺相关杂质,病毒清除能力得到有效验证。在多达200个循环次数的验证实验表明,动态结合载量无明显变化,同时protein-A残留量小于3 ppm。

基于膜层析的易于放大性以及灵活性,Sartobind Rapid A提供从实验室级别到生产级别等多个规格,充分满足多种工艺的使用需要。以2000L的生产规模,5g/L的上游表达量来看,需要近60L的层析填料以4个循环每批次进行生产。如果在相同的生产周期下使用Sartobind Rapid A膜层析技术,仅需要3.2L的膜。因此Sartobind Rapid A膜层析技术可以有效优化亲和层析的成本和效率。
值得注意的是,虽然Sartobind Rapid A不是第一个推出的蛋白A亲和膜层析技术的,但却是第一个提供真正意义商业化解决方案的产品。Sartobind Rapid A将以超高流速的优势极大地提高抗体药物纯化的效率,并降低成本,驱动新型抗体药物生产工艺的变革。
成本和效率是药物生产工艺永恒的主题,两者在药物开发的不同阶段体现出差异性化的权重,建立高度灵活化的工艺是匹配产品商业化开发的终极目标。当然双抗及抗体偶联药物等不断崛起,商业化的需求量将变得多元化,膜层析技术不但可以提升工艺的成本效益和效率,并将为工艺带来惊人的灵活性,重塑产品在生命周期中的活力。
参考文献:
1.Process Capability Requirements [B]. Biopharmaceutical Processing, 2018:73-94.2.
2.Intensified Downstream Processing of Monoclonal Antibodies Using Membrane Technology [J]. Biotechnol J 2021 Mar;16(3):e2000309.






