以下文章来源于医药速览
共价药物用于治疗疾病已有一个多世纪的历史,而促进共价药物合理设计的工具最近才出现。Nature Reviews Drug Discovery 上发表了题为“Advances in covalent drug discovery”的综述文章,阐述了过去十年共价药物发现的里程碑,总结了新兴共价药物发现技术的工具箱。
公众号后台回复“20220927共价药物”,即可获得百度网盘提取码,下载本文所引用文献。
医药速览 | 来源
墨竹 | 作者
Dara | 编辑
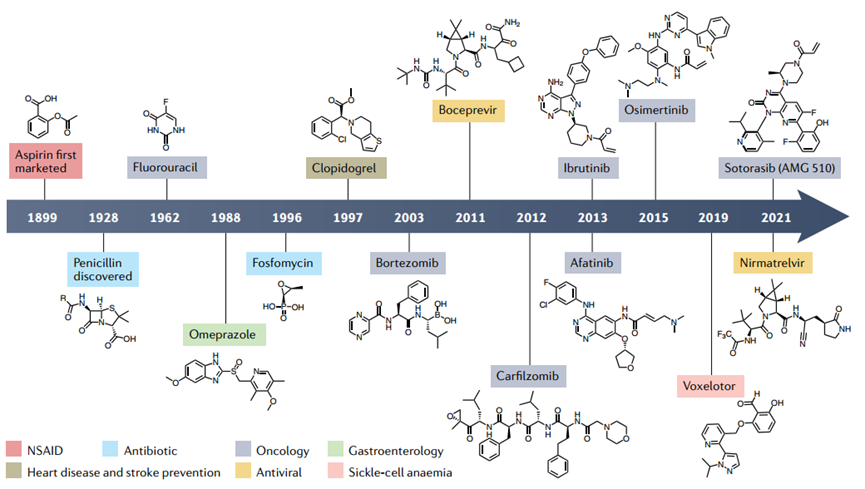
历史上许多共价药物都是在它们已经被广泛使用后才被发现通过共价机制起作用,其中最突出的是阿司匹林。
此外,早期的共价药物也倾向于来自或受到自然来源的启发。青霉菌产生的β-内酰胺类抗生素,如青霉素,与参与细菌细胞壁合成的青霉素结合蛋白(PBPs)结合。一些共价药物是含有硫醇代谢物的前药,这些代谢物形成二硫键以灭活其靶标。如质子泵抑制剂奥美拉唑,于1988年被FDA批准用于治疗胃食道反流病。在癌症治疗中,嘧啶核苷类似物5-氟尿嘧啶和吉西他滨分别是用于抑制胸苷合成酶和核糖核苷酸还原酶I的前药。Bortezomib是一种与26S蛋白酶体的苏氨酸催化残基共价结合并抑制其活性的二肽硼酸,于2003年被FDA批准用于治疗多发性骨髓瘤患者。共价药物已被用于治疗各种疾病。而从一开始就关注共价性,而不是在事后发现共价作用机制,往往可以更好改进药物设计。
图1 主要共价药物开发时间表
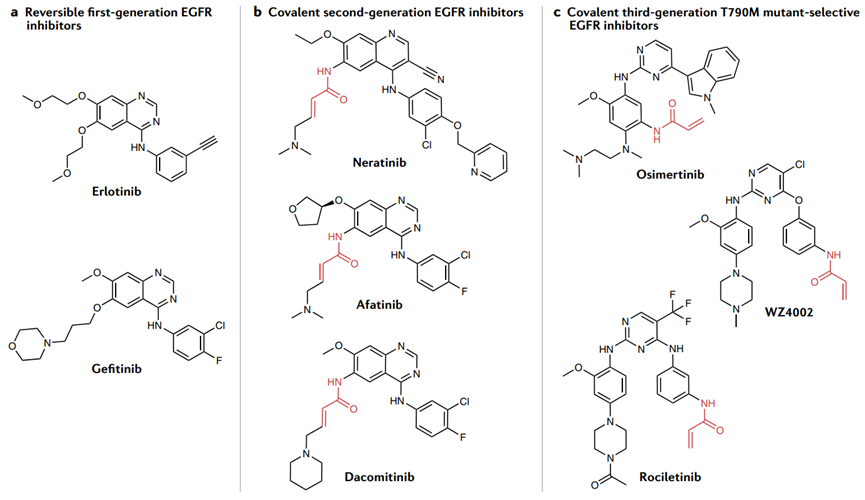
将中等活性的亲电官能团加入到已知的可逆配体中,以加强对蛋白质功能的抑制。这些化合物往往需要在反应性、活性和选择性之间取得平衡。代表例子是EGFR共价抑制剂。第一代可逆的EGFR抑制剂Gefitinib和Erlotinib被发现对含有EGFR体细胞激活突变的肿瘤有效,然而随着T790M突变,不仅降低了许多可逆抑制剂与EGFR的结合亲和力,而且还增加了EGFR与ATP的结合亲和力。
为了克服这一问题,共价第二代抑制剂被战略性地设计为与丙烯酰胺迈克尔受体反应,与EGFR中的半胱氨酸残基(Cys797)反应。Cys797位于ATP结合位点附近,EGFR配体与EGFR的不可逆结合部分恢复了对T790M关守突变体的活性。
第三代EGFR抑制剂紧随阿法替尼之后,这些共价抑制剂选择性地针对T790M突变体而不是野生型EGFR,包括WZ4002、Osimertinib和Rociletinib。这些化合物保持丙烯酰胺基团与Cys797共价结合,但将第一代和第二代化合物的喹唑啉部分交换为嘧啶,以提高突变EGFR(T790M)的选择性。
共价EGFR抑制剂的成功验证了将非催化、非保守的半胱氨酸与激酶活性部位相邻的半胱氨酸共价结合的方法,以提高最初可逆配体的效力并调节其药效学。除此之外,具有代表性的还有BTK抑制剂ibrutinib,JAK3抑制剂feogatinib等。
该方法意味着从最初的发现过程就植根于寻找共价配体,而不是将共价结合到已知的可逆配体中。关键药物包括KRAS (G12C)抑制剂sotorasib和SARS-CoV-2 MPRO抑制剂nirmatrelvir。基于KRAS靶点治疗癌症,直接使用传统药物发现方法均未成功。KRAS没有用于可逆抑制剂结合的口袋,竞争性抑制剂需要克服GTP和GDP的皮摩尔结合亲和力,而对野生型KRAS有活性的抑制剂可能显示出靶向毒性。而针对G12C突变体的共价KRAS抑制剂具有吸引力有几个原因。首先,靶向突变的KRAS可以对癌细胞产生选择性的细胞毒作用。其次,由于KRAS缺乏易于连接的口袋,因此通过共价结合实现的亲和力将是有利的。第三,NSCLC中12-14%的KRAS突变是KRASG12C,这是一个有希望的患者群体,将直接受益于KRAS(G12C)抑制。最后,KRAS中的第12位位于效应器结合区和核苷酸结合口袋的下方,这表明共价KRAS(G12C)配体可能影响KRAS的功能。2013年,研究人员报告了第一个突变选择性共价KRAS(G12C)抑制剂。该抑制剂是通过一种称为tethering的二硫键片段筛选方法发现的。在此基础上综合代谢稳定性、生物利用度等方面优化的结果,ARS-1620被确定为第一个适用于体内研究的KRAS(G12C)抑制剂。这一系列KRAS(G12C)抑制剂效力的提高和体内模型的成功表明,设计临床有效的药物是可能的。Sotorasib(AMG-510)是2018年进入临床试验的第一个选择性KRAS(G12C)抑制剂,其中针对KRAS(G12C)筛选了一个共价结合半胱氨酸的定制小分子文库。设计小分子共价KRAS(G12C)选择性抑制剂为给无法用药的癌症靶点提供了一种解决思路。在KRAS(G12C)抑制剂之前,最近在肿瘤学中发现的靶向共价抑制剂大多是通过配体优先的方法确定的。共价KRAS(G12C)抑制剂的成功验证了亲电优先发现共价药物的方法,并肯定了共价片段筛选技术的重要性。
1、筛选平台
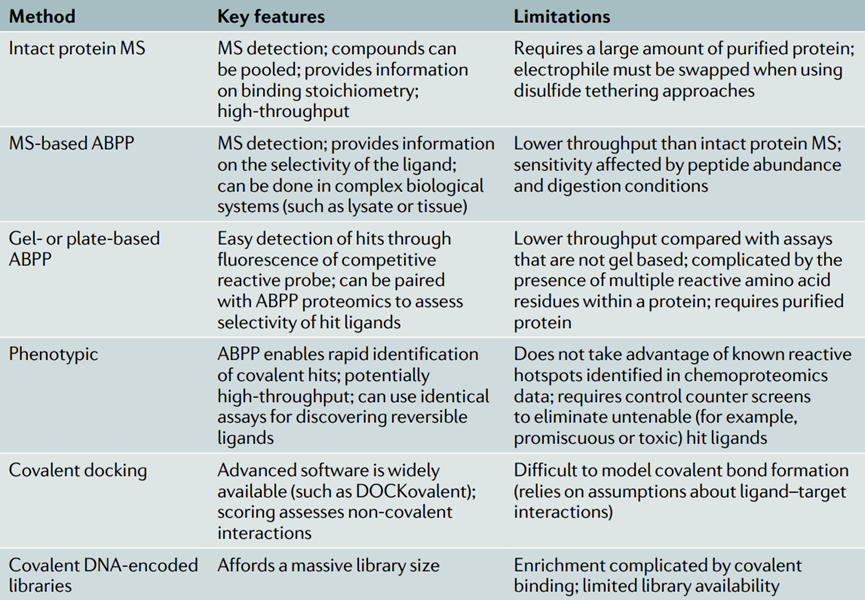
许多新兴的共价配体筛选平台涉及基于MS的检测,这是通过化合物与蛋白质之间形成共价键实现的。还使用了其他表型、DNA编码或计算方法,然后将其与基于MS的验证、基于ABPP的实验配对,以告知选择性和结构生物学,从而实现药物化学。
表1总结了最突出的共价筛选方法。亲电片段类化合物商业文库的增长是这些亲电优先发现策略兴起的关键因素。
表1共价药物发现筛选方法比较
化学蛋白质组平台可以直接在复杂的生物系统中鉴定共价化合物及其对应的靶蛋白上的可配位位点。化学蛋白质组学的进展促进了针对不可药物的疾病靶点的共价配体的发现,并使跨蛋白质组的共价配体的选择性图谱能够识别这些配体的靶点和非靶点。
大多数蛋白质反应性共价药物往往是亲电的,以便与亲核氨基酸发生反应。相比之下,亲核药物可以与亲电辅助因子和翻译后修饰发生反应。几种含肼的化合物作为单胺氧化酶(MAO)A和B的基于机制的抑制剂,从而被MAO激活使黄素辅因子能够烷基化,从而抑制酶。ABPP原理和“反极性”探针已被用来研究亲电翻译后修饰。基于联氨的探针也被用来帮助识别和表征具有亲电辅助因子或翻译后修饰的蛋白质的配体。
半胱氨酸的低丰度使选择性成为可能,但限制了以共价方式靶向特定感兴趣蛋白质的机会。这个问题促使科学家研究其他亲核氨基酸的靶向,特别是赖氨酸。由于赖氨酸的ε-氨基在生理条件下的亲核性很低,因此发现高效的赖氨酸靶向共价配体需要鉴定异常活性的赖氨酸。结合全面的电泳谱、赖氨酸导向的化学蛋白质组学和结构导向的方法,科学家将能够利用配体结合位点附近丰富的赖氨酸残基来促进共价药物的发现。
过去十年里,共价药物有了成功的进展,包括EGFR、BTK、KRAS(G12C)和SARS-CoV-2 MPRO的抑制剂。这些药物的批准代表了里程碑,展示了共价药物发现从偶然的努力演变为具有既定成功路线的领域。在可逆共价机制中,活性和选择性之间平衡的研究将会继续。亲电优先发现策略的采用代表了该领域的一个显著转变。我们相信,共价配体独特的特性将继续推动共价药物的发现与发展。