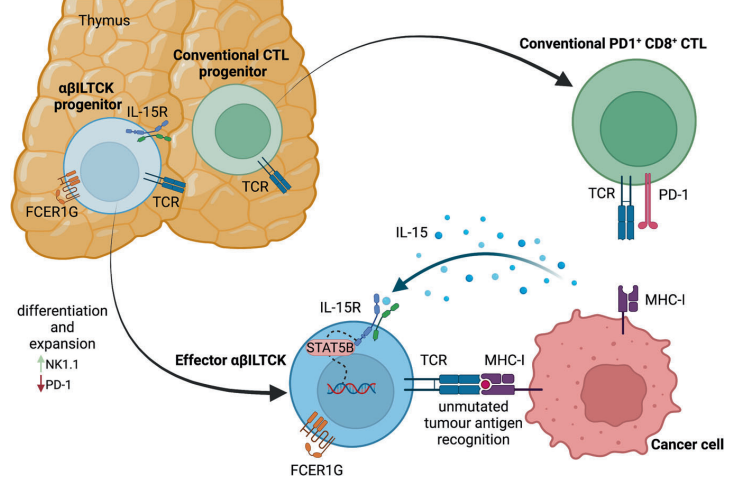
在最近发表在《自然》杂志发表了一项研究,Chou和他的同事定义了一种新型抗肿瘤T细胞亚群:进化上保守,表达αβTCR和FCER1G,具有高细胞毒性和天然免疫细胞(NK1.1)特征,命名为αβILTCKs。
αβILTCKs:抗肿瘤活性
为了全面表征肿瘤浸润性细胞毒性T细胞的表型,Chou和同事直接从MMTV-PyMT(PyMT)小鼠乳腺癌组织中分离的CD45+TCRβ+CD8α+细胞进行单细胞RNA测序分析。生物信息学聚类鉴定了五种不同的T细胞群,包括初始T细胞、激活T细胞、耗竭T细胞、增殖T细胞,以及以高表达NK1.1的αβILTCKs。这些细胞具有独特的转录组,不同于传统的肿瘤浸润CD8+T细胞。它们属于非传统的1型样先天淋巴样细胞。同一研究组之前的工作表明,αβILTCKs原则上可以对肿瘤细胞表现出固有的细胞毒性。
Chou和同事还在小鼠前列腺癌和人类结直肠癌组织中检测到αβILTCKs,表明它们可能代表了进化上保守的肿瘤诱导免疫监测调节因子。比较了来自肿瘤驻留的NK1.1+CD8α+αβILTCKs和传统的PD-1+CD8α+T细胞(PD-1+T细胞)的配对TCR序列,这两个肿瘤浸润性T细胞亚群并不是来源于共同的祖细胞,而是代表了两个完全不同的祖细胞。
与PD1+TCR+CD8+T细胞识别肿瘤抗原不同
针对PD-1轴的免疫治疗,需要传统的PD-1+T细胞的活性,这些传统的CTLs通常识别具有高肿瘤突变负担的肿瘤,因为它们的TCR能够检测到突变的新抗原是“非自身”。相比之下,NK1.1+CD8α+αβILTCKs的大多数TCR识别未突变癌症特异性肽。
特异性表达FCER1G
将肿瘤浸润αβILTCKs的基因表达谱与PyMT小鼠乳腺肿瘤组织中所有其他CD45+TCRβ+CD8α+细胞的基因表达谱进行了比较。编码Fc Epsilon受体Ig蛋白(FCER1G)的Fcer1g的表达与其他肿瘤浸润CD8+T细胞,包括PD-1+T细胞相比有显著差异,无论它们的激活状态如何。在原发性人类结肠癌组织中,在TCRβ+细胞中也检测到FCER1G的表达,其共受体表达谱与小鼠αβILTCK相似。此外,与邻近的正常组织相比,这些FCER1G+T细胞在癌变组织中富集,表明FCER1G是一个谱系定义的标志物,是肿瘤浸润T细胞进入αβILTCK谱系的特征。Signal Transduct Target Ther. 2022.
抗肿瘤活性依赖IL-15
在S100a8-cre-Il15fl/fl PyMT小鼠模型中,癌细胞来源的IL-15丢失导致肿瘤组织中αβILTCK招募减少,癌症免疫监测受损,与野生型对照相比,肿瘤生长加速。接下来,作者通过在αβILTCK祖细胞中选择性地表达功能获得的STAT5B变体(STAT5B-CA),组成性激活IL-15R信号通路。将这些工程αβILTCKs过继转移到淋巴细胞缺陷的肿瘤携带PyMT小鼠中,与对照组αβILTCKs相比,强烈抑制了肿瘤生长。
简评:αβILTCKs表达的PD-1下降,因而PD-(L)1抑制剂对此群细胞可能无效。αβILTCKs和经典的PD-1+T细胞互补,识别未突变的肿瘤抗原,且依赖于IL-15信号,为联用IL-15和PD-1抑制剂提供了理论基础。