以下文章来源于佰傲谷BioValley ,作者Dara
mRNA(信使核糖核酸,Messager RNA)由DNA的一条链为模板转录而来,是携带着遗传信息并能指导蛋白质合成的一类单链核糖核酸,也是连接基因和蛋白质的桥梁。
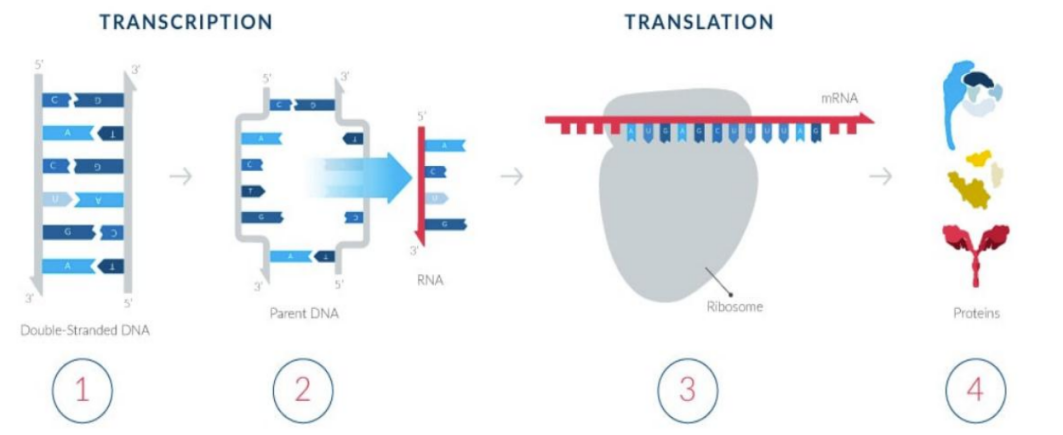
mRNA的翻译机制
60年代~70年代 证实mRNA存在&发现脂质体 1 证实mRNA的存在
1960年伊始,科学界相继迎来了激动人心的时刻。基于1947 年至 1960 年间的诸多开创性研究,从60年代开始,关于mRNA遗传密码的神秘面纱被逐渐揭开。
1960年,Fram ois Jacob和Matthew Meselson确定了蛋白质是在细胞质的核糖体上组装而成。这个重要发现表明细胞核里的染色体和细胞中的核糖体中必然有一种联系的桥梁,即细胞内存在一种将细胞核里的遗传信息转移到细胞质的机制。此后,Jacob和Meselson又选用细菌作为研究对象并做了相关实验,确定核糖体是蛋白质合成的场所。
不过,这还是没解开遗传信息是如何翻译成蛋白质的疑惑。如果是核糖体RNA负责将细胞核里的遗传信息传到细胞质,那么细胞内应该有许多不同的核糖体。不同的核糖体应该含有不同的RNA模板,而不同的RNA模板应该来自不同的基因,编码大小不一的蛋白质。然而,这种可能性很快就被排除,因为他们发现核糖体是完全一样的。既然编码遗传信息的DNA在细胞核里,而遗传信息最后的表达发生在细胞质的核糖体,而现在又发现核糖体RNA也不可能是传递信息的媒介,那么,在细胞内肯定存在其他的成分充当遗传信息传递的载体。
鉴于细胞内大多数RNA是rRNA,但并不都是rRNA,所以也许细胞内还有其他种类的RNA充当遗传的信使。对此,1961年,Jacob和Jacques Monod 提出了信使RNA假说,认为细胞内肯定存在一种特殊的RNA是直接从DNA上合成的,它们的序列与DNA上的基因序列互补,然后被运输到细胞质为蛋白质合成提供模板。在一种蛋白质合成结束以后,它的mRNA将离开核糖体,为其他的mRNAs“让路”。
为了验证这个假说,Brenner、Jacob和Meselson在加州理工学院实验室进行了紧张的科研工作。很快他们发现,使用噬菌体感染大肠杆菌后不久,就有一种病毒特异性的RNA被合成并很快和细菌内本来存在的含有细菌rRNA的核糖体结合。但这种新的病毒RNA并不是核糖体的永久性成分,而只与核糖体短暂结合。这正是假说中预测的mRNA 分子。[7]
2 发现脂质体
脂质体的发现对mRNA技术的发展至关重要(下文将提到),遂在此单独列出说明。
脂质体是由类似生物膜结构的磷脂等类脂分散于水相中所形成的封闭囊泡,膜壁厚度约为5~7nm,囊的直径一般在 25 ~500 nm内。药物可根据其亲油、亲水性质,或插入类脂双分子层,或包封于脂质体内水相,也可直接连在脂质体表面。
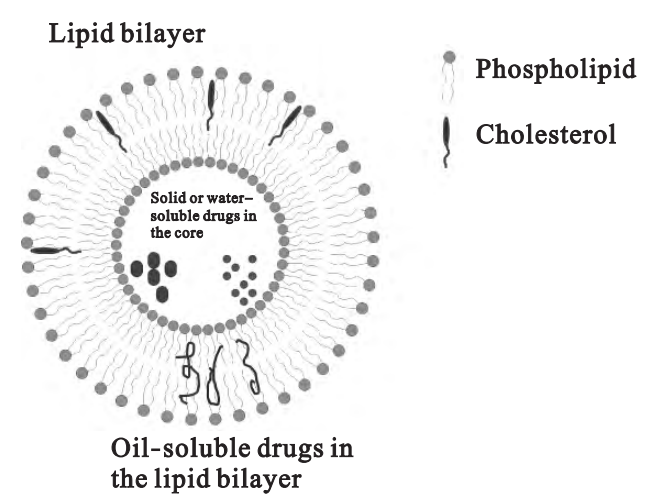
追溯脂质体的发现过程,可以知道,虽然研究者们很早就已经通过电子显微镜观察到了细胞周围和内部的生物膜结构,但膜中存在磷脂双分子层这一观点还未被广泛接受。基于对磷脂膜的好奇,Bangham 尝试将蛋黄卵磷脂滴于涂布水的载玻片上,显微镜下惊奇地发现卵磷脂与水相互作用自发形成了类似叶状体(“fronds”) 的复杂结构。随后,Horne 使用负染色法观察此分散体,清晰看到了遍处的囊泡(起初称之为“Banghasomes”),基于这一发现,1964 年 Bangham 和 Horne 将此多层囊泡的电镜图发表于 Journal of Molecular Biology,作为脂质体的雏形首次映入世人眼帘。
1965年,Bangham又与同事做了磷脂囊泡的离子透过性实验,发现磷脂双分子层可以维持离子(钠或钾)的浓度梯度,且脂双层打乱的同时离子梯度也不复存在,此实验为脂质体作为载药系统奠定了坚实的基础。
而对于如今我们所熟知的“liposomes”一词其实源自于1968年Gerald Weissmann的报道,他最初想法是用Bangham的囊泡系统建立溶酶体模型,将其重命名“liposomes”后,并定义为一层或多层磷脂组成的微小囊泡而广为人知。[8]
70年代~80年代 使用脂质体包裹mRNA
如前所述,发现mRNA是科学史上激动人心的事件。不过,短暂的激动后,该领域的科学家又有了其他烦恼。
因为他们发现,mRNA不稳定、易降解,想将mRNA分子送到特定的靶细胞并产生足够的、需要的蛋白质,从而实现期待的治疗效果尚为困难。
彼时,脂质体开始作为“好拍档”进入mRNA领域。基于脂质载体的递送系统能够包裹mRNA分子,包封率较高,以及保护mRNA免受酶降解。另外脂质载体通常会含有对mRNA细胞内转运有利的重要的功能性脂质成分。这些脂质成分在生理环境下带有正电荷,通过静电作用将带有负电荷的mRNA分子包裹起来,并帮助整个载体系统与靶细胞的细胞膜相结合,从而起到递送mRNA的作用。
用一个不太精准但形象的比喻,大概就是mRNA分子是馅,脂质体是皮,脂质体包裹mRNA就如“包汤圆”般用皮(脂质体)将馅(mRNA分子)包起来。而通过脂质体的保护,可以让mRNA更好地更完整地进入到体细胞内,诱导出一定的免疫反应。
1978年,Dimitriadis等人便首次使用脂质体成功将编码兔球蛋白的mRNA递送至小鼠淋巴细胞并产生功能性蛋白质,验证了“包汤圆”的可行性。

80年代~90年代 人工合成mRNA
mRNA技术发展到70年代,其实已经有了很大的进步。但介于那时候的条件和生物工程技术,还没有一种方法能够在实验室中制造这种遗传物质,大多数科学家都是从兔子血液、培养的小鼠细胞等来源中重新使用mRNA。所以当时很少有研究人员把mRNA作为一种医疗产品来考虑,更多地是用它来研究基本的分子过程。
如1984年,Krieg和生物学家Douglas·Melton及分子生物学家Tom·Maniatis和哈佛大学的Michael·Green等人利用从病毒中提取的RNA合成酶等在实验室得到了具有生物活性的mRNA(这一核心方法至今仍在使用)。然后Krieg将实验室制造的mRNA注射到青蛙的卵子中,证明它的工作原理与真实一样。这时,Melton和Krieg也仅认为合成mRNA主要是作为研究基因功能和活性的工具。

到了90年代,事情迎来了转机。
20世纪90年代,美国科学家 Jon Wolff的团队将体外合成的mRNA注射至小鼠骨骼肌内,通过检测发现其在细胞内可表达特定蛋白生成,产生免疫反应,这一发现震惊学术界。
如果说,此前mRNA技术的发展仅仅是能“包汤圆”却不能决定汤圆里放什么馅,那么发展到这个时期,基于人工合成mRNA的技术,科学家已经能决定往汤圆里放什么馅了。
90年代~2000年 正视mRNA“露馅”问题&纳米脂质体出现 1 正视mRNA“露馅”问题
当然,仅仅是能决定放什么“馅”还不够。因为即便mRNA能被稳定提取并注射到动物体内,它也会引起一系列免疫反应,就像是身体在对抗病毒入侵一般。也就是说,这时候mRNA进入人体后还面临着容易“露馅”的问题。但这不妨碍mRNA技术的潜力被看到。
事实上,早在1990年,宾夕法尼亚大学的Katalin Karikó教授就提出,在基因疗法领域,mRNA疗法也许可以成为DNA疗法的替代。两者的长处一目了然,DNA疗法的作用即便不是永久,也是长效的,而mRNA能提供短期内的修正。对于由于基因突变导致的遗传病来说,DNA疗法也许更为适合。而在其他疾病领域,mRNA有一展拳脚的空间。
“但(当时)没有人对它感兴趣。” Karikó教授回忆道。mRNA不是一种容易操作的分子,它不如DNA和蛋白质稳定,很容易被降解。但更重要的是,即便mRNA能被稳定提取并注射到动物体内,它也会引起一系列免疫反应,就像是身体在对抗病毒入侵一般。因此,它在安全性上有巨大隐患,这基本宣判了这种治疗思路的死刑。
2 纳米脂质体出现
除了对mRNA有更深入的认识,同期进步的还有mRNA的递送技术。
前文提到,脂质体可作为“皮”将mRNA这个“馅”包裹起来送进人体。但“皮”也存在品质上的不同。选择先进的皮,能更好地实现mRNA的递送。而随着纳米科学和纳米技术的发展,纳米颗粒脂质体(Lipid nanoparticles,LNPs)开始崭露头角,LNP便是这种优质皮。
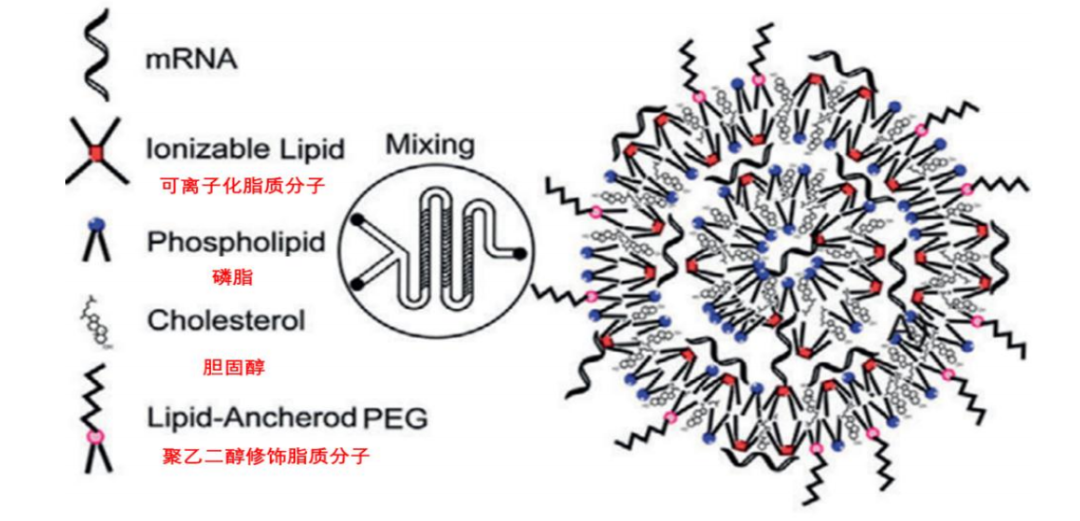
LNP由于细胞膜和 mRNA 均带负电荷会产生排斥反应,LNP 的阳离子脂质可以协助mRNA 进入细胞膜。此外,可离子化脂质分子的应用则实现了 LNP 技术的突破,它的极性会随 pH 值变化而改变,在生理pH 值下保持中性,在 LNP 被细胞吞入形成内体后,pH 值会降低,可离子化脂质分子会携带正电荷,改变 LNP 结构促进 mRNA 释放到细胞基质内完成抗原蛋白翻译。以及聚乙二醇修饰的脂质分子可以有效防止 LNP 聚集,控制 LNP 大小以及防止 LNP 最初被人体免疫系统识别。
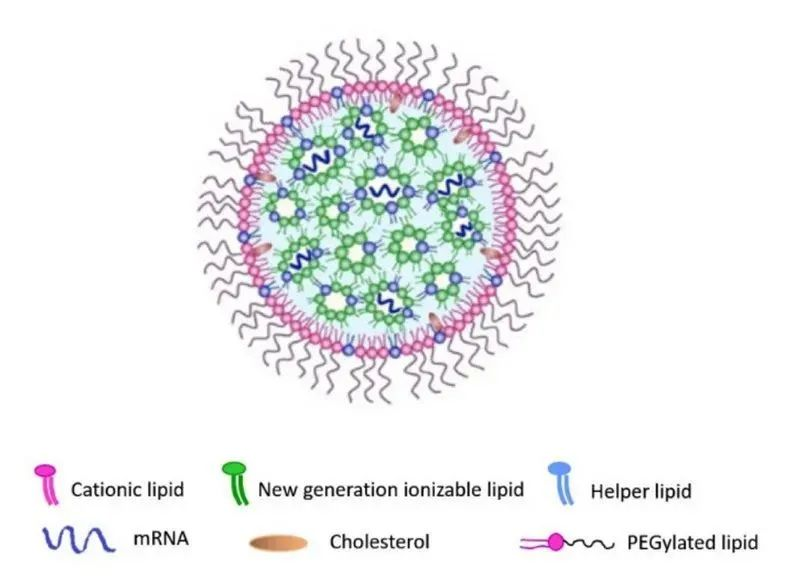
20世纪90年代中期,Pieter Cullis的团队开始研究大分子,他们发现脂质纳米粒可用于向肝脏输送mRNA并产生蛋白质。当然,一项技术的发现如何助推另一项技术发展往往都要等上多年才知道,LNPs也不例外。把时间拉长到往后的十多年,才能深刻了解LNPs在mRNA技术中的关键作用。

2000年~2010年 发现假尿苷&商业化雏形出现
时间来到2000年后。
1 发现假尿苷
实际上,在注意到mRNA易被身体的免疫系统识别并清除掉后,科研人员一直在寻求技术上的突破。2005年,Katalin Karikó和她在宾夕法尼亚大学的合作者Drew Weissman有了诺奖级的大发现——修饰mRNA。他们发现,用假尿苷去替换mRNA中的尿苷,不但能够让合成的mRNA免受免疫系统的攻击,而且显著增强了mRNA表达蛋白的能力。这一突破性的发现结果发表在Immunity 杂志上,解决了mRNA 临床应用的最大难题,从此揭开了mRNA临床应用的序幕。

随后,Katalin、Drew以及美国宾夕法尼亚大学将mRNA分子修饰的专利独家授权给mRNA RiboTherapeautics,该公司将该专利二次授权给Cellscript,Cellscript又将专利二次授权给Moderna和BioNTech。
2 mRNA商业化雏形出现
除了技术上的突破,在2000年至2010年的10年间,mRNA技术的商业潜力也逐渐被看到。这时候,已经开始有大型药企向mRNA进军。如2008年,诺华和Shire都成立了mRNA研发部门——前者关注疫苗,后者关注药物。
当然,还有人们熟知的mRNA三巨头CureVac、BioNtech、Moderna也是先后在这十年间成立。
2000年,CureVac成立于德国,是mRNA药物技术领先的生物技术公司。公司拥有20年的专业经验,专注于癌症疗法、抗体疗法、罕见病治疗和预防疫苗的开发。 跨拥有独特的四大技术平台。四大技术平台分别为:mRNA疗法平台、细胞和基因治疗平台、蛋白质疗法平台和小分子治疗平台,涵盖肿瘤、传染病和罕见疾病等领域。 2010年,Moderna成立,公司致力于开发以mRNA 技术为基础的创新疗法。2018年12月,Moderna 在纳斯达克上市。目前,公司拥有世界领先且自助完整的mRNA研发生产平台,包括mRNA的改造、L NP递送系统和生产平台。 2010年~2020年 临门一脚&一战成名 1 临门一脚
纵览过去的几十年,可以发现,为发挥mRNA技术作为药物的潜力,多年来业界一直在攻克mRNA自身稳定性差、易被体内的核酸酶降解等致命缺陷。而在2000年至2010年的10年间,从对mRNA的修饰到mRNA递送系统的选择,mRNA技术的发展已取得长足的进步,但还差临门一脚。
如前文所述,90年代时,科研人员已对LNP在mRNA领域中的应用进行了探索,但LNP如何作为mRNA的载体还未有具体的表述,直到2015年。
2015年,帕迪和韦斯曼首次描述了将脂质体纳米颗粒(LNP)作为mRNA的载体。LNP的作用就是保护mRNA,防止其降解,同时帮助mRNA顺利进入细胞。
至此,mRNA疗法发展史上面临的最艰巨的两大难题,随着mRNA修饰问题的解决与LNP技术的应用迎刃而解。
2 一战成名
不过,尽管在过去的数十年间,mRNA技术已在技术上相继取得重大突破,但当时传统观点仍认为mRNA太不稳定且价格昂贵,所以几乎所有涉足mRNA领域的公司都选择了将资源投资到别处。而因为外部投入少,在2020年之前,还未有一款mRNA疫苗或药物正式获批上市。
但很快,局势发生了变化。2020年,全球性新冠疫情暴发。2020年12月,由辉瑞/BioNTech开发的全球首款mRNA新冠疫苗获得了FDA的紧急使用授权,开始了在全球范围内的免疫接种。
mRNA新冠疫苗的初步尝试点燃了业界对这项技术的期望,市场热捧,资本迅速涌入。mRNA技术的时代至此到来。
现在,除了疫苗,mRNA还正在拓宽“自己的边界”,有望为多个疾病预防和治疗领域带来新方法,比如肿瘤、免疫疾病等。
所谓高科技即建立在基础科学上的应用科技,一旦基础受限,应用这座高楼大厦,将因为没有基石而坍塌。而回溯mRNA技术六十年的发展可以发现,mRNA技术能发展至今,最为关键的其实是基础科学研究数十年的铺垫。
但在mRNA技术爆火之前,谁都难以预料这项技术今后的发展。这正是基础研究最大的特性——不可预见性。你没法知道自己的研究将会是一颗哑弹还是一场革命。或许,对基础研究而言,过于功利和以目标为导向反而可能一无所获。






