自11年前FDA批准第一个免疫检查点抑制剂(ICI)以来, ICI已经彻底改变了肿瘤医学的临床实践。然而尽管ICI免疫疗法具有巨大的潜力,但仍存在许多有待解决的缺点,大部分的患者仍然缺乏响应,这种失败可归因于肿瘤的异质性、获得性抵抗以及有害的免疫相关不良事件。
因此,为了提高ICI疗法的疗效,组合疗法以及新型的免疫检查点抑制剂应运而生。其中淋巴细胞激活基因3(LAG-3)是最重要的下一代免疫检查点分子之一。目前,19个LAG-3靶向分子正在108个临床试验中进行评估,这些试验显示了积极的结果,包括与其他ICI的双特异性抗体分子。
今年3月,百时美施贵宝开发的Opdualag,一种新型的抗PD-1(Nivolumab)和抗LAG-3(Relatimab)的组合治疗方案被美国食品和药物管理局(FDA)批准用于不可切除或转移性黑色素瘤。与Nivolumab单药治疗相比,这种新型免疫治疗组合将中位无进展生存期(PFS)增加了一倍以上(10.1个月对4.6个月)。Opdualag的成功将促进更多靶向LAG-3的分子进入临床实践。
LAG-3是一种Ⅰ型跨膜蛋白,具有四个Ig样结构域(D1-D4)。LAG-3的D1由9条β-链组成,它们被称为A、B、C、C'、C”、D、E、F和G链。大约30个氨基酸的附加序列位于C和C'链之间,形成一个环,称为“额外环”。尽管序列相似性较低,但在人和小鼠LAG-3中都可以观察到这个环,据报道此环参与了LAG-3和主要组织相容性复合体II类(MHCII)之间的关联。此外,LAG-3高度糖基化,在D2-D4中存在多个N-糖基化位点。Galectin-3和肝窦内皮细胞凝集素(LSECtin)被认为与LAG-3聚糖存在相互作用。
LAG-3的D4和跨膜区之间的存在一个较长的氨基酸序列称为“连接肽”。基于小鼠模型,发现金属蛋白酶ADAM10和ADAM17可以在CP处裂解LAG-3,并以可溶性形式释放LAG-3胞外区域。因此,ADAM10和ADAM17可能通过调节细胞表面LAG-3的数量来调节LAG-3的抑制作用。人与小鼠CP的氨基酸序列同源性较低,因此人类LAG-3是否也能被这些金属蛋白酶裂解,还有待进一步研究。
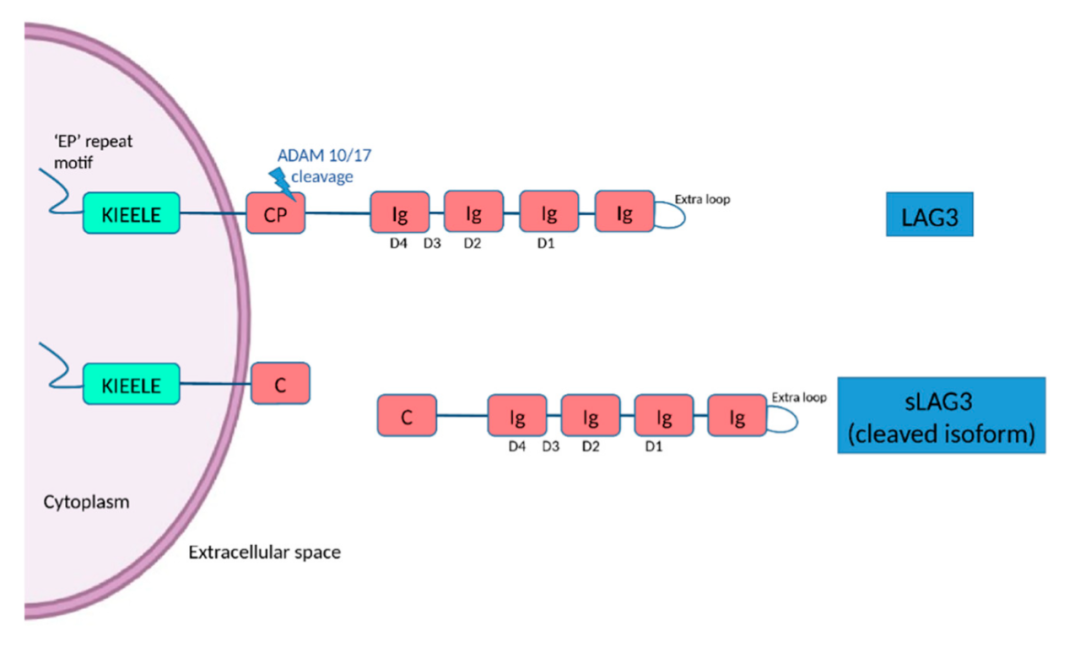
LAG-3的胞内区由大约60个氨基酸残基组成,缺乏典型的抑制基序,如免疫受体基于酪氨酸的抑制基序。然而,它包含几个氨基酸序列,这些氨基酸序列在不同的LAG-3物种中非常保守,而不与其他抑制性共受体共享。这些序列包括并列膜区的FSAL,中部区域的KIEELE,10-15个谷氨酸串联重复序列,以及在C末端区域的倾向但不限于的脯氨酸(EX-repeat)。LAG-3抑制T细胞活化需要细胞内区域的信号传递,它可以通过这些序列传递不同的抑制信号。
与PD-1和CTLA-4一样,LAG-3在原始T细胞上不表达,但在抗原刺激下可在CD4+和CD8+T细胞上诱导表达。LAG-3在具有抑制功能的CD4+T细胞亚群中也有表达。Foxp3+调节性T(Treg)细胞结构性地表达LAG-3。
LAG-3在CD3+CD4-CD8-T细胞、TCRαβCD8αα上皮内淋巴细胞、γδT细胞和NKT细胞上也有表达,据报道,其在活化NK细胞上的表达参与了对小鼠MHCI阴性靶细胞的杀伤作用。浆细胞样树突状细胞和活化B细胞也在其细胞表面表达LAG-3。然而,LAG-3在这些细胞中的功能作用仍然知之甚少。此外,据报道LAG-3在神经元上也有表达,并作为α-突触核蛋白纤维的受体。
LAG-3区分pMHCII的构象并选择性地与稳定的pMHCII结合。除了稳定的pMHCII外,还有其他几种分子被报道为LAG-3的可能配体。galectin-3和LSECtin已被证明与LAG-3上的聚糖相互作用。Galectin-3属于Galectin家族,是一种由多种肿瘤细胞和肿瘤间质细胞分泌的可溶性半乳糖结合凝集素。LSECtin是C型凝集素家族的一员,主要在肝脏中表达。
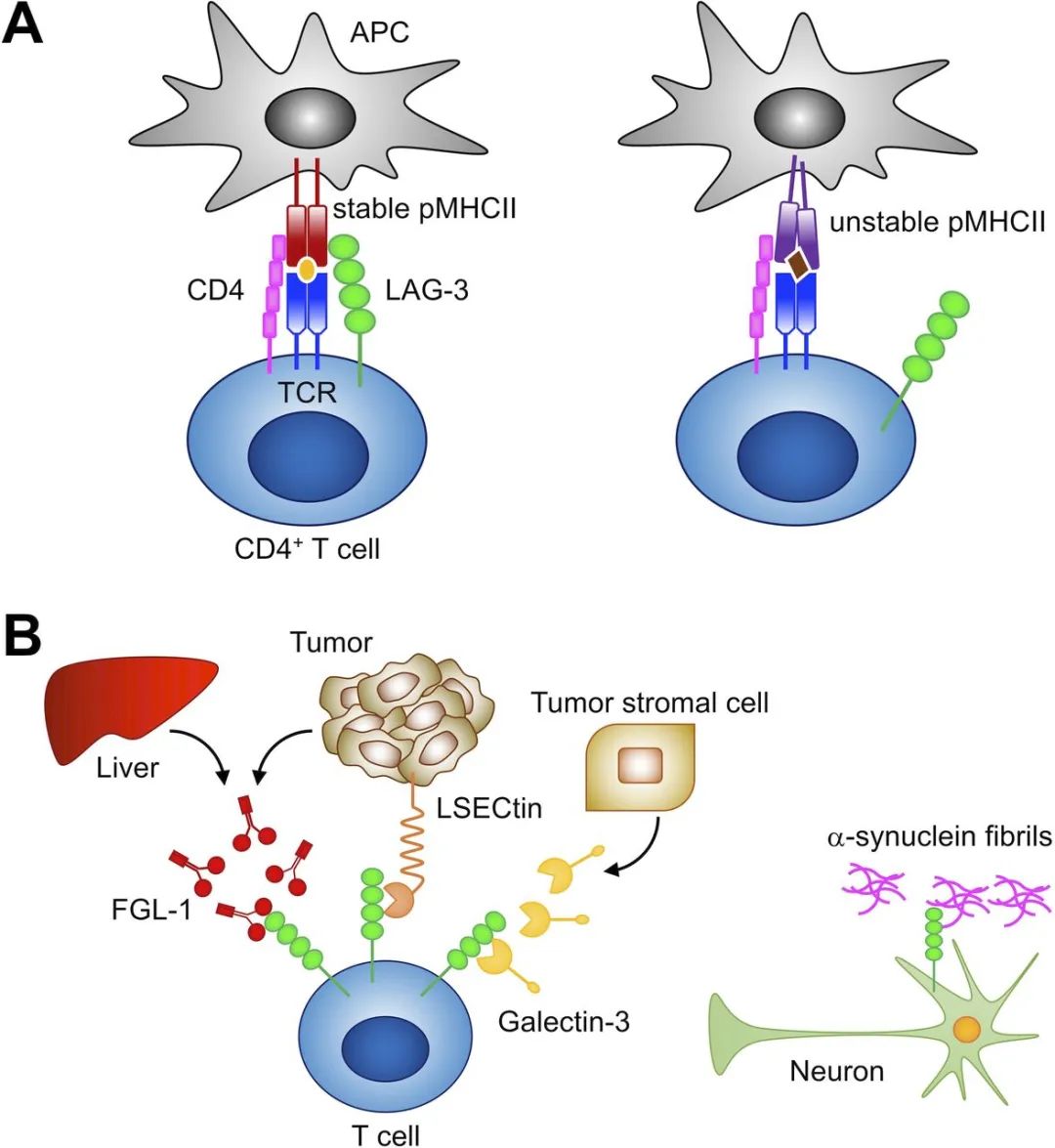
除了免疫抑制作用外,LAG-3似乎在神经系统中也有明显的作用。Mao等人报道LAG-3可以与α-突触核蛋白纤维结合,这与帕金森病的发病机制有关。α-突触核蛋白纤维与LAG-3的结合触发了α-突触核蛋白纤维的内吞作用、细胞间传递和神经毒性。
目前,共有108项临床试验正在评估19种不同的LAG-3靶向分子,包括39项I期试验、2项I/II期试验、40项II期试验,3项II/III期试验和3项III期试验。
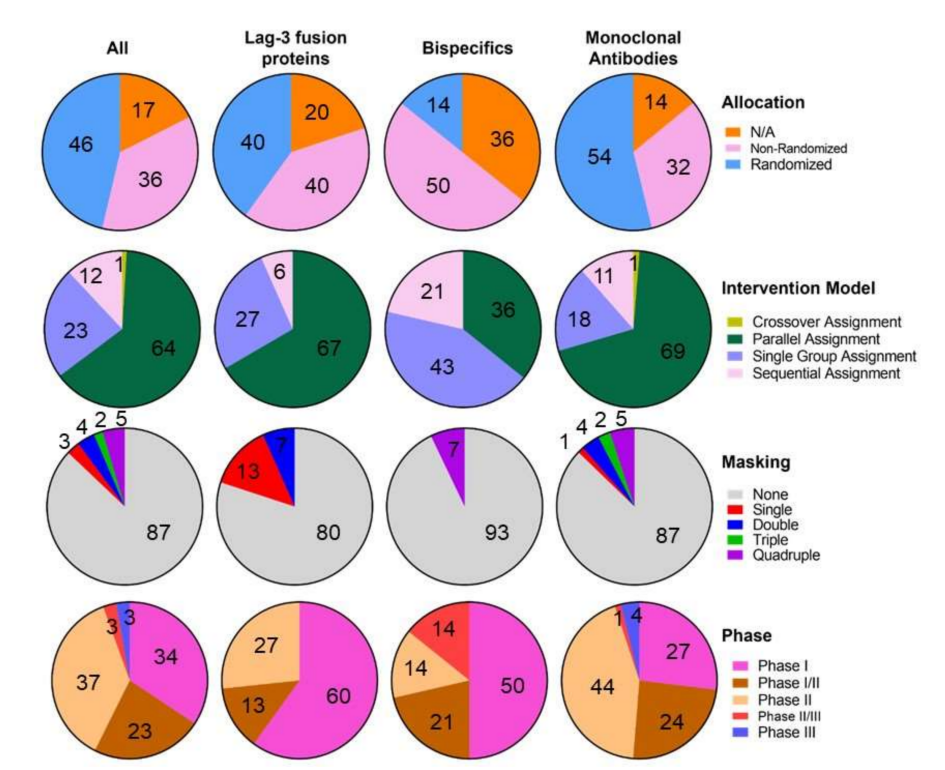
这些分子可分为抗LAG-3单克隆抗体(178项试验,10个分子)、双特异性抗体(14项试验,7个分子)、LAG-3融合蛋白(15项试验,2个分子)和CAR-T细胞治疗(1项试验,1个分子)。
目前,共有23项试验已启动但尚未招募,16项已完成,8项尚未招募,49项招募,9项终止,2项撤回,只有13个有可用的结果。经治疗的肿瘤包括大多数血液瘤和实体癌,但也包括银屑病、溃疡性结肠炎等自免疾病。
目前,78项临床试验正在评估10种不同的抗LAG-3单克隆抗体:relatlimab、GSK2831781、HLX26、IBI110、INCAGN02385、LAG525、MK-4830、REGN3767,Sym022、TSR-033。其中,21个I期、19个I/II期、24个II期、1个II/III期和3个III期。7个I期和II期试验仅评估单药治疗,其余试验主要与其他ICIs(如抗PD-1)联合评估。
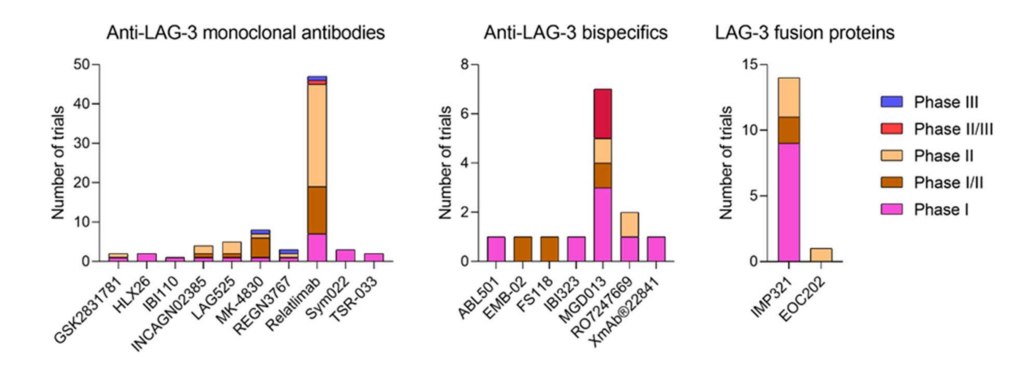
百时美施贵宝开发的BMS-986016(relatlimab)是第一个临床开发的抗LAG-3单克隆抗体,也是第一个获得FDA批准用于临床的单克隆抗体。其拥有最多的临床试验,已有结果表明,单独或与抗PD-1/PD-L1阻断免疫疗法联合使用,具有良好的耐受性和有效性,是克服免疫疗法耐药性的良好替代方案。
GSK2831781来源于IMP731,葛兰素史克在3项银屑病和溃疡性结肠炎临床试验(2个I期和1个II期)中进行单一疗法开发。溃疡性结肠炎II期试验在中期分析后终止,但I期结果显示良好的耐受性、安全性和炎症调节特征。
由复宏汉霖开发的HLX26,在两个I期临床试验(NCT05078593和NCT05400265)中,其安全性、耐受性、药代动力学特征和初步疗效正在实体瘤或淋巴瘤患者中单独评估,并与抗PD-1治疗相结合。
信达开发的IBI110正在一期临床试验中单药以及与抗PD-1联合用于复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)患者(NCT05039658)。
INCAGN02385由Incyte开发,在4个临床试验中单药(NCT03538028)或与抗PD-1和抗TIM-3联合开发(NCT437004、NCT05287113、NCT04586244)。初步数据显示耐受性良好。
由诺华开发的LAG525,在5项临床试验中单药或与抗PD-1阻断剂联合开发。初步数据表明,其具有良好的药代动力学、抗肿瘤活性和安全性。
默克公司开发的MK-4830(favezelimab),在8项临床试验中单药或与抗PD-1、化疗和靶向药物联合使用,显示出可管理的安全性和耐受性。
再生元和赛诺菲开发的REGN3767(fianlimab),在3个临床试验中进行评估,初步的临床试验结果显示出早期疗效和抗肿瘤活性,其与cemiplimab的组合也显示出良好的安全性。
Sym022由Symphogen公司开发,目前正在3个I期临床试验中评估单药(NCT03489369)或与抗PD-1和抗TIM-3免疫疗法联合(NCT0331412、NCT04641871)的剂量递增和剂量扩展。
TSR-033由Tesaro公司开发,正在两个I期临床试验中单药或与抗PD-1和抗TIM-3治疗联合评估(NCT03250832、NCT02817633)。第一阶段的初步数据表明安全性和耐受性良好。
ABL生物公司正在一期临床试验中开发ABL501,用于治疗任何进展性、局部晚期或转移性实体瘤(NCT05101109)。这种双特异性抗体同时阻断PD-L1和LAG-3。在体外研究中,其促进增强的T细胞活化,并通过DC活化增强T细胞的抗肿瘤反应。
IBI323是一种LAG-3/PD-L1双特异性抗体,由信达开发。目前,正在I期临床试验中单药或与化疗联合用于晚期恶性肿瘤患者,旨在评估IBI323的安全性、耐受性和有效性。
MGD013(Tebotelimab)是一种靶向LAG-3/PD-1的DART形式的双特异性抗体,由MacroGenetics开发,目前在7项临床试验中进行评估,用于治疗不可切除或转移性实体肿瘤。初步结果显示良好的耐受性、安全性和抗肿瘤活性特征。
RO7247669是一种LAG-3/PD-1双特异性抗体,由罗氏开发。目前在1期I和1期II临床试验中,用于晚期和/或转移性实体瘤(NCT04140500)以及晚期或转移性食管鳞状细胞癌(NCT04785820)患者。
XmAb®22841(pavunalimab)是由Xencor开发的一种靶向LAG-3/CTLA-4的双特异性抗体,正在一期临床试验(NCT03849469)中评估,单药或与抗PD-1联合用于晚期实体瘤患者。
EMB-02是一种LAG-3/PD-1的双特异性抗体,由EpimAb Biotherapeutics公司开发。临床前数据显示了在抗PD-1耐药模型中具有抗肿瘤活性。目前正在晚期实体瘤的I/II期临床试验(NCT04618393)中评估。
FS118是一种LAG-3/PD-L1的双特异性抗体,由F-star Therapeutics公司开发。目前正在针对晚期恶性肿瘤的患者中进行I/II期临床试验(NCT03440437),以确定剂量和毒性。初步临床试验数据显示了良好的药效和耐受性。
CB213 Humabody®是一种由Crescendo Biologics公司开发的靶向PD-1/LAG-3双特异性抗体,最近与英国癌症研究所(Cancer Research UK)建立了合作伙伴关系,将其临床开发纳入未来的一期临床试验。
IMP321(Eftilagimodα)是一种LAG-3可溶性融合蛋白,由Immutep开发。目前,共14个临床试验,用于治疗晚期实体瘤、乙型肝炎和流感。IMP321被开发为癌症和传染病疫苗的佐剂和免疫调节剂,以及抗癌治疗剂。数据显示,IMP321增强了T细胞活化和增殖、体液免疫、适应性免疫、细胞因子释放和抗肿瘤活性,具有良好的耐受性、疗效和安全性。
EOC202是一种重组人LAG-3融合蛋白,由亿腾景昂药业开发,用于HR+、HER2-治疗后进展的晚期乳腺癌患者。目前正在进行一项II期临床试验(NCT05322720),以评估EOC202联合白蛋白结合紫杉醇的药效和耐受性。
靶向抑制性协同受体PD-1和CTLA-4的检查点免疫疗法彻底改变了癌症治疗,而LAG-3作为新一代发现的抑制性检查点,有望成为肿瘤治疗中极具前景的靶点。LAG-3在调节T细胞稳态中起关键作用,作为T细胞活化、增殖、细胞因子分泌和效应器功能的抑制分子。目前,多种不同的LAG-3靶向分子正在多项临床研究中进行评估,显示出良好的临床结果。尤其Opdualag最近的获批,这是癌症治疗临床领域的一个重大里程碑。为更多更具前景的LAG-3靶向分子进入临床实践打开了大门,并将适应症扩展到其他恶性肿瘤,期待更多LAG-3相关药物获批,为癌症患者带来更多的福音。
参考文献:
1. LAG-3: from molecular functions to clinical applications. J Immunother Cancer. 2020 Sep;8(2):e001014.
2. The Next-Generation Immune Checkpoint LAG-3 and Its Therapeutic Potentialin Oncology: Third Time’s a Charm. Int J Mol Sci. 2021 Jan; 22(1): 75.
3. Cutting-Edge: Preclinical and Clinical Development of the First Approved Lag-3 Inhibitor. Cells.2022 Aug; 11(15): 2351.






