以下文章来源于医药速览
自2001年Crews等人提出PROTAC(Proteolysis Targeting Chimeras,蛋白降解靶向联合体)概念后,异双功能分子开始进入人们的眼球。其靶向“不可成药蛋白”优势引发了业内科学家们的纷纷入海,但是考虑到“大姐”PROTAC并不适用于所有蛋白,其他异双功能分子“姐妹”如LYTACs、AUTACs、RIBOTACs、PHORCs/PhosTACs等等分子设计也被拓展开发,通过招募其他效应子,来弥补PROTAC的缺点,带领着靶向蛋白降解(Targeted Protein Degradation,TPD)领域迅猛发展。

Molecules Based on Functional Effectors”的综述,介绍了各类异双功能分子特征,分析优势及挑战,为未来TPD领域的开发策略提供了有效见解。
溶酶体靶向嵌合体——LYTACs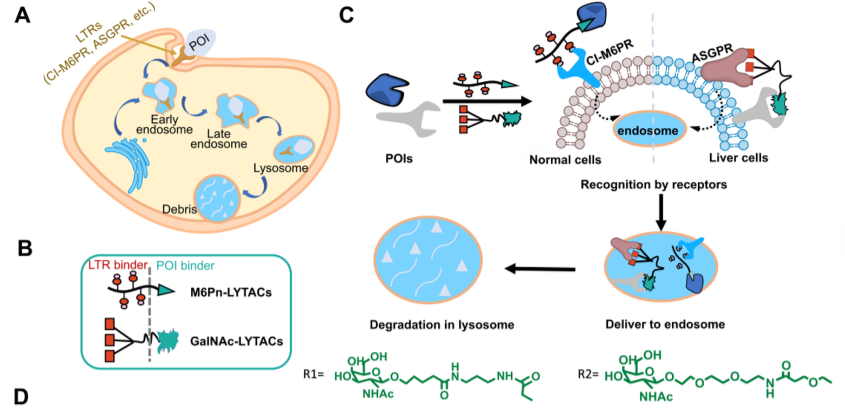
图1 LYTACs作用机制
除蛋白酶体降解系统外,内切酶体/溶酶体途径也是一种重要的蛋白质降解途径。LYTAC一端拽着与细胞表面跨膜受体CI-M6PR结合的低聚糖肽,另一端拽着靶向POI的抗体或小分子,中间linker连接,利用溶酶体通过将POI连接到LTR(溶酶体靶向受体)来发挥作用,诱导溶酶体介导的降解。该系统底物获取的调节主要依赖于LTR,如CI-M6PR和ASGPR。迄今为止,有两种LYTACs已开发,基于CI-M6PR(M6Pn-LYTACs)和基于ASGPR(GalNAc-LYTACs)。
LYTACs优势是靶向细胞外和膜相关的POI。LTR在大多数细胞表面广泛表达,为了避免LYTACs靶向仅表达LTR而非靶蛋白的细胞,非特异性糖基修饰抗体被很快清除,提高选择性和安全性及控制脱靶的药代动力学清除率也是亟待解决的问题。
自噬靶向嵌合体——AUTACs
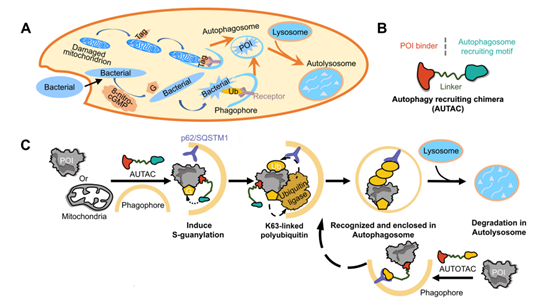
自噬系统在溶酶体介导的细胞内物质降解中起主要作用,使如受损的细胞器,细胞内碎片等等的底物降解。AUTAC通过招募自噬体选择性降解POI。自噬相关标签通过linker“贴”到POI配体,从而招募自噬相关通路分子。第一代AUTACs选择鸟嘌呤衍生物(cGMP)作为自噬标签来诱导内源性S-鸟苷化。在cGMP-HTL处理的细胞中,EGFP-HT(POI)的水平降低,证明了AUTAC的可行性。鉴于AUTAC由泛素依赖机制引发局限性,招募途径进一步改善,例如,靶向自噬的嵌合体(AUTOTACs)可以直接将受体p62绑在POI上并诱导POI的选择性自噬。
AUTACs/AUTOTACs进一步扩展了POI范围,包括聚集的蛋白质、细胞内碎片,甚至受损的细胞器。AUTOTACs适用于广泛的胞内靶蛋白,它们可以选择性降解聚集蛋白。
然而,AUTAC的发展仍面临许多挑战。例如,AUTAC的效率仍有待改进,对POI的降解对比其他嵌合体要花费更多的时间。此外,选择性问题仍有待阐明。AUTACs对体内整个自噬过程的影响仍有待探索。一些自噬关键机制尚不清楚,因此难以阐明AUTAC的确切机制和扩展AUTAC/AUTOTAC平台以利用其他标签或受体介导自噬。
核糖核酸酶靶向嵌合体——RIBOTACs
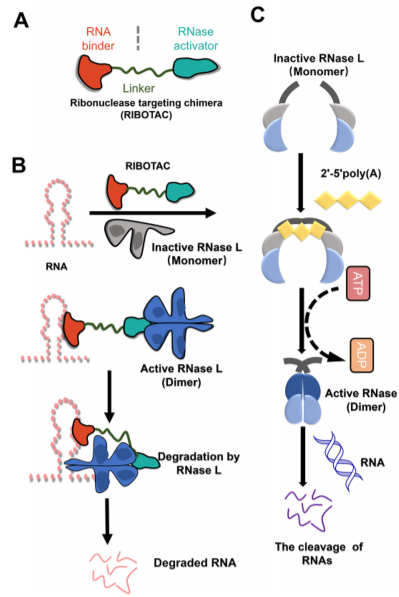
异常RNA与许多疾病有关。已经有进展的关于RNA寡核苷酸降解的方法如RNAi、ASO、CRISPR分子技术等等。新型降解RNA异双功能分子RIBOTACs,由RNA靶向配体,招募RNase部分,以及两者之间的一个接头组成,通过将内源性RNase募集到特定RNA、激活RNase并诱导靶RNA的选择性切割而发挥作用。
RIBOTACs提供了一种通过调节mRNA来解决无法成药的致病蛋白的替代策略。RIBOTAC可以为靶向多种类型的非编码RNA,可以看出其比蛋白质降解影响更多的疾病进展。
然而低渗透性是一个巨大的挑战。此外,高选择性的RNA小分子配体设计难度大,易脱靶。RIBOTACs可能不适用于在细胞核中发挥作用的RNAs。
蛋白磷酸酶募集嵌合体——PHORCs/PhosTACs
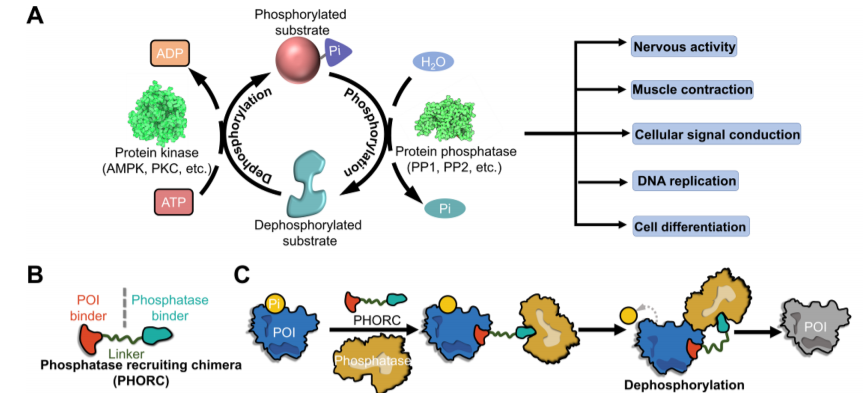
Yamazoe团队发现第一个PHORCs是PP1磷酸酶募集到AKT和EGFR附近,促进细胞中靶蛋白去磷酸化。在此基础上,Crews团队设计了另一种磷酸化靶向嵌合体(PhosTACs),它募集丝氨酸/苏氨酸蛋白磷酸酶 2A(PP2A)去磷酸化PDCD4(程序性细胞死亡4)和Forkhead-box O3a(FOXO3a,转录因子)。PDCD4和FOXO3a是潜在的抗癌靶点,具有抑制肿瘤的功能,并且它们的表达缺陷与许多类型的癌症有关。
PHORCs已成为通过改变靶蛋白磷酸化状态而不是其表达水平来精确调节其功能的有效工具,这可能可以避免其他蛋白质降解技术引起的副作用。因此PHORCs可用于PTMs的生物学研究和由异常高磷酸化靶标引起的疾病的治疗。然而,在PHORC的开发过程中仍有许多问题需要解决。如机制仍然需要阐明,非本地底物的去磷酸化,蛋白磷酸酶配体的相对短缺及其成药性(与细胞内渗透性差和细胞水解酶存在下的不稳定性有关)等等。
激酶募集嵌合体——PHICS
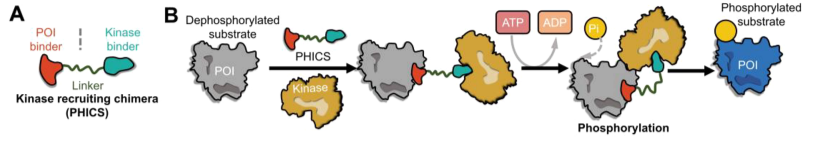
激酶通过将磷酸基团从ATP转移到蛋白质底物,在调节底物的磷酸化状态中发挥重要作用。PHICS由激酶激活剂、POI粘合剂和linker组成,通过诱导底物易位使它们靠近,募集激酶以磷酸化POI。
PHICS在精确治疗过度去磷酸化的致病蛋白方面具有巨大潜力,例如黑死病中的去磷酸化酪氨酸蛋白。然而PHICS在体内的疗效和成药性,如何保持去磷酸化或磷酸化POI的平衡仍有待确定,某些磷酸化位点与疾病进展之间的精确关系等仍有待验证。
乙酰转移酶招募异双功能分子——AceTAGs
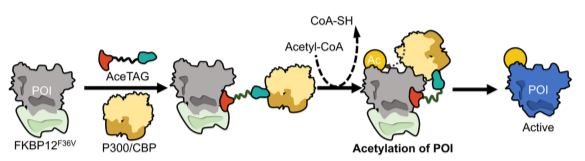
AceTAG,一种乙酰化标记系统,通过异双功能分子诱导POI的乙酰化。第一个AceTAG使用了与FKBP12结合配体连接的KAT抑制剂。这些异双功能分子调节了内源性KAT和FKBP12标记的POI之间的距离,从而诱导底物乙酰化。
AceTAG技术的优势在于:(1)可以提供高效和精确的乙酰化调节剂的空白;(2)与DNA重组技术结合可以使AceTAGs用于缺乏配体的POI,扩展了调节范围;(3)邻近诱导的乙酰化可以在不直接干扰POI结构或与其他PTM竞争的情况下调节POI的乙酰化状态,可以分析下游信号通路中乙酰化功能和探索乙酰化机制。然而,AceTAGs还有许多优化之处,如乙酰化位点诱导位点选择性乙酰化,KAT招募的异双功能分子的适用性等等。
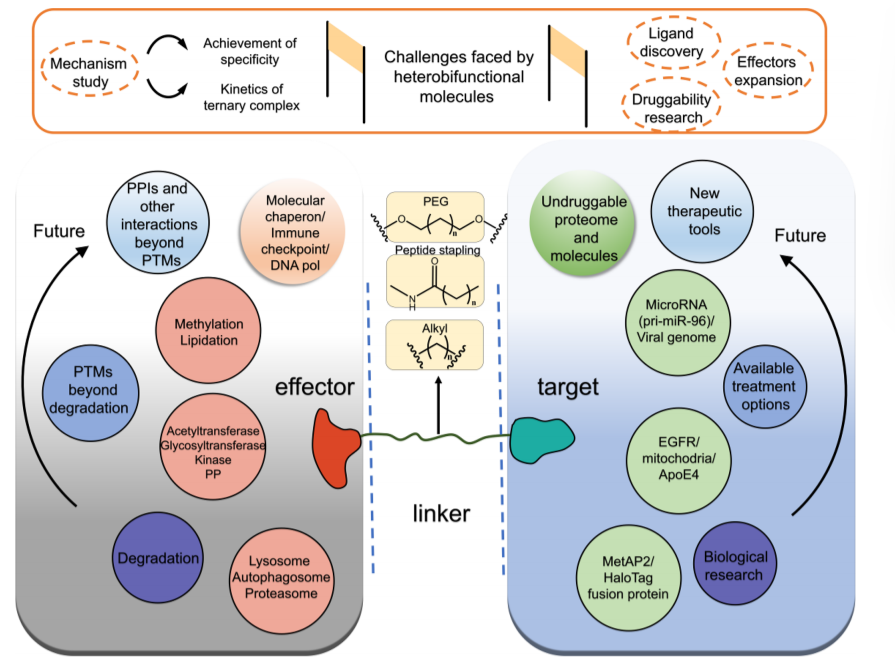
图7 异双功能分子的研究进展
PROTAC在蛋白降解领域的蓬勃发展打开了异双功能分子的大门,文章作者通过根据效应子进行分类来介绍PROTACs之外的异双功能分子。异双功能分子通过招募其上游效应物(如E3泛素连接酶、内体/溶酶体、RNase L、蛋白磷酸酶/激酶和乙酰转移酶)来调节POI的功能,以加速它们的相互作用。异双功能分子通过拉近“效应子”和“POI”的距离,充分丰富新型药物设计理念,在小分子药物的发现上掀起了浪潮。
但是,在异双功能分子开发过程中,技术还未成熟,面临着诸多挑战:
● 更深入的机制研究,主要包括嵌合分子对POI的特异性以及嵌合分子诱导的三元复合物形成的动力学。此外,三元复合物(效应子、POI和嵌合分子之间)形成过程中的动力学机制仍然未知。
● 开发高亲和力和选择性的配体,提高异双功能分子的活性。确定如何有效地招募效应子来介导生物过程是设计新的异双功能分子的关键挑战之一。
● 成药性。目前大多数已知的异双功能分子因其大分子量而表现出较差的PK曲线、溶解度和细胞渗透性。故而需优化其结构,对临床开发有重要意义。
研究者尚需开发招募更多内源效应子的异双功能分子,可以丰富靶向调节机制,如分子伴侣的调节、甲基化、脂化、免疫检查点和DNA合成。如果未来POI降解达到一个“万物皆可降解”状态,那么临床疾病治疗必会有大量milestone出现。






