遗传毒试验
表1.1 标准试验组合的两种选择

另,遗传毒性试验组合(包括体内和体外试验)检测的是主要通过直接的遗传损伤机制的致癌剂,如大多数已知的人类致癌剂。因此,这些组合不期望用于检测非遗传毒性致癌剂。
同时,还需注意,虽然体外试验阳性结果可提示药物内在的遗传毒性特征,但是,在大多数情况下,恰当的体内试验才能确定这些体外试验阳性信号的生物学意义。但,体内遗传毒性试验也具有给出误导性假阳性结果的可能性,而该结果并不提示具有真正的遗传毒性,如:1)未给予任何遗传毒性物质,但由于干扰了红细胞生成而导致微核率升高;2)DNA加合物数据应根据内源性加合物的已知背景水平进行解释;3)与毒性相关的间接作用可能影响DNA链断裂试验的结果(如碱洗脱和彗星试验)。
生殖毒试验
依据ICH指导原则“S5(R3)_人用药物生殖与发育毒性检测”、“S5药品的生殖毒性和雄性生育力毒性检测”,非临床生殖与发育毒性(DART)试验的目的是揭示与人类风险评估相关的药物对哺乳动物生殖的影响。在适当的情况下,所进行的一组试验应包含对一个完整生命周期(即从第一代的受孕至下一代的受孕)的观察,并可检测即时和潜在的不良影响。
表2.1 评估生殖的阶段&“三段”划分

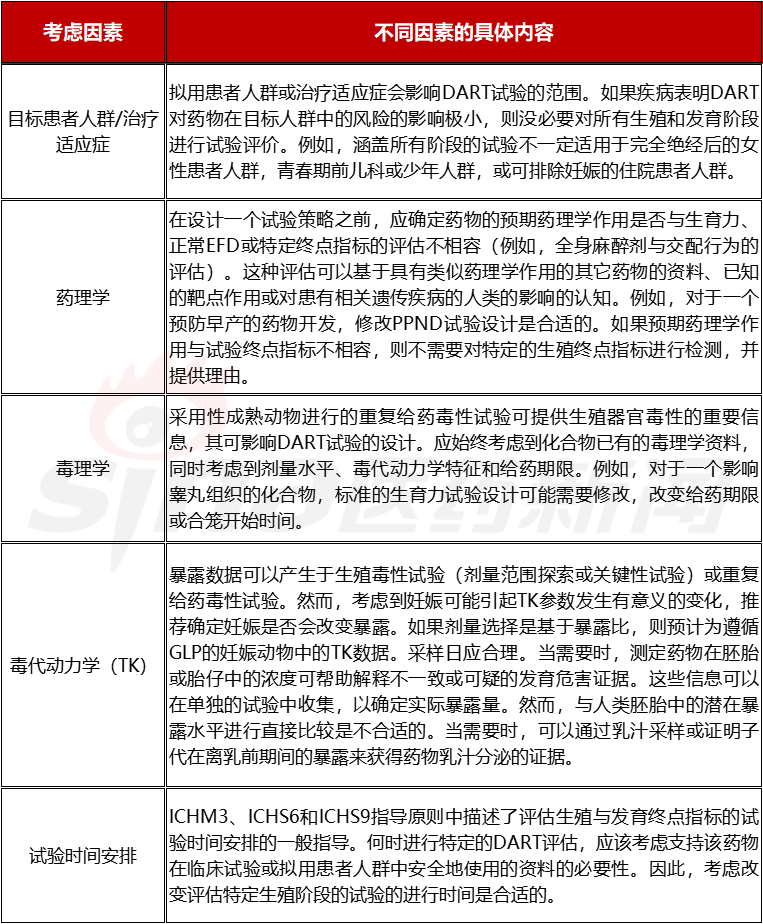
在以上试验分期的基础上,为了制定全面的综合试验策略,还需要考虑很多因素,如目标患者人群和使用条件(特别是与生殖潜力和疾病严重程度有关的);拟用于人的药物剂型和给药途径;毒性相关资料(也包括体外、离体和非哺乳动物试验的资料,以及结构-活性关系)、药效学、药代动力学,以及与其它药物的药理学相似性;药物靶点的一般生物学信息,或靶点在生殖或发育中的已知作用。具体如下表所示。
表2.2 生殖试验制订的相关因素
给药期限至少两周的重复给药毒性试验的结果通常可以用于设计生育力试验,而无需进行进一步的剂量范围探索试验,尽管如此短期限的试验不足以揭示所有的不良影响。
对于大多数小分子药物,通常在两种动物种属(即啮齿类动物和非啮齿类动物(通常是兔))中评价对EFD的影响;至少一种实验动物种属应显示出预期的药效学(PD)效应。
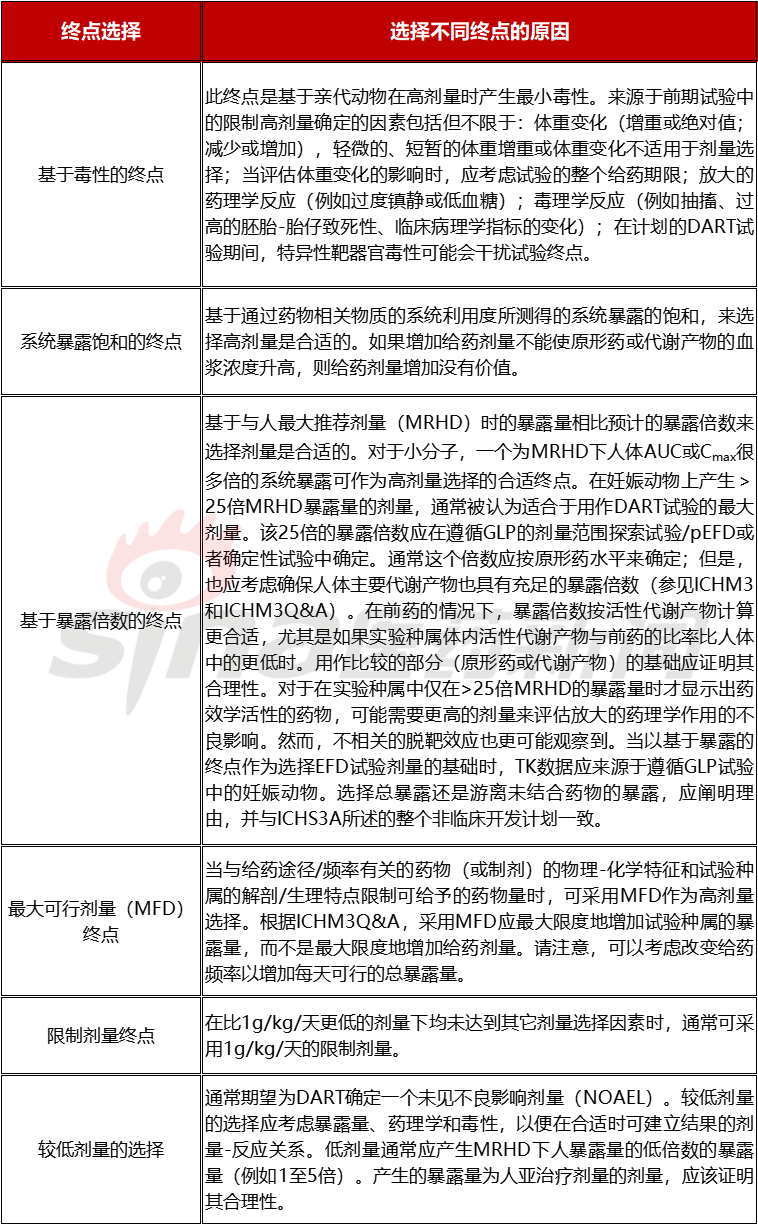
表2.3 基于不同终点的剂量选择依据
致癌试验
依据ICH“S1A:药物致癌性试验必要性指导原则”、“S1B:药物致癌性试验”、“S1C(R2):药物致癌性试验的剂量选择”,致癌性试验的目的是在动物中识别潜在致癌作用,从而评价人体中的相关风险。
由于致癌性试验耗时耗力,只有当人体暴露情况确实需要动物终生给药研究信息来评价其潜在致癌性时,才进行致癌性试验。
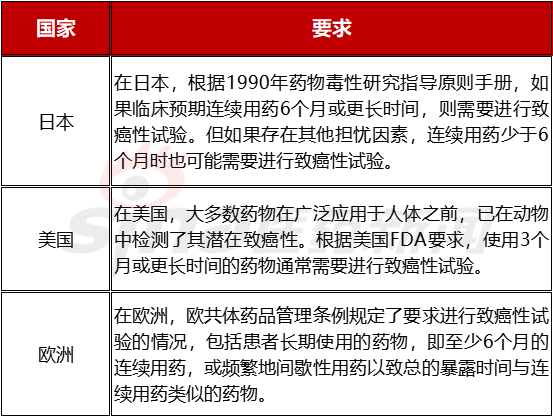
表3.1 开展致癌试验的临床用药周期依据
确定药物是否需进行致癌性试验的基本考虑是患者的最长用药时间及其他研究所出现的任何担忧因素,也可能会考虑其他因素,如拟用患者人群、与潜在致癌性有关的前期研究结果、系统暴露程度、与内源性物质的异同、适当的试验设计及与临床开发进程对应的试验时间安排等。
表3.2 致癌性试验应考虑的因素

表3.3 理想情况/剂量产生的暴露量

最后,针对致癌试验,我们来说说如何对结果进行判定。结果无外乎两种,阴性&阳性,阴性有哪些前提?阳性有哪些具体特征,总结见下表。
表3.4 阴性前提&阳性判定

综上,即为创新药有关遗传毒、生殖毒、致癌试验研究的大体体现。客观的讲,短短的几千字不足以概括出三个试验的精髓,尤其是具体问题具体分析+不同学科之间的数据汇总解读。但,没有办法的是,创新药总项目负责人必须对每个子学科都有一定的了解乃至深入;过程中需要对每个数据进行判定,需要对每个结果进行客观分析,否则,很难把控创新药的研发节奏以及走势。所以,当上述三个毒性试验出现阳性结果时,如何判定,如何解决,并客观理性的推动项目,才是创新药研究人员真正的研究能力之所在。






