<svg viewbox="0 0 1 1" style="float: left; line-height: 0; width: 0px; vertical-align: top; visibility: visible;" mpa-from-tpl="t"></svg>前言
中美药品监管机构通过设定加快上市程序(Expedited Programs)为那些具有满足临床急需医疗需求潜力或是有充分证据表明优于临床现有疗法的药品提供了上市加速渠道,以及相应的技术和政策支持。数据表明,上市加速程序的加速效果显著,其中,NMPA的优先审评审批政策可将药物审评时间从406天缩减至77天;FDA的突破性疗法认定则可将药物的开发时间从8年缩短至4.8年。
作者 | betaloc
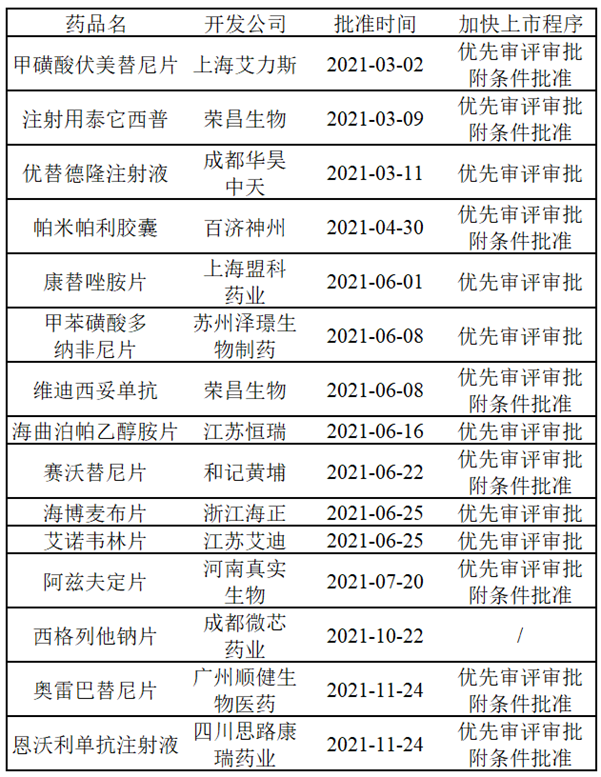
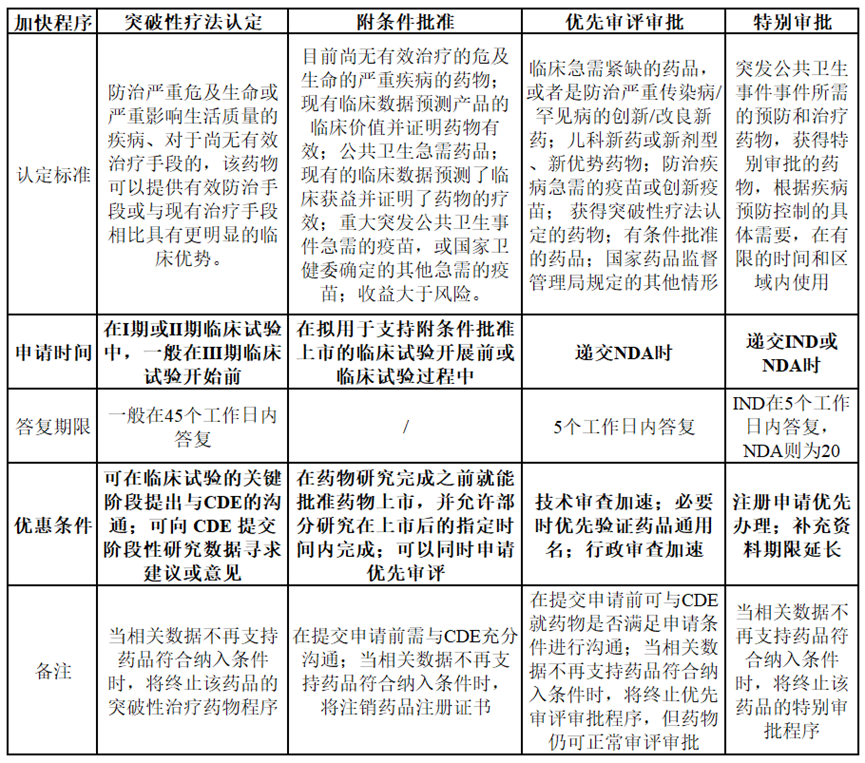
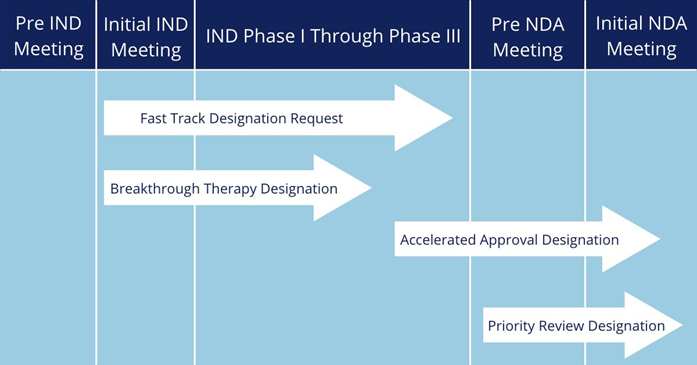
为了加快药物开发和上市,加速满足临床急需医疗需求,包括NMPA、FDA、EMA等在内的各国药品监管机构均颁布了相关加快上市程序。其中,NMPA在2020版的《药品注册管理办法》中,设立了“突破性治疗药物、附条件批准、优先审评审批、特别审批”四个加快上市程序,FDA则通过立法设立了“快速通道(Fast Track)、突破性疗法(Breakthrough Therapy)、再生医学先进疗法(Regenerative Medicine Advanced Therapy)、优先审评(Priority Review)、加速审批(Accelerated Approval)”五个加快上市程序。NMPA在2021年共批准了75个新药,其中16个新药通过优先审评审批和附条件批准加速上市,在获批的15款国产创新药中,更是有高达14款获得了优先审评审批或附条件批准,同年FDA批准的新药中则是有71%通过优先审评批准上市,足以见得申请加快上市程序对创新药开发的重要性。
那么什么样的新药才能申请到加快上市程序?申请到加快上市程序又能多大程度地加速新药上市呢?根据NMPA颁布的《药品注册管理办法》,将加快上市程序的相关特性总结如下:可以发现,能够获得加快上市的药物均是具有满足临床急需医疗需求的潜力或是有充分证据表明优于临床现有疗法,药品获得优先审评审批或突破性疗法认定后,可获得来自NMPA的政策和技术支持,包括但不限于必要的技术指导、与药品申请人的沟通、资源的优先分配和缩短审查时间等。由百济神州开发的泽布替尼(zanubrutinib)便是纳入加快上市程序的典型。一项入组86例患者的单臂II期临床试验结果显示,在复发性和/或难治性套细胞淋巴瘤患者中,泽布替尼的ORR率为83.7%,CR达到78%,房颤、第二肿瘤、肿瘤溶解综合征的发生率均为0,疗效和安全性均优于既往获批的BTK抑制剂,基于此,泽布替尼先后获得了NMPA的突破性疗法认定、优先审评审批以及附条件批准。更早之前同样也获得了FDA的突破性疗法认定以及加速批准,从递交NDA申请到加速批准上市仅耗时5个月。特别审批程序则主要适用于突发公共卫生事件所需药物,如COVID-19,2021年NMPA审结了81件纳入特别审批程序的注册申请(包括IND和NDA),均为新冠病毒疫苗和治疗药物,并建议附条件批准5件新冠病毒疫苗NDA。根据NMPA的2021年度药品审评报告,我们也能一探各个加快上市程序申请的成功率。NMPA在2021年共受理突破性治疗药物程序的注册申请263件,批准了其中的53件,成功率为20.1%;受理NDA共389件,其中有115件纳入了优先审评审批程序,占比29.5%。可以看出虽然成功率并不算高,但相比去年仍有明显提高,一方面说明中国新药的创新水平正不断提升,另一方面也说明药审中心的审评资源在逐年向具有临床优势的新药注册申请倾斜。FDA的加速政策与NMPA的相关政策大同小异,此处不再赘述。对于药品申请人来说,最关心的可能还是获得监管机构的加快上市认定后,到底能节约多长时间,可为自己的产品带来多大的先发优势。FDA加快上市程序
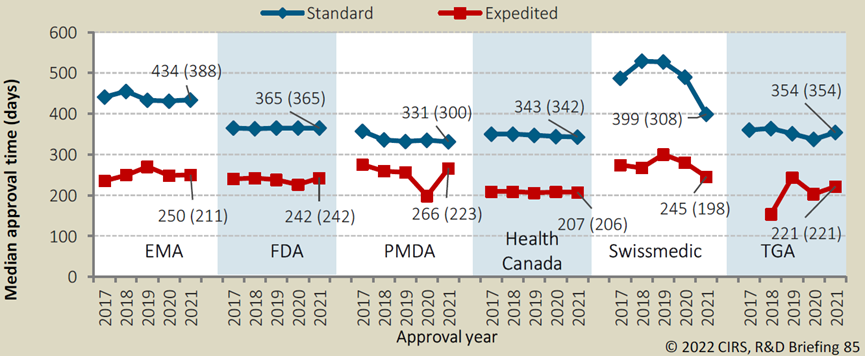
根据NMPA的规定,纳入优先审评审批程序的药品上市许可申请,审评时限为130日,其中临床急需的境外已上市境内未上市的罕见病药品审评时限为70日,而普通NDA的审评时限则为200天。另外,根据中国医学科学院肿瘤医院的研究报告,从2016年到2020年,获得优先审评审批资格的药品其中位审评时间仅为77天,而对普通审评审批的药品说,递交NDA后耗时的中位数为406天,显著长于纳入优先审评审批程序的药品。其他各国的药品监管机构的加快上市程序有着类似的效果。对于未获得优先审评资格的药品来说,在2021年,从向FDA递交NDA到获得批准上市的中位时长为365天,而优先审评的药品则可将这一时间缩短123天,大大加速创新药物的上市及临床应用。其他国家/地区如欧盟、日本、加拿大等的优先审评政策也均可缩短药品审评审批耗时26%-46%不等。各国监管优先审评vs普通审评耗时
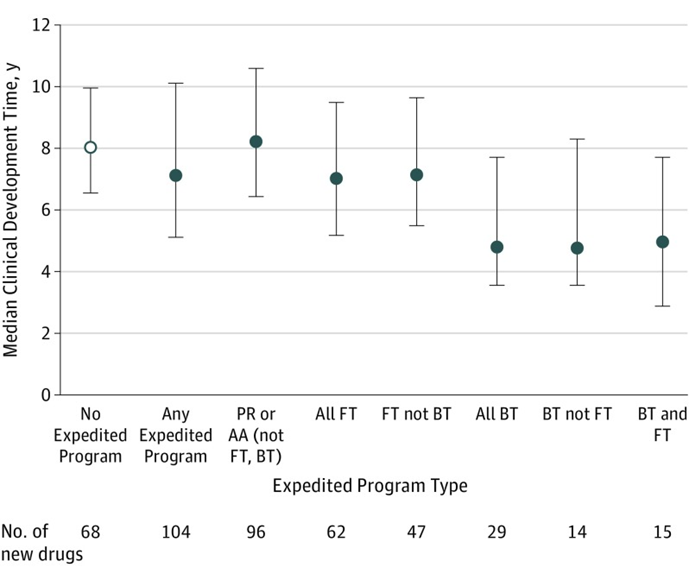
事实上,获得加快上市相关政策资格后,药物的临床开发时间同样可以得到节约。根据发表在JAMA的相关文章,获得一项FDA加快上市政策资格的药品中位开发时间(从IND申请到FDA首次批准的时间)为7.1年,相比没有任何加快上市政策资格的药品缩短了0.9年;尽管优先审评资格能够将药品的审评时间缩短4个月,但令人诧异的是,对于非突破性、非快速通道的药物,即使纳入优先审评或加速批准,他们与未获得加快上市资格的药物在开发时间上并没有显著差异;而对于被授予突破性疗法认定或快速通道资格的药品来说,开发时间则明显缩短,他们的中位开发时间分别只有4.8年和7.0年,尤其是突破性疗法认定,将药品的开发时间整整减少了40%,充分体现了突破性疗法认定的优势,更及时地为患者送去了急需新药,也为药企赢得了更长的上市独占期。
参考:
[1] 《Guidance for Industry Expedited Programs for Serious Conditions – Drugs and Biologics》
[2] 《药品注册管理办法》
[3] Wang S, Yang Q, Deng L. An overview of cancer drugs approved through expedited approval programs and orphan medicine designation globally between 2011 and 2020. Drug Discov Today. 2022 May;27(5):1236-1250.
[4] Hwang TJ, Darrow JJ, Kesselheim AS. The FDA's Expedited Programs and Clinical Development Times for Novel Therapeutics, 2012-2016. JAMA. 2017 Dec 5;318(21):2137-2138.
[5] 《2021年度药品审评报告》
[6] https://www.fda.gov/
* 推文用于传递知识,如有版权等疑问,请于本文刊发30日内联系BiG生物创新社。