以下文章来源于Claudisiran药药 ,作者机车宝贝
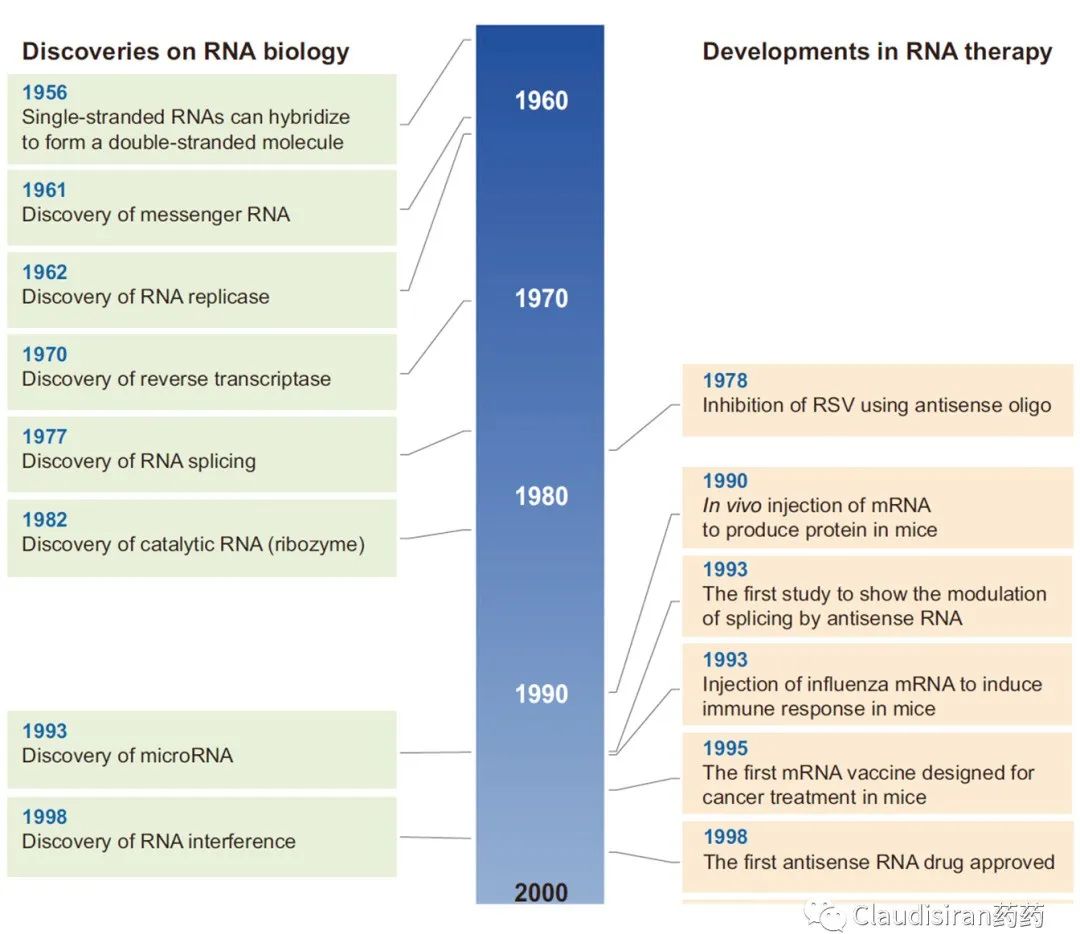
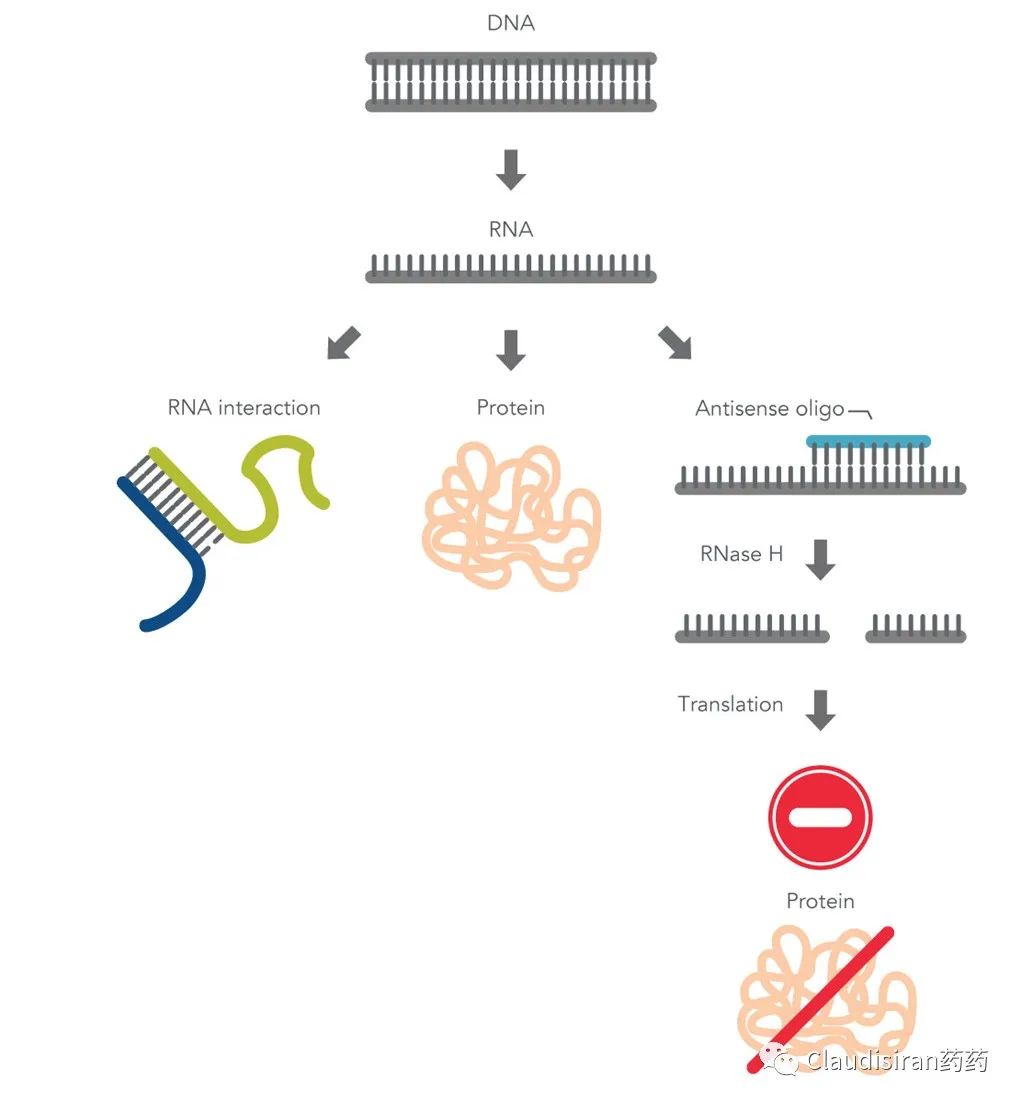
如果说发现RNA是起点,那么两条单链RNA可以base-pair的发现就是解锁RNA成药性的钥匙。RNA的发现可追逐到1890年,自此之后很长一段时间RNA都被认为只能以单链的形式存在。1939年,RNA被发现具有“合成/表达蛋白”的功能。直到1956年,MIT的生物物理学家Alexander Rich发现两条单链的RNA是可以像DNA那样结合(base pair)在一起形成双链。从此,科学家对于RNA功能的认知也不再局限于蛋白的表达。随后的20多年里,一系列关于RNA的功能陆续解密。其实RNA自身的功能非常有限,大多时候它只是在扮演一个“ID”,通过独特的核酸编码作为“身份确认”。而与RNA相关的诸多细胞功能其实需要靠一系列的辅助蛋白或蛋白组件来实现。例如:帮助mRNA翻译为蛋白的ribsome,帮助RNA转成DNA的reverse transcriptase,使同一段pre-mRNA产生各种各样蛋白产物的spliceosome等等。
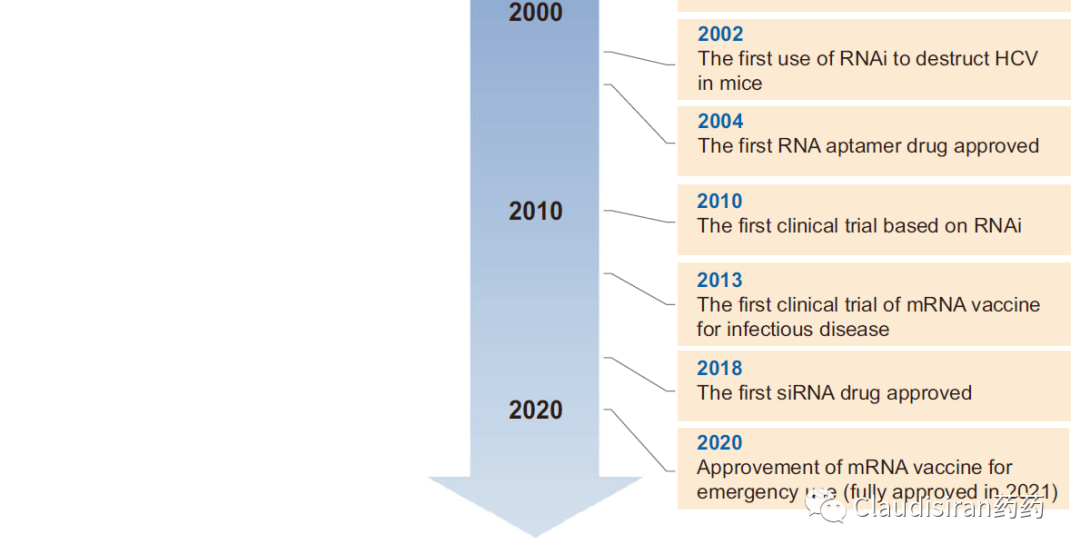
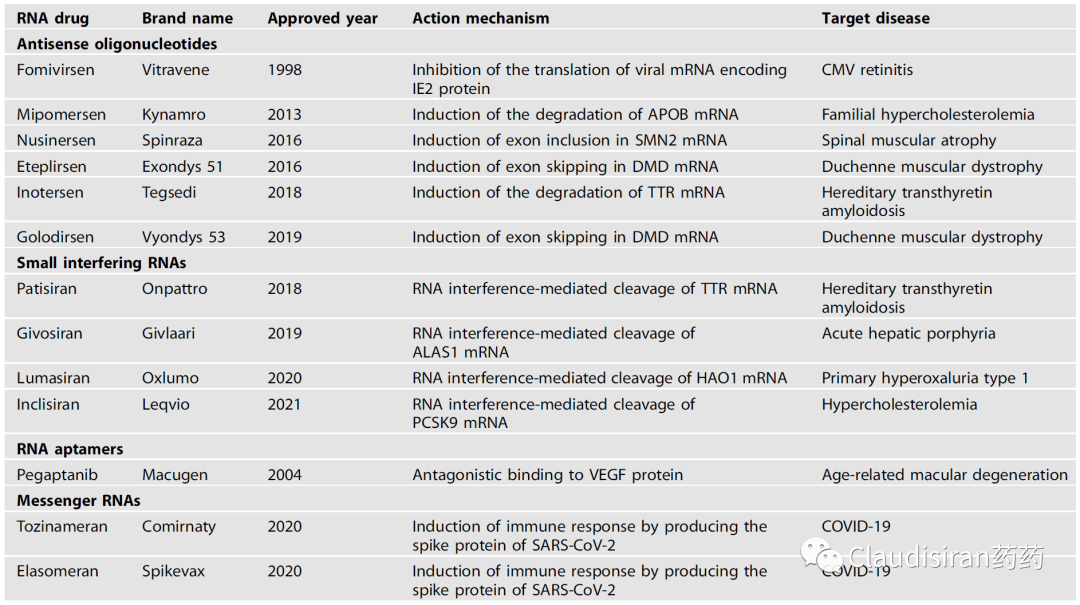
当科学家们足够了解这些RNA相关的“基本工具”后,就可以开始利用它们的功能来研发药物了。自1980年起,生物医药行业对RNA疗法的研发明显升温。但这个阶段还是以临床前动物模型为主,主要探索antisense和mRNA两大类技术在蛋白补充、抗感染和肿瘤等疾病领域的潜力。1998年,行业迎来第一个RNA药物的上市,由Ionis研发的Vitravene (Fomivirsen),用于治疗HIV患者的眼部CMV病毒感染。2014年,由辉瑞和Eyetech联合研发的用于治疗wAMD的Macugen(pegaptanib,RNA-aptamer,VEGF)上市。是的,没错,早在贝伐珠单抗问世之前就有靶向VEGF的黄斑病变眼药。然而,由于RNA稳定性(及其他化学性质)、递送技术等难关很难在短时间内被攻克,RNA领域并没有复刻当年重组蛋白技术那种“一旦突破,遍地开花”的盛况。直到2018年,行业才迎来第三个上市品种,由Alnylam研发的用于治疗hATTR的siRNA药物,Onpattro (patisiran)。再接下来的故事我们就很熟悉了,2020年,新冠mRNA疫苗问世;但如果不是因为疫情,也许至今还没有任何mRNA药物上市。截至目前,FDA一共批了13个RNA药物/疫苗,其中包括6个ASO,5个siRNA,1个aptamer,2个mRNA。从下表不难看出,除了两个新冠疫苗和用于治疗高血脂的inclisiran,大部分RNA药物都是用在罕见病上,DMD(肌营养不良蛋白)尤其多。这主要跟疾病机理有关,DMD为单基因,不同位点突变的疾病。治疗思路简单清晰:只要用ASO技术将突变的部分从转录的mRNA中删除(splice-out)就可以了。
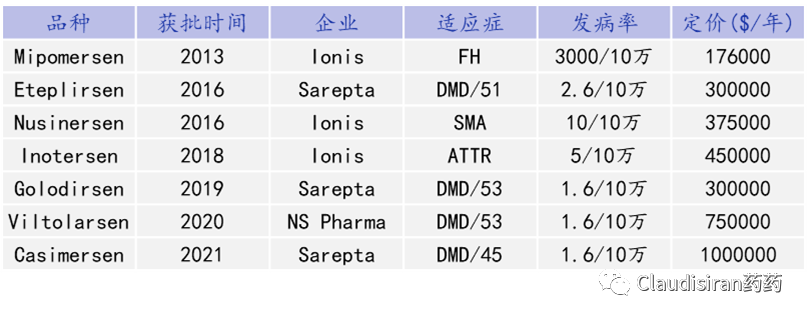
通常,基于一项新技术开发药物的biotech公司研发风险都比较高。所以选择一个不太拥挤的,没有特效药SOC的赛道进入市场比较稳妥。一方面疗效门槛比较低,另一方面可以避免与大药企正面竞争。此外,由于患者数量十分有限,所以通常罕见病药物售价都非常高。这样一来,一方面可cover药企的研发投入,另一方面也不需要太多的市场推广费用。
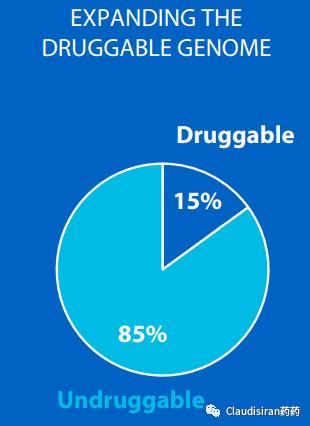
其实之前我们在Amgen那一期讲过,所谓“低垂的果实”,实际上就是比较容易用小分子或者抗体去靶向的蛋白靶点。而这部分其实只占人类基因组中已知致病靶点的15%。剩下的85%空间虽大,但传统制药方式很难成药。其中一大主要难点在于蛋白结构复杂,无法找到合适的结合位点。而RNA疗法可以在蛋白表达之前将其扼杀于摇篮,不受蛋白结构的限制。而且RNA疗法所靶向的不仅限于表达蛋白的codingRNA,还可以从noncoding入手,调控一些非蛋白突变直接引发的疾病的MOA,要知道human genome中的noncoding region数量远远大于coding region(格局打开,空间打开)。
很多人体蛋白是分大类的,同一个类别中不同的蛋白往往在功能和结构上会有一定的相似性。这就给以蛋白结构为基础的小分子药物研发带来了一定的挑战。不少药物因特异性/选择性不够高而伴随不可避免的副作用,导致即便找到了靶点、可结合的分子,也没有合适的therapeutic window。而每个RNA都有自己独特的序列,必须是与之相匹配的序列才可确认为其靶点,精准的特异性/靶向性/选择性很大程度上避免了脱靶的问题。
RNA疗法并不像小分子或抗体药物那样“一事一议”。只要攻克了递送和化学性质的问题,整套技术流程可以快速运用到同种递送组织的其他疾病。新冠疫苗之所以可以快速研发上市,就是因为肝脏递送技术早在2020年以前就已被基本攻克。
以前开发RNA药物最大的难题之一就是RNA不够稳定,容易被降解。然而现在的技术已经可以支持半年一次给药,不但省钱省事,副作用小,更可以让患者体验到不必每天被吃药给“绑架”,disease-free的感受。
目前已获批的RNA疗法分为3大类,他们的分子大小、作用机制、功能等方面都有明显区别。我们先从最明显的区别入手,nomenclature(命名法)。3)mRNA:后缀“-meran”,例如新冠疫苗tozinameran(辉瑞+BioNTech)、elasomeran(Moderna)。
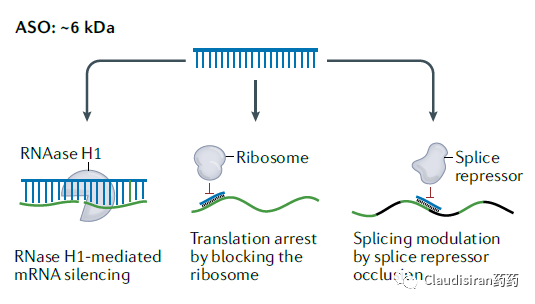
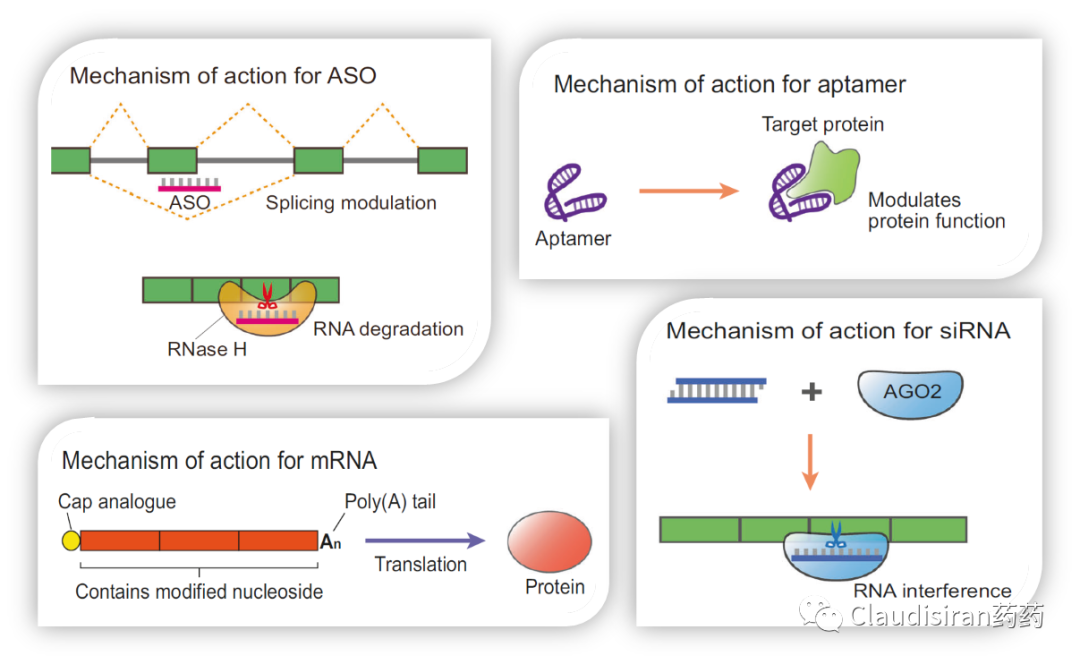
Antisense oligonucleotides,反义寡核苷酸。单链,分子量相对较小约6kDa。主要通过mRNA silencing、抑制ribosome翻译蛋白、调节RNA splicing等机制治疗疾病。
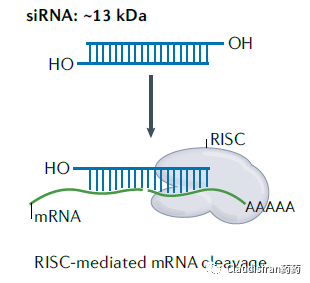
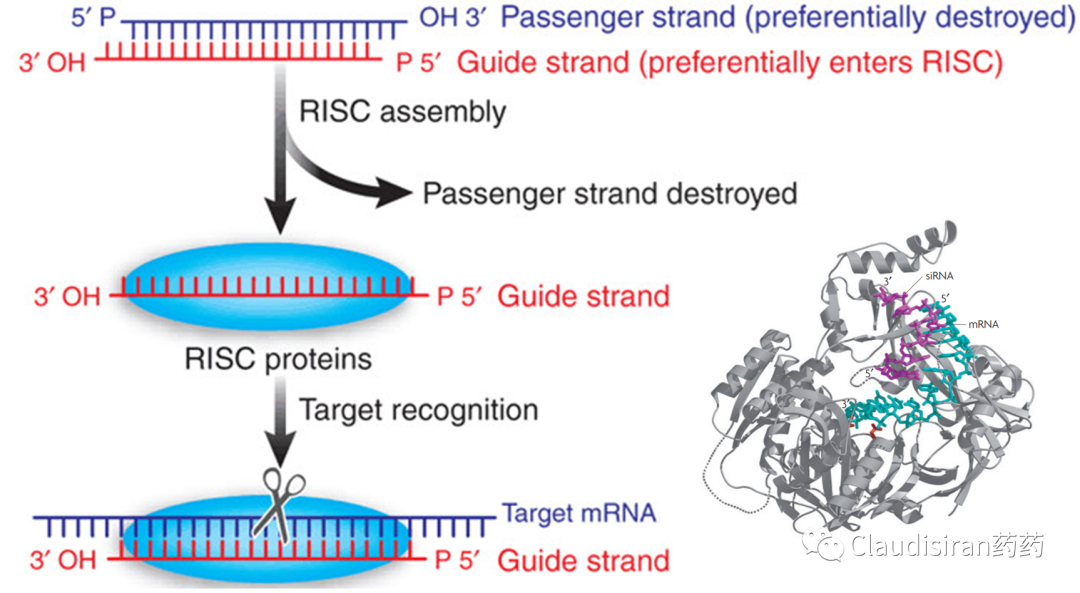
Small interfering RNA,小分子干扰RNA。通常以双链形式存在,单链形式起效。分子量居中,约13kDa。主要通过RISC(RNA-induced silencing complex)抑制目标mRNA翻译为蛋白,or silencing。
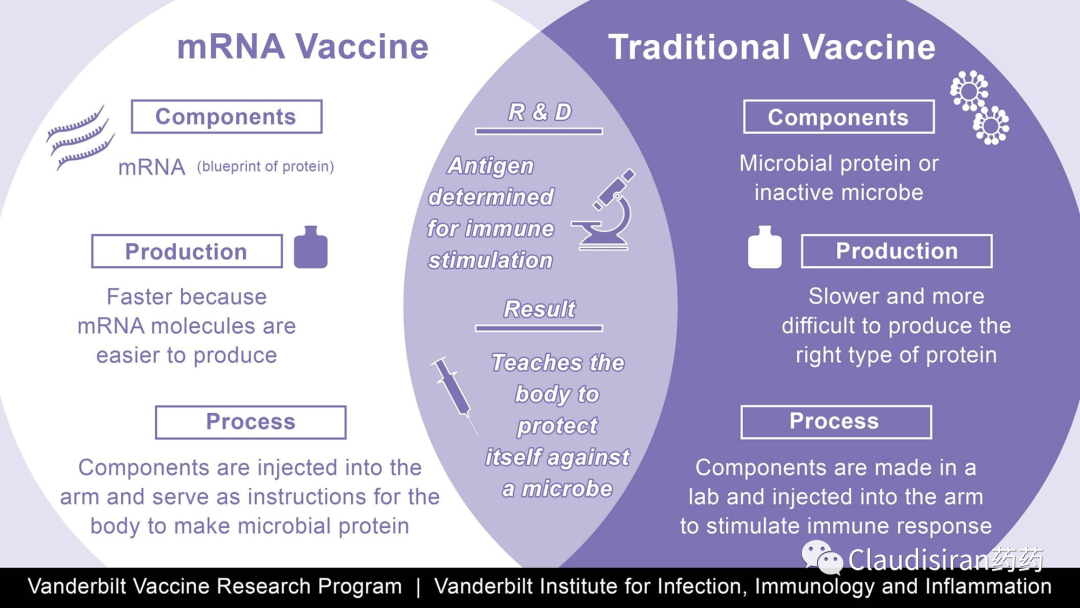
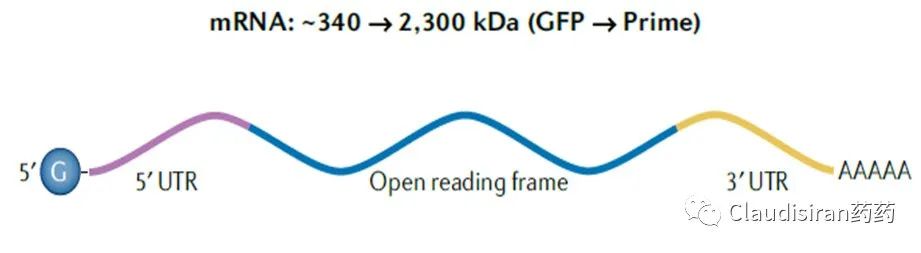
messenger RNA,信使核糖核酸。单链,分子量大,且跨度大,约340~2300kDa。主要作用为蛋白的表达,所以通常用作蛋白补充疗法,或者抗原呈现等。
<svg xmlns="http://www.w3.org/2000/svg" viewbox="0 0 494.52 127.53"></svg>
cleave and degrade切断RNA并使其降解
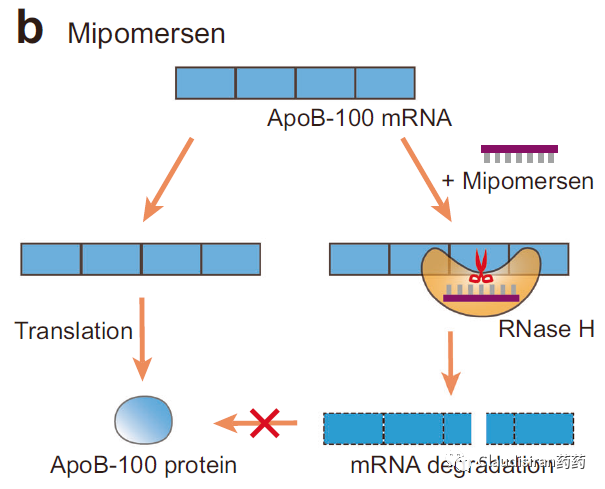
ASO先锁定目标RNA,然后通过RNase H.将目标RNA切断,从而使蛋白无法表达。由于RNase H.存在于细胞核内以及核外,所以ASO不止作用于mRNA,也可以调控一些noncoding(非编码)RNA。事实上科学研究发现很多没有明确蛋白靶点的疾病发病机制都与noncoding RNA有关。而这也是ASO相对于siRNA的优势,因为绝大部分siRNA只能在细胞核外工作。由Kastle研发的治疗高血脂的Kynamro(mipomersen),现已discontinued。该品种靶向apolipoprotein B-100(ApoB-100)的mRNA。ApoB-100是LDL的主要构成要素。近期,由GSK和Ionis联合开发的潜在HBV功能性cure品种bepirovirsen刚刚公布了积极临床数据。Bepirovirsen也是属于这类cleave°rade品种,作用于几乎所有HBV病毒的mRNA(这跟HBV的genome有关)。
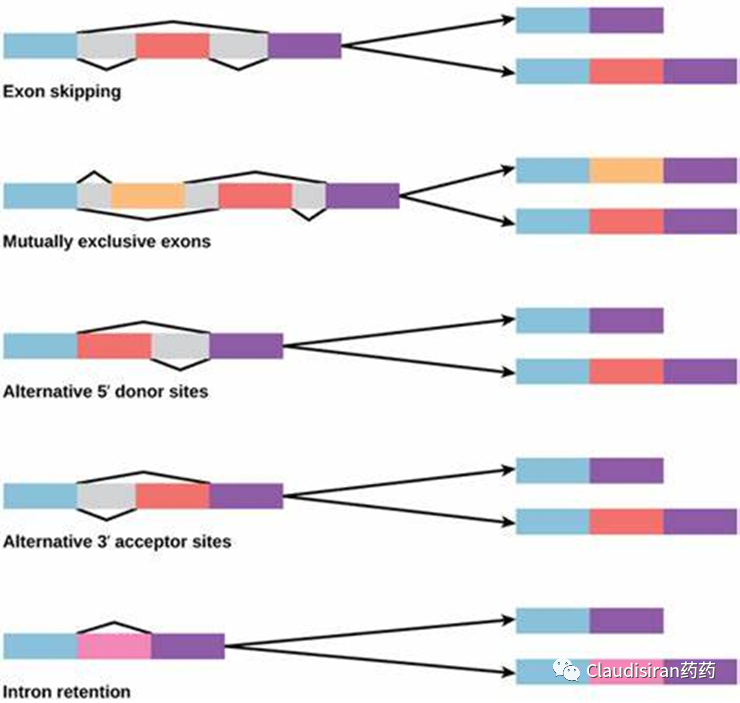
同一条pre-mRNA上有多个exon,通过不同的剪接方式拼接这些exon,可以产生多个不同的mRNA以及相应的蛋白。如果某个exon有突变,可以直接将其删除,或者修正本不该被删除的片段。
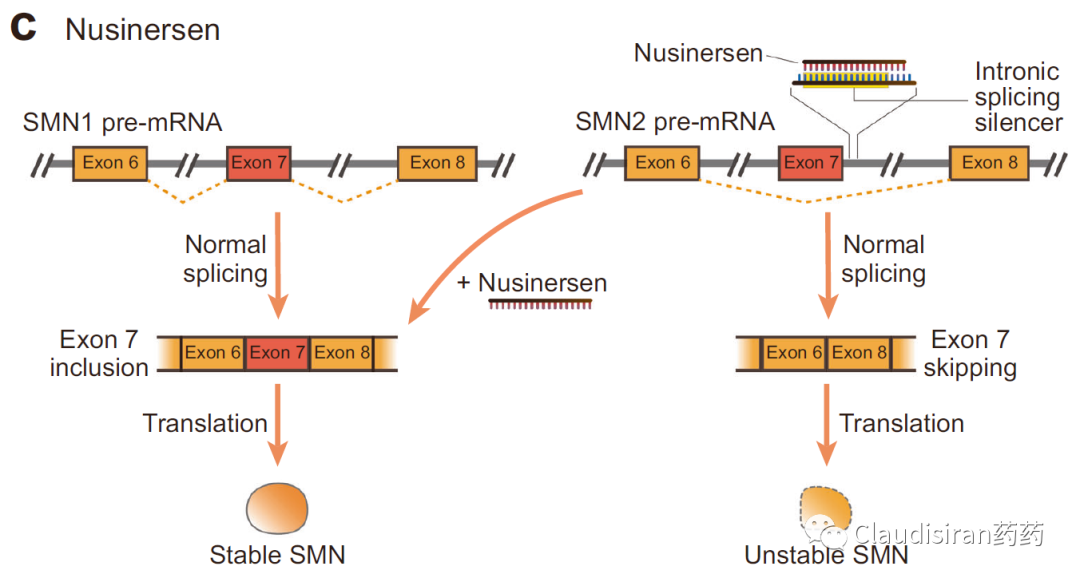
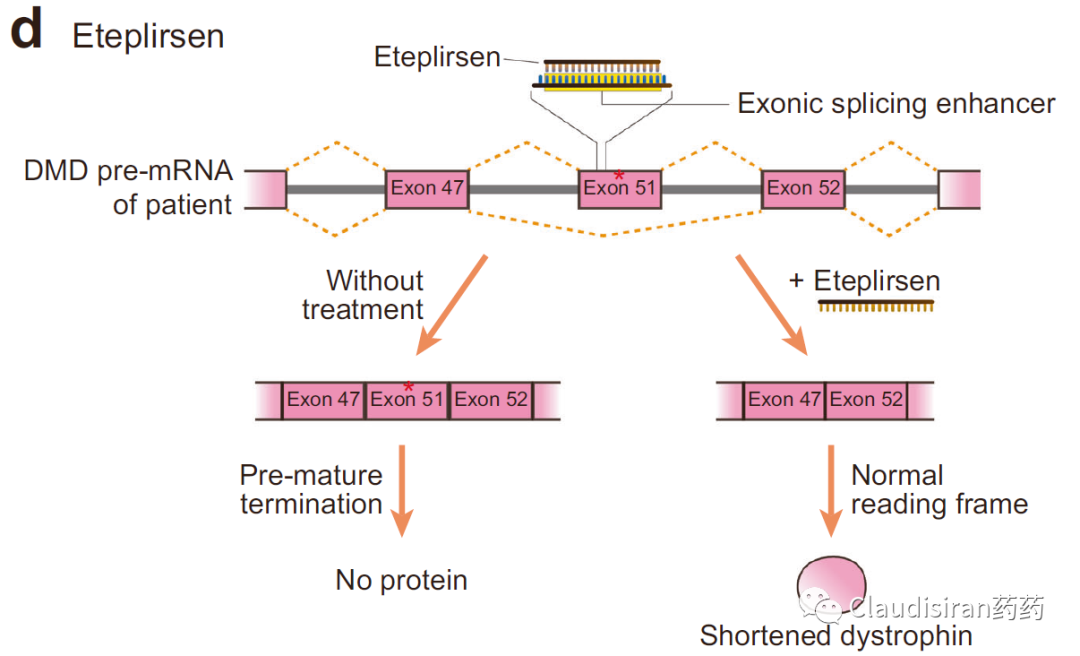
由Biogen/Ionis研发的治疗SMA(脊髓性肌萎缩)的Spinraza(nusinersen)。SMA患者的SMN1基因出现突变,导致该locus无法表达SMN蛋白。还好还有一个SMN2基因,可以产生少量的SMN蛋白。但是正常情况下,SMN2的mRNA在被splice的过程中删除了exon7(正常的SMN1保留了exon7),导致最终生成的蛋白比较小,且不够稳定。Nusinersen的作用则是确保SMN2的mRNA保留住exon7,使最终的蛋白产物与正常SMN1产生的蛋白相似,提高稳定性,达到治疗效果。由Sarepta研发的治疗DMD(肌营养不良)的Exondys 51 (eteplirsen)。患者的DMD基因上exon51处有一个突变导致无蛋白表达(pre-mature termination)。Eteplirsen则是让mRNA在splice的过程中直接删除exon51,跳过有突变的部分,使蛋白正常表达。虽然重新被剪接的蛋白比正常蛋白小一些,但保留了正常DMD蛋白的基本功能。<svg xmlns="http://www.w3.org/2000/svg" viewbox="0 0 494.52 127.53"></svg>siRNA通过序列确认找到目标RNA,然后与Ago蛋白结合形成RISC(RNA-induced silencing complex),破坏目标mRNA,达到沉默效果。
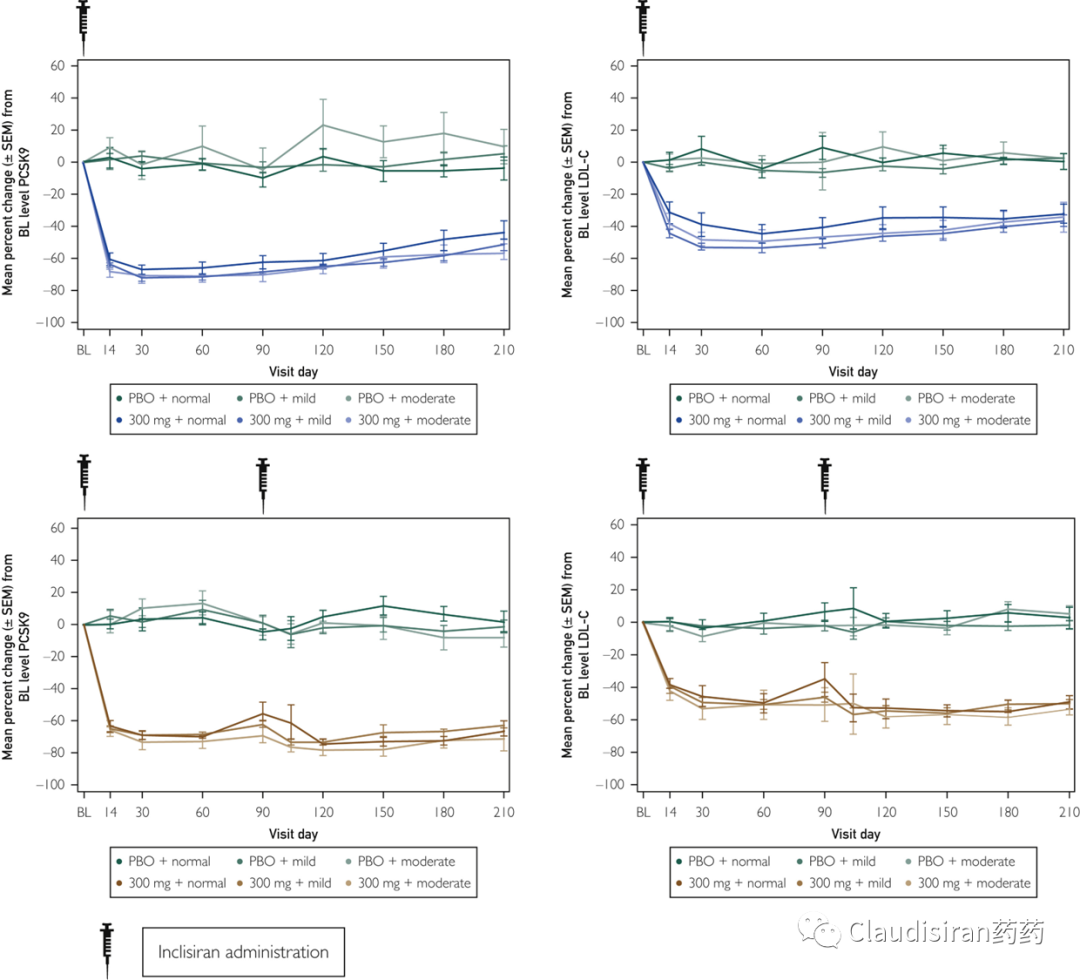
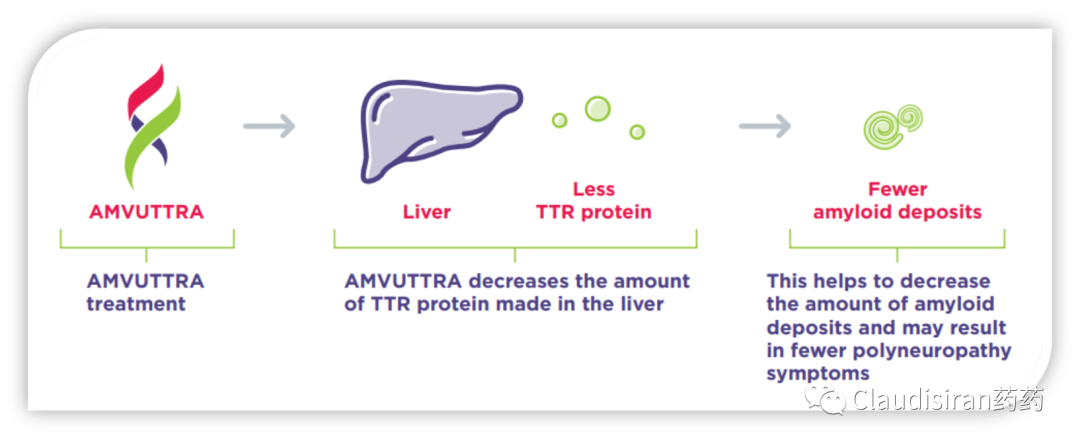
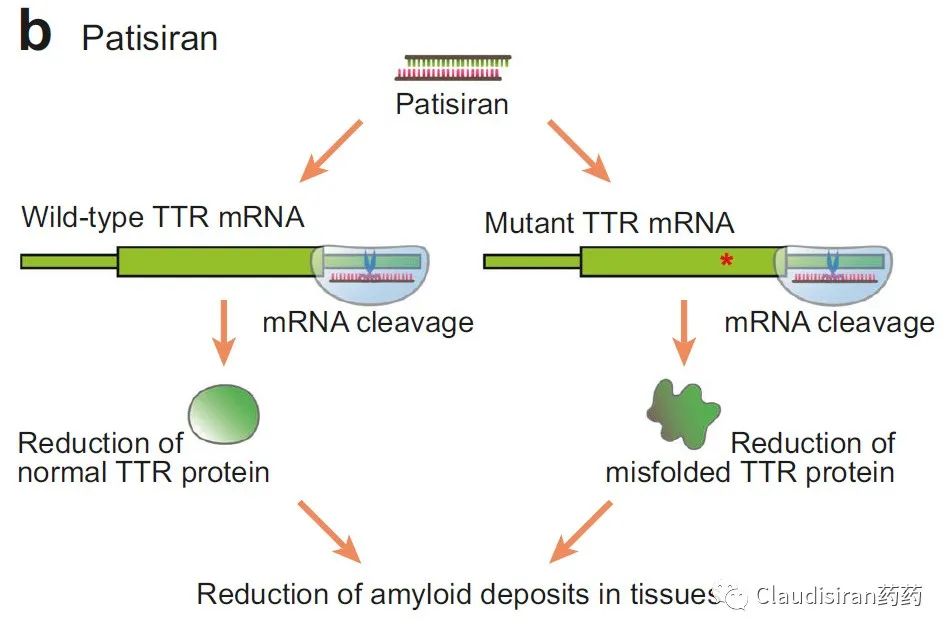
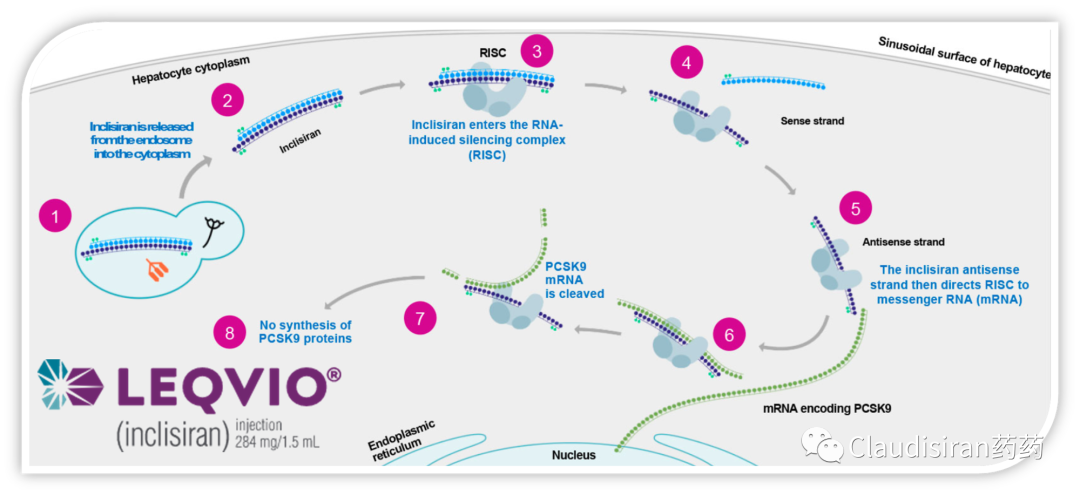
由Alnylam研发的两款治疗hATTR品种,patisiran和vutrisiran。二者都是靶向突变的TTR基因/mRNA,主要区别在于p用的第一代LNP递送技术,需要静脉注射,v则是新一代独家ESC-GalNAc技术,更稳定,递送效率更高,可以皮下注射。hATTR(遗传性转甲状腺素蛋白淀粉样变性)患者的TTR基因突变,导致表达出来的蛋白折叠出问题,异常的3D结构会使同类病变蛋白聚集在一起,形成淀粉样蛋白堆积,物理性影响身体各组织正常功能。所以治疗疾病的关键在于从RNA层面抑制TTR蛋白的生成,从而降低蛋白堆积。由于patisiran/vutrisiran并不直接靶向TTR mRNA突变的位点,所以该类药物也会影响正常TTR的表达。由Alnylam和诺华联合开发的Leqvio(inclisiran),靶向PCSK9mRNA,用于治疗家族性高血脂。该品种是RNA药物研发历史上第一个用于治疗常见病的超长效品种,可半年注射一次。至此,心血管疾病从慢性病治疗从此进入长期“预防”模式。PCSK9的作用是回收细胞表面的LDL受体,而LDL受体的功能是捕获血液中的LDL,从而降低血脂。下调PCSK9的表达则可以延长/提高LDL受体的降血脂功能。