干扰素基因刺激因子(stimulator of interferon genes, STING) 作为参与固有免疫反应的关键信号转导分子,被来自病原体和宿主的胞质DNA触发,在诱导Ⅰ型干扰素和促炎性细胞因子分泌、防御病毒及胞内细菌感染、调节体内自发性抗肿瘤免疫反应产生过程中发挥重要功能。
STING激动剂能够有效治疗病原体感染和癌症。近10年来,对STING及其激动剂的研究发展迅速。本文从STING的结构和激活、cGAS-STING通路的机制等方面概述了STING的最新研究进展,尤其对STING激动剂进行了概述,重点分析了STING与其激动剂复合物的晶体结构以及STING激动剂的构效关系,并总结了研发STING激动剂所面临的严峻挑战,试图为设计和发现小分子STING激动剂提供思路。
固有免疫反应是人体内的第一道防线,对宿主有效抵抗外来病原微生物的入侵至关重要。
模式识别受体(pattern recognition receptors, PRRs) 通过检测病原体相关分子模式(pathogen-associated molecular patterns, PAMPs) 和损伤相关分子模式(damage-associated molecular patterns, DAMPs),启动下游对I 型干扰素(type I interferons, IFNs) 和促炎细胞因子的反应。
微生物DNA和来自细胞核或线粒体的自身DNA是主要的PAMPs/DAMPs,可被胞质DNA 感受器,如环磷酸鸟苷-腺苷合成酶(cyclic guanosine monophosphateadenosine monophosphate synthase, cGAS) 识别。由cGAS 内源性产生或由细菌病原体合成的胞质环状二核苷酸(cyclic dinucleotides, CDNs) 激活干扰素基因刺激因子(stimulator of interferon genes, STING),引发免疫反应。
许多研究表明STING参与多种疾病的发生,STING的激活能够诱导有效的免疫反应,对抗病原体感染和癌症;而STING的异常激活会引发自身免疫性疾病和炎症性疾病。作为一个潜在的药物新靶点,STING的结构和功能也已经被广泛研究,为发现和确定STING激动剂提供了理论基础。
STING的结构
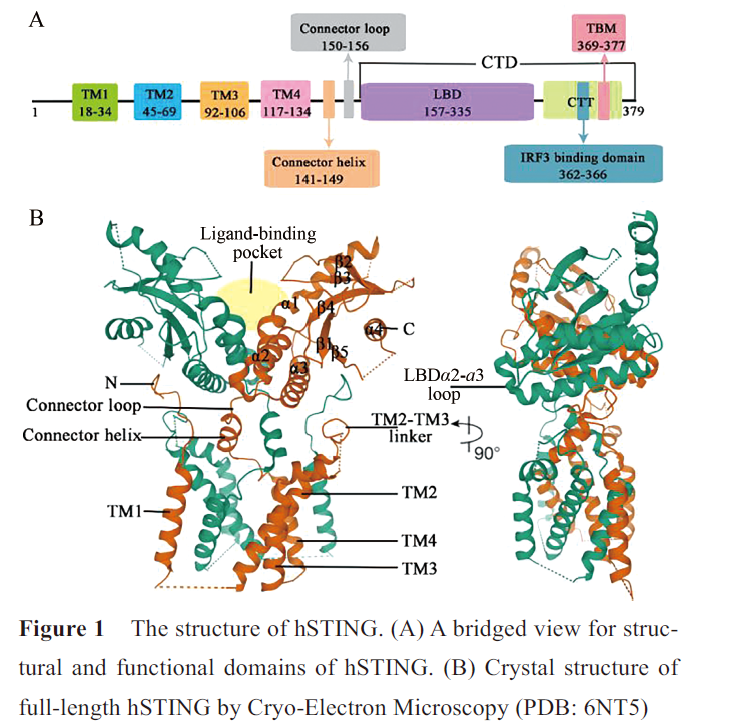
STING的胞质部分以二聚体形式存在。全长STING的结构直到2019年,才由Shang等利用冷冻电镜技术解析完全。人源STING(human STING, hSTING)的结构如图1,包含一个跨膜的N末端结构域和一个球状的C末端结构域(C-terminal domain, CTD)。N末端结构域分为4个跨膜的区域(transmembrane region 1~4, TM1~4),主要负责将STING锚定于内质网膜或其他细胞器膜上。
在STING二聚体中,TM1~4采用结构域交换结构,其中一个亚基的TM1与另一个亚基的TM2、TM3和TM4组合在一起,8个跨膜区组成两层:两个亚基的TM2和TM4形成了中央层,被外围的TM1和TM3包围。CTD暴露在细胞质中,包含配体与蛋白结合的区域(ligand-binding domain, LBD)和C尾端结构域(C-terminal tail, CTT)。
LBD包括4 个α螺旋(LBDα1~α4) 和5个β折叠片层(LBDβ1~β5)。连接TM4 和LBDα1 的连接子包括一个连接螺旋和一个连接环,在二聚体中两个连接子形成右旋交叉,使同一STING分子的TM和LBD分布在二聚体的对侧。TM2和TM3 之间的连接桥、连接螺旋和LBD共同形成胞质和跨膜结构域之间的表面沟槽,TM1之前的N末端段位于这个沟槽中,这种域间相互作用是一种保守的结构特征,对蛋白质的稳定性和功能非常重要。
CTT与STING的胞质部分结合,包含结合TANK结合激酶1(TANK binding kinase 1, TBK1) 的基序(TBK1-binding motif, TBM) 和结合干扰素调节因子3 (interferon regulatory factor 3, IRF3) 的基序。
STING的激活
cGAS合成的2',3'-环磷酸鸟苷-腺苷(2',3'-cyclic GMP-AMP, 2',3'-cGAMP) 结合STING后,诱导LBD向配体结合口袋内旋,由“V形”变为“U形”,并且在结合口袋上方四个β折叠片层反向平行形成“盖子”结构,STING由“开放”构象转变为“闭合”构象(图2A)。然而,这种构象变化如何导致STING的激活一直困扰着科学研究者。直到2019 年,Shang等和Ergun等阐明了STING的激活机制。
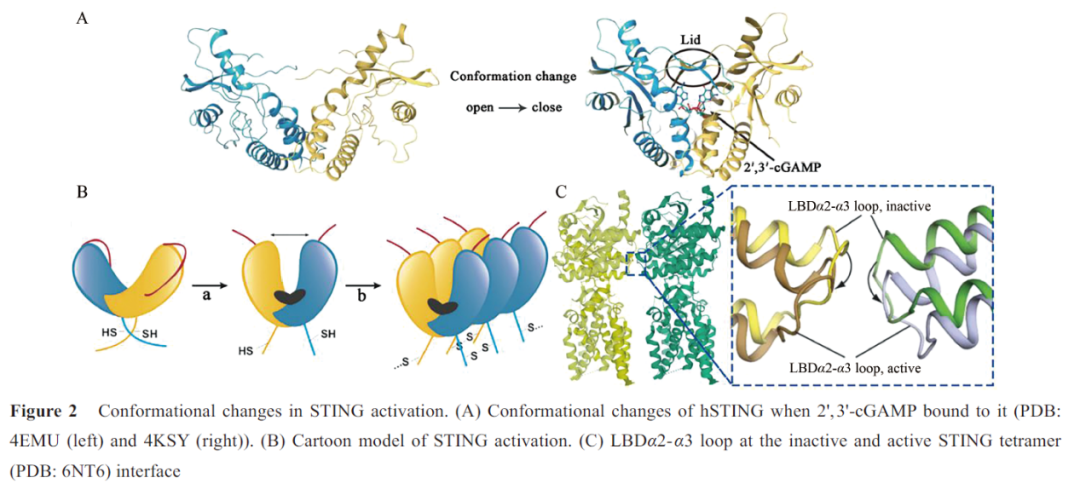
Shang等发现2',3'-cGAMP与LBD的结合诱导包括连接子、LBD和CTT在内的STING胞质部分相对于TM旋转180°,使连接子的右旋交叉被解开,同一STING亚基的LBD回到TM同侧,形成肩并肩的STING二聚体(图2B: a)。2',3'-cGAMP与LBD的结合还导致LBDα2和LBDα3向下倾斜,从而使STING二聚体间连接LBDα2和LBDα3的环(LBDα2- α3 loop)相互远离,不再冲突(图2C);同时Ergun等的研究补充证明2',3'-cGAMP的结合会触发CTT的释放,暴露STING聚合界面,这两种构象变化使STING以二聚体为单位平行排布式的组装成聚合体(图2B: b)。Ergun等还发现STING聚合使Cys148形成二硫键来连接、稳定STING聚合体(图2B: b)。STING聚合体的形成对后续反应至关重要。
cGAS-STING通路
STING是固有免疫中重要的信号分子,介导胞质DNA 诱导的固有免疫反应。当DNA感受器cGAS检测到死细胞、肿瘤细胞或病原体释放的胞质双链DNA (double-stranded DNA, dsDNA),以及泄漏于胞质的线粒体DNA(mitochondrial DNA, mtDNA)时,cGAS催化ATP和GTP合成第二信使2',3'-cGAMP,直接激活内质网上的STING蛋白。
此外,STING还可以直接作为DNA感受器,识别细菌携带的CDNs,引发对病原体的固有免疫反应。STING激活形成的聚合体招募下游的TBK1和IRF3,TBK1磷酸化IRF3,激活IRF3二聚体进入细胞核,诱导I型IFN的表达(如IFN-β),启动干扰素免疫应答。
另外, 转录因子核因子κB(nuclear factor kappa-B, NF-κB) 也可以被STING激活,进入细胞核,诱导促炎性细胞因子(如肿瘤坏死因子α(tumor necrosis factor-α, TNF-α) 和白细胞介素6(interleukin 6, IL-6) 的表达(图3A)。STING 通路分泌最多的细胞因子IFN-β不仅可以直接杀伤癌细胞,还可以通过促进树突细胞的成熟来实现抗原的呈递,从而将先天免疫应答与适应性免疫应答联系起来。除了诱导细胞因子外,一些研究发现诱导自噬过程也是cGAS-STING通路的基本功能,在抗病毒防御中发挥着重要的作用。
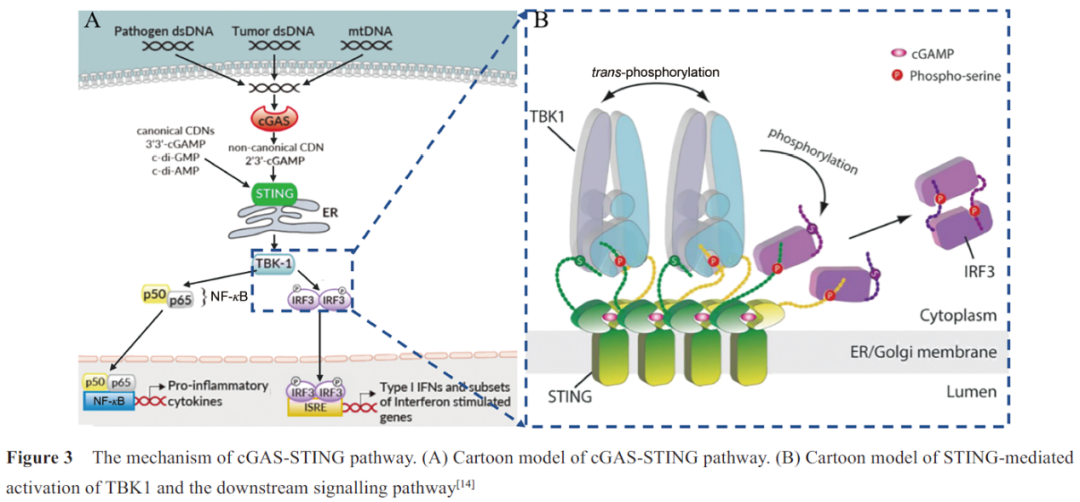
2019年, Zhang等用冷冻电镜方法阐明了活化的STING聚合体如何特异地招募TBK1和IRF3,实现依赖TBK1的IRF3磷酸化。研究发现一个STING二聚体结合一个TBK1二聚体,活化STING释放的CTT末端的TBM结合在TBK1二聚体界面的沟槽内,从而实现STING对TBK1高亲和力的招募。
在STING聚合体中,多个TBK1二聚体聚集在一起,TBK1二聚体间进行反式自磷酸化。同时STING聚合体中只有一些STING二聚体的CTT招募TBK1,邻近未结合TBK1的CTT的Ser366被TBK1磷酸化。STING磷酸化后的363LXIS366基序构成IRF3结合基序,招募IRF3被TBK1磷酸化,激活IRF3二聚体进入细胞核(图3B)。
STING在抗病原体感染、抗肿瘤免疫反应和自身免疫性疾病中发挥重要作用。因此2008 年STING一经发现,便成为免疫和肿瘤学的一个极具吸引力的靶标。研究者们大力开展了STING相关药物的研发,通过激活或抑制STING信号通路达到不同的治疗目的。本文主要介绍STING激动剂的研究进展。
STING激动剂
随着STING及其通路机制的深入研究,STING激动剂得到快速发展。研究者们不仅证明了具有抗病原微生物、抗肿瘤活性的天然CDNs、5,6-二甲基呫吨酮-4-乙酸(5, 6-dimethylxanthenone-4-acetic acid, DMXAA)和10-羧甲基-9-吖啶酮(10-carboxymethyl-9-acridanone,CMA)为STING激动剂,还通过高通量筛选得到了多种结构类型的STING激动剂。
在进行激动剂作用机制研究时发现,一些激动剂可以与STING结合,称为直接STING激动剂;而另一些激动剂不与STING结合,称为间接STING激动剂,其激活STING通路的机制不明,可能与STING通路中任何阶段的蛋白发生作用,甚至可能是激活其他通路发挥效应后,再间接激活STING通路。
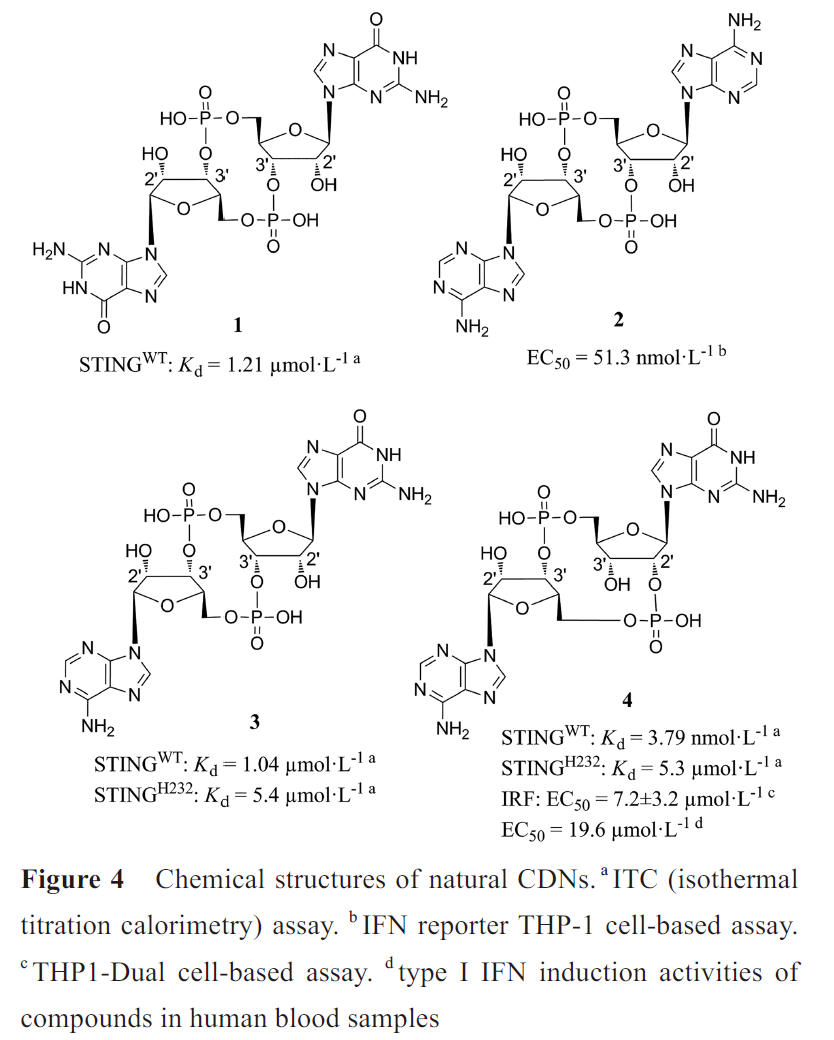
·环状二核苷酸类
细菌产生的环二鸟嘌呤(cyclic dimeric GMP, c-di-GMP)(1)、环二腺嘌呤(cyclic dimeric AMP, c-di-AMP)(2)、3',3'-环磷酸鸟苷-腺苷(3',3'-cyclic GMP-AMP, 3',3'-cGAMP)(3)和哺乳动物由cGAS 催化产生的2',3'-cGAMP(4)(图4)是天然的CDNs类STING 激动剂。
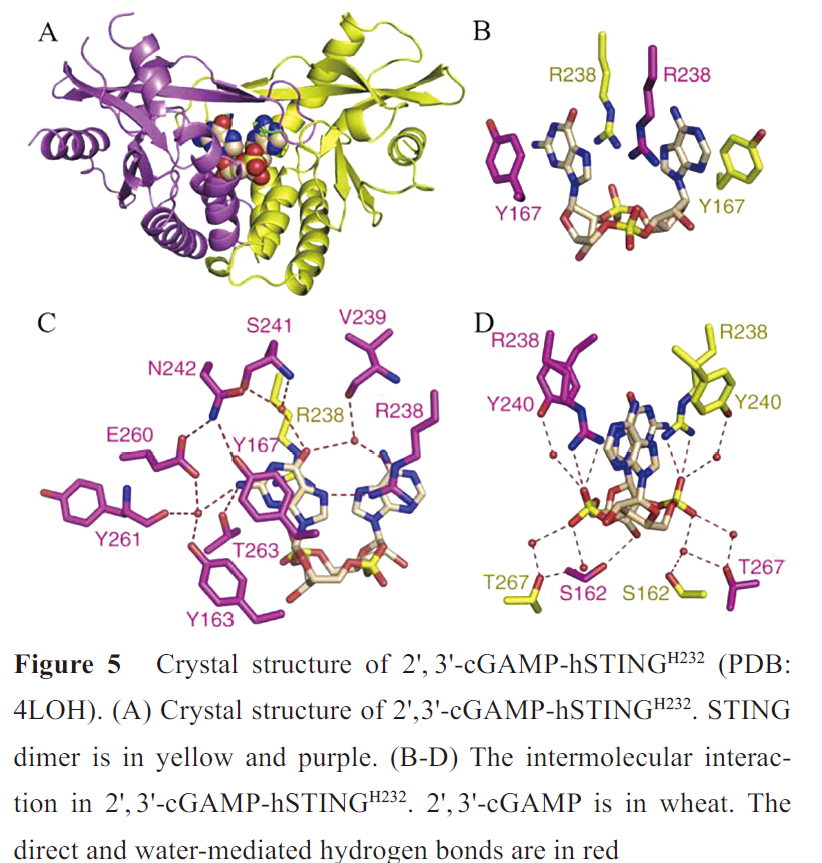
其中2',3'-cGAMP与STING具有更广泛的相互作用,形成更稳定的“闭合”二聚体构象(图5A),因此诱导更强的I 型IFNs反应。2',3'-cGAMP-hSTINGH232晶体结构中,2',3'-cGAMP位于STING二聚体的“U形”裂缝中,核糖-磷酸位于底部,嘌呤环平行向上,嘌呤碱基位于Y167和R238之间(图5B)。R238在平面上对齐,与一个嘌呤的N7形成氢键,其胍基则堆叠在另一个嘌呤上(图5C)。鸟苷NH2与T263、核糖3'-OH与S162、磷酸链与R238胍基形成直接氢键网络。N242、S241、V239、Y163、E260、Y261、T267和Y240与鸟苷O6、鸟苷NH2和磷酸链形成水介导的氢键网络(图5C, D)。核糖2'-OH不参与氢键网络的形成,因此含有3'-OH的2',3'-cGAMP比其他天然CDNs 与STING 的结合亲和力更强。
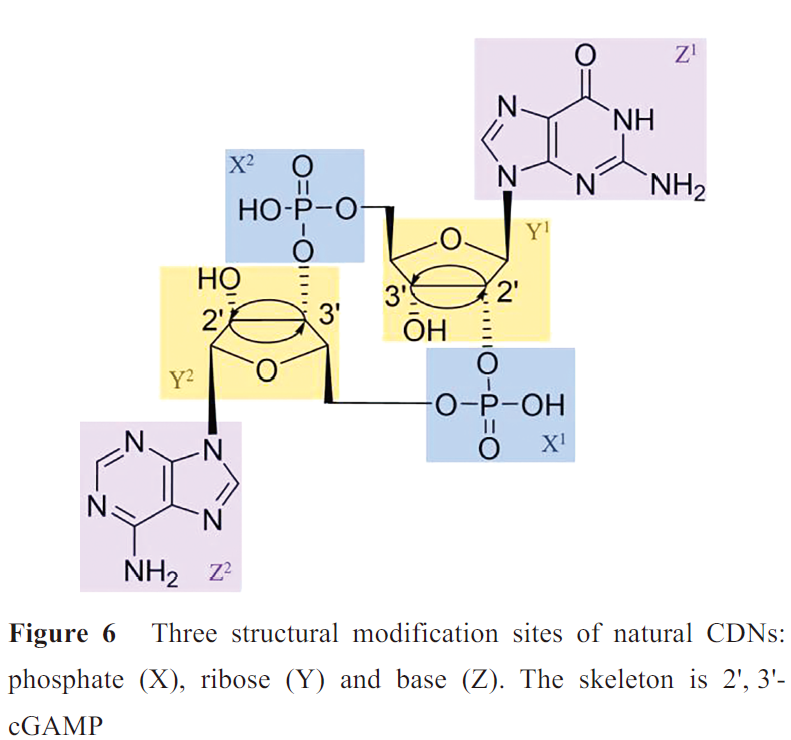
然而,天然CDNs相对较大的分子质量和强极性使其难以透过细胞膜,细胞摄取不足,且其磷酸二酯键易被酶水解,代谢不稳定,这些因素一定程度上限制了其临床应用。因此研究者们对天然CDNs的磷酸二酯键、核糖和碱基三个部分进行了大量的结构改造(图6),以期改善其较差的膜渗透性、细胞摄取和代谢不稳定性,从而提高生物活性。优化后,CDNs展现出更为有利的药代动力学特征,其中的一些化合物已进入临床试验中。
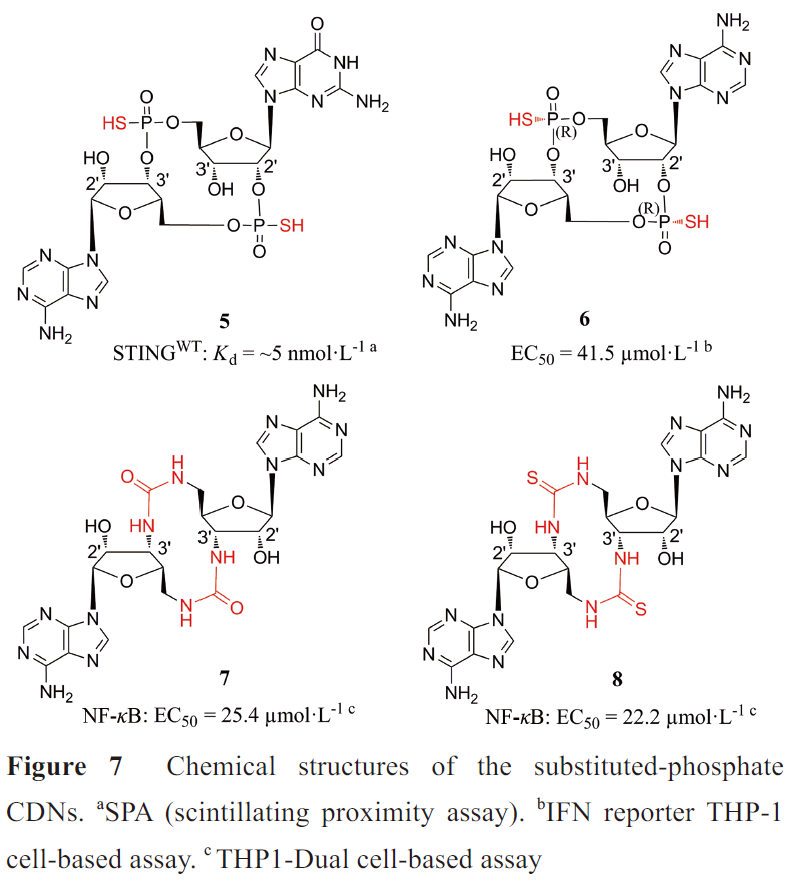
CDNs易受体内酶的水解,对磷酸二酯键进行硫代(5, 6)、脲或硫脲(7, 8) (图7)取代可以增强化合物对水解酶的抗性。Aduro与诺华公司合作开发的化合物6,Rp,Rp-2',3'-c-diAMPSS(也称为ML-RR-S2-CDA、MIW815或ADUS100),诱导IFN的效力明显高于2',3'-cGAMP,经瘤内注射,可使小鼠肿瘤显著消退,并提供长期免疫记忆。6为第一个进入临床试验的非典型CDNs,应用于晚期或转移性实体瘤或淋巴瘤(NCT02675439 和NCT03172936)和头颈部鳞状细胞癌(NCT03937141)。
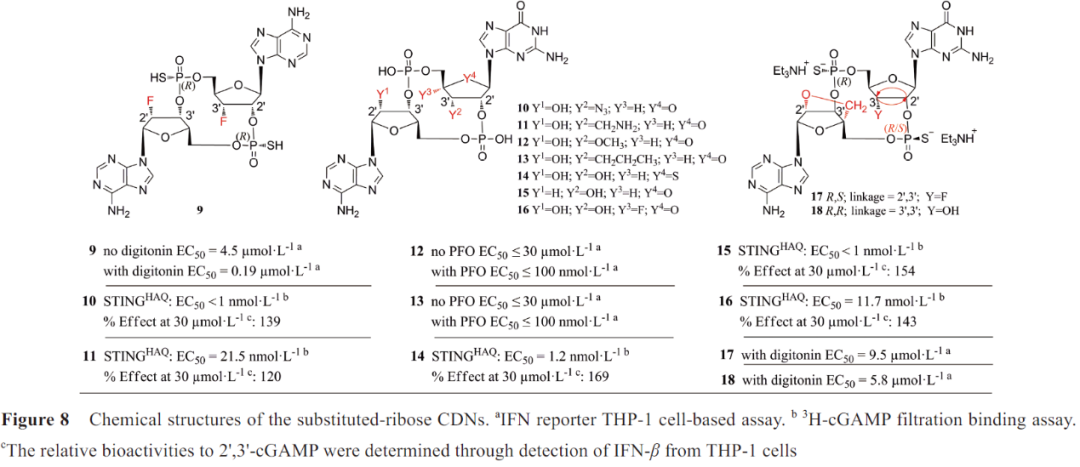
在化合物6的核糖环上引入氟原子(9, 图8),其细胞通透性得到改善,活性提高8倍。默沙东(MERCK SHARP&DOHME, MSD)和Immune Senor对2',3'-cGAMP的核糖进行了结构改造,分别得到活性增强的化合物10~14和抗水解的化合物15、16。
其中化合物10、14、15 与STING的结合亲和力比2', 3'-cGAMP稍强或相当,而化合物11、16丧失了部分结合亲和力。MSD研制的MK-1454正在进行I 期临床试验,初步数据显示,单药治疗时无应答,但与Keytruda联合治疗时产生部分应答(NCT03010176)。Aduro公司在CDNs核糖环上引入了锁核酸结构,活性较好的化合物17、18的细胞渗透性比ADU-S100和2', 3'-cGAMP更好, 细胞吸收增强。
Lioux等设计并合成了由腺苷核苷和肌苷核苷组成的环磷酸腺苷-肌苷(cyclic adenosine-inosine monophosphate, cAIMP),并且进行了核糖取代、核苷酸间连接位置和磷酸修饰。
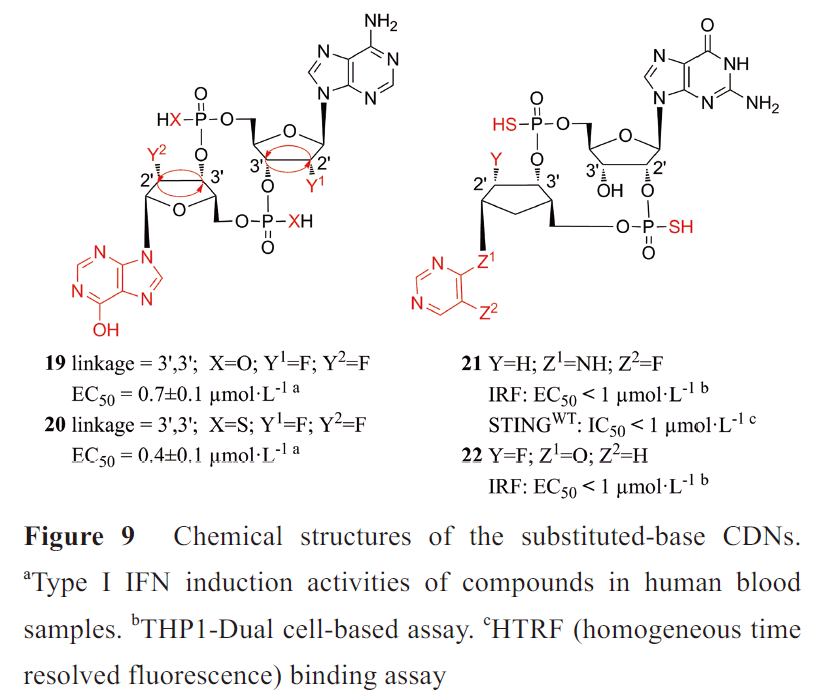
其中化合物19和20(图9)活性最优,均能较好地促进I型IFN和促炎细胞因子的分泌和抵抗水解酶的水解。四种连接异构体中3',3'连接对I型IFNs的诱导作用最强,这与cGAMP 不同(3',3'-cGAMP活性最弱)。硫代磷酸类似物比其对应的磷酸二酯类似物更能抵抗酶解,这与Li 等的研究结果一致。
施贵宝制药和武田公司则将2',3'-cGAMP的嘌呤碱基替换为非碱基部分,同时也进行了核糖和磷酸修饰,其中化合物21、22激活THP1-Dual细胞的IRF 通路活性较强。
·蒽醌类
黄酮-8-乙酸(flavone-8-acetic acid,FAA)(23, 图10)最初为一种非甾体抗炎药被发现,20世纪80 年代发现其抗肿瘤特性,但在Ⅱ期临床试验中失败。呫吨酮-4-乙酸(xanthenone-4-acetic acid, XAA)(24)是一种具有类似FAA 结构的活性药物。
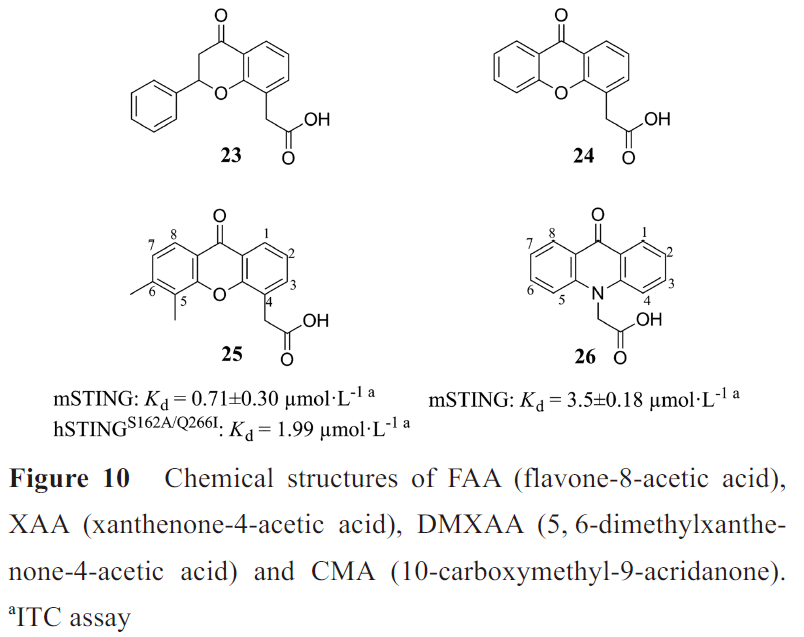
2005年发现具有呫吨酮(又称氧杂蒽酮)结构的XAA的5,6位二甲基取代产物DMXAA(也称为ASA404或vadimezan)(25)可以激活NF-κB信号通路,破坏肿瘤血管的发生,2007 年发现它还可以激活TBK1-IRF3 信号通路。DMXAA和化疗药物紫杉醇、卡铂组成的联合疗法,通过了治疗非小细胞肺癌的II 期临床试验,但人体III 期临床试验宣告失败。
20世纪80 年代发现吖啶酮(又称氮蒽酮)类化合物CMA (26)是一种非常有效的I型IFN诱导剂,在防范啮齿动物病毒感染方面表现良好,但同样在临床试验中失败。2013年研究发现DMXAA和CMA只能结合并激活鼠源STING(mouse STING, mSTING),不与hSTING结合,解释了临床失败的原因。
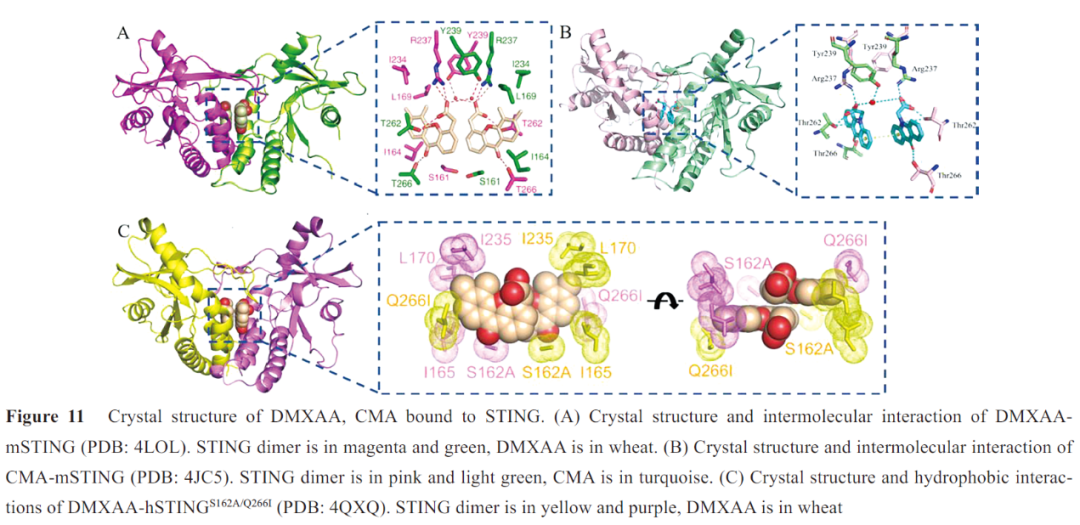
DMXAA、CMA均诱导mSTING形成“闭合”构象,且与mSTING的分子间作用十分相似(图11)。两个化合物分子位于mSTING二聚体结合口袋,芳香环平行排列,酮基与T266直接形成氢键,C10位O/N与T262结合,羧基与T262、R237 形成直接氢键、与Y239 通过水分子形成氢键,DMXAA的5、6位甲基与L169 和I234侧链形成疏水性区域(图11A, B)。
Gao等还发现hSTING结合口袋的Q266I和S162A突变,“盖子”上G230I 的突变,均可增强DMXAA对hSTING的敏感性,三者之间是互助促进的关系。DMXAA和hSTINGS162A/Q266I晶体结构中,I266侧链与侧链I165、L170和I235一起形成疏水性区域,将DMXAA的5、6位甲基和未取代的7位牢牢包裹起来,A162 侧链与DMXAA另一侧芳香环边缘也发生了疏水性相互作用(图11C)。
因此DMXAA的双甲基和羧酸可能为活性必须,且对C1/C2(对应Q266I突变)和C7 位(对应S162A突变)进行结构改造,可能会恢复DMXAA对hSTING 的敏感性。由于CMA与DMXAA的相似性,推测CMA也可进行类似结构改造。
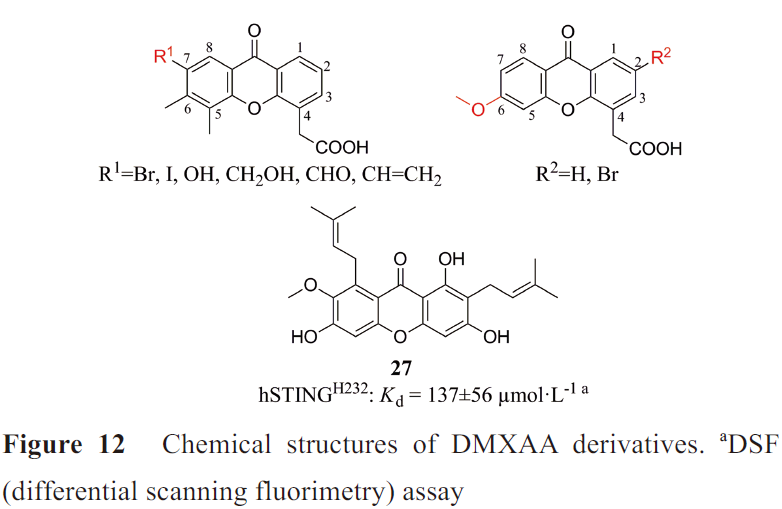
根据晶体复合物结构,人们对DMXAA进行了结构改造(图12)。Hwang等设计了C7位具有极性基团的DMXAA衍生物,遗憾的是没有得到与不同的hSTING 突变体特异性结合的化合物。本课题组在DMXAA的C2位修饰疏水性的基团,保留5,6位双甲基的结构或者仅在C6位修饰甲氧基,但也没有获得能与hSTING结合的DMXAA衍生物。从山竹子果壳中分离出的呫吨酮类α-倒捻子素(27)能结合、激活hSTING H232和hSTING R232,但只能小程度的激活mSTING,其诱导IFN-β水平高于2',3'-cGAMP,且能够将人单核细胞来源的M2巨噬细胞重新极化为M1表型,可能具有抗肿瘤、抗病毒作用。
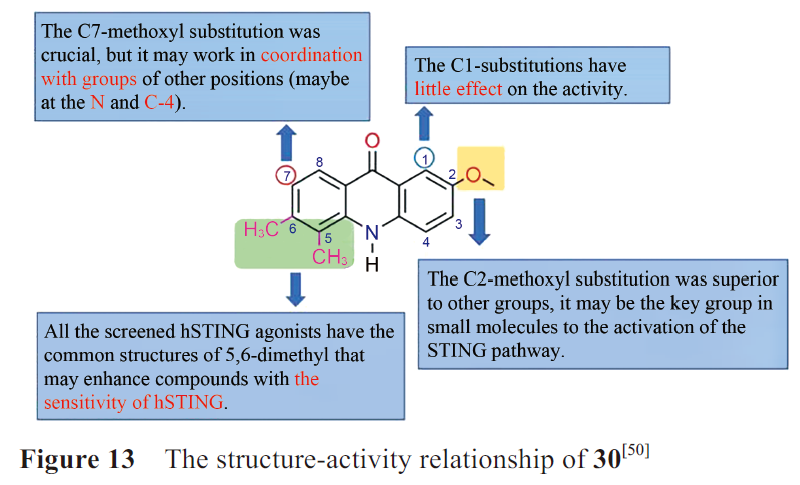
本课题组参照DMXAA的结构在CMA的5,6位引入了双甲基、将N 原子上的羧基转移至C4 位,在C1、C2和C7的一处或多处取代卤素原子或甲氧基,并分析了构效关系(图13)。
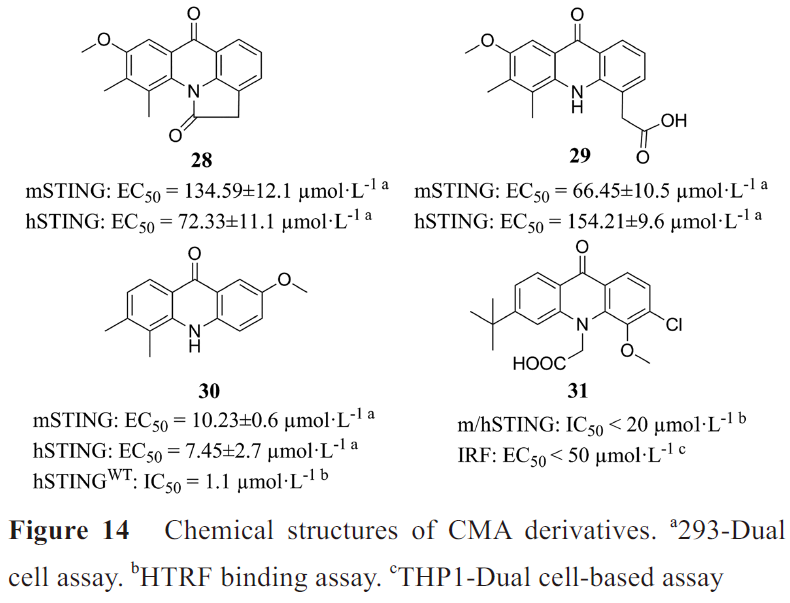
其中化合物28、29和30(图14)对hSTING和mSTING均能有效激活。最优化合物30可以有效激活STING-IRF3和STING-NF-κB两个通路,且对NF-κB途径的激活效应比2',3'-cGAMP更强。Silicon Swa公司也合成了数百种带有CMA衍生物。通过亲和力结合试验和细胞实验,得到最优化合物31。对CMA的成功改造说明吖啶酮类在治疗肿瘤或病毒感染方面有巨大潜力。
未来对于吖啶酮类激动剂的改造,可以在化合物30的N、C4和C7的位置修饰适宜的基团,增强活性;也可以将两个活性小分子通过共价连接,形成CDNs模拟物,以增强与STING的结合亲和力,提高活性。
·氨基苯并咪唑类
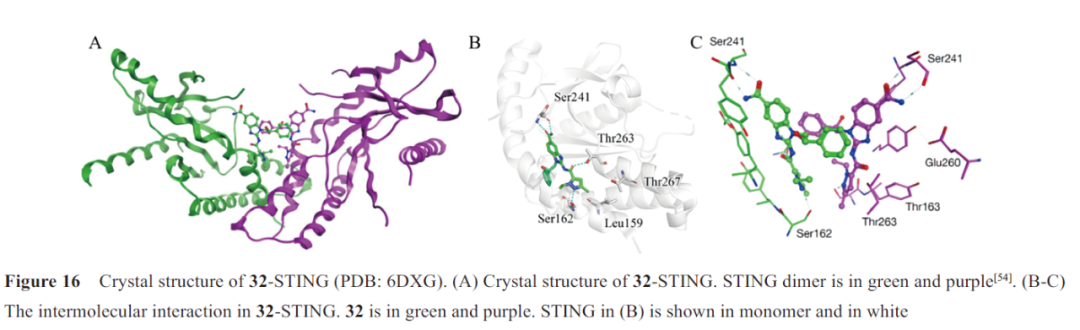
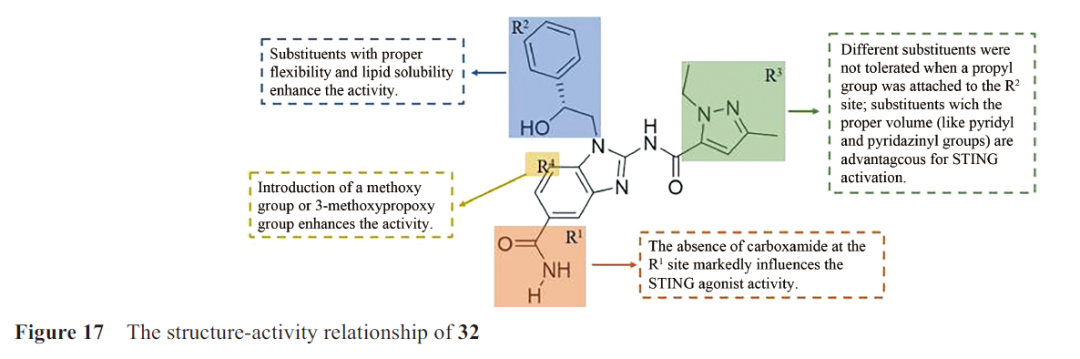
2018年,葛兰素史克(Glaxo‐SmithKline, GSK)通过筛选与3H-cGAMP竞争结合STING CTD的小分子,发现氨基苯并咪唑类化合物32(图15),是第一种有效的、非核苷酸类、同时激活mSTING和hSTING的STING激动剂。不同于2',3'-cGAMP,化合物32激活STING的同时保持“开放”的STING构象(图16A),对“闭合”构象使STING蛋白激活的观点提出了质疑。晶体复合物结构表明两分子化合物32与一个STING蛋白二聚体结合,甲基与L159和T267 残基形成疏水性区域(图16B),吡唑N与S162的羟基形成氢键,中间酰胺与T263 形成氢键,末端酰胺与S241形成氢键网络(位于STING 开放的“盖子”区) (图16C)。
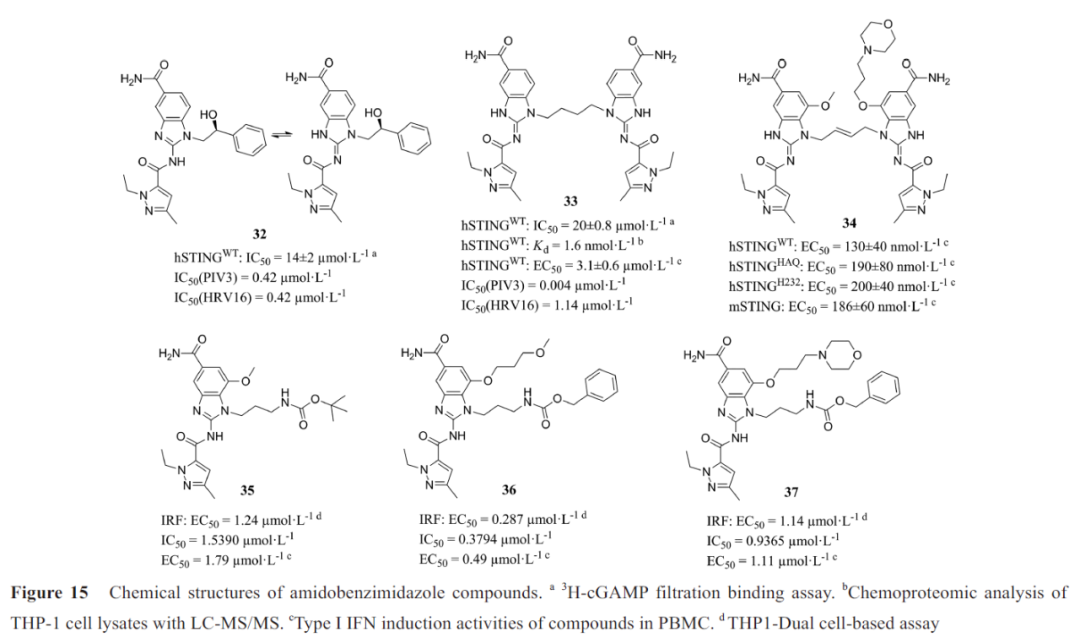
化合物32的N1位羟苯乙基与STING蛋白没有相互作用,且两分子的N1在空间上很接近,因此,在N1位通过连接桥合成二聚化合物33,其结合能力提升了近1000 倍。通过进一步的优化,化合物34的结合亲和力和诱导IFN-β分泌的活性进一步提高,小鼠静脉给药后产生持久的抗肿瘤作用。另外,Xi等选择了四个修饰位点(R1、R2、R3、R4)对化合物32进行优化,其构效关系如图17。其中化合物35、36和37在THP1-Dual细胞荧光实验显示出微摩尔激动剂活性。结肠肿瘤小鼠静脉注射化合物37,有显著的抗肿瘤作用。
Zhu等研究了化合物32和33的抗病毒活性,发现其对呼吸道RNA病毒:副流感病毒3型(parainfluenza virus 3, PIV3)和人鼻病毒16(human rhinovirus, HRV16)表现强大的抗病毒活性,而且有两种不同的抗病毒机制。抗PIV3依赖于I 型IFN应答,而抗HRV16则需要依赖自噬相关基因5(autophagy-related gene 5, ATG5)的自噬,抗PIV3病毒的效应强于抗HRV16病毒效应,延迟治疗起始时间点,会显著降低抗HRV16病毒的活性。
·3-咪唑-哒嗪类
Chin等以含有IRF荧光素酶报告基因的THP-1细胞为研究对象,筛选了大约100万个小分子,并在敲除STING或cGAS的ISG-THP1细胞系进行二次试验,以确定通路特异性和潜在的靶标。
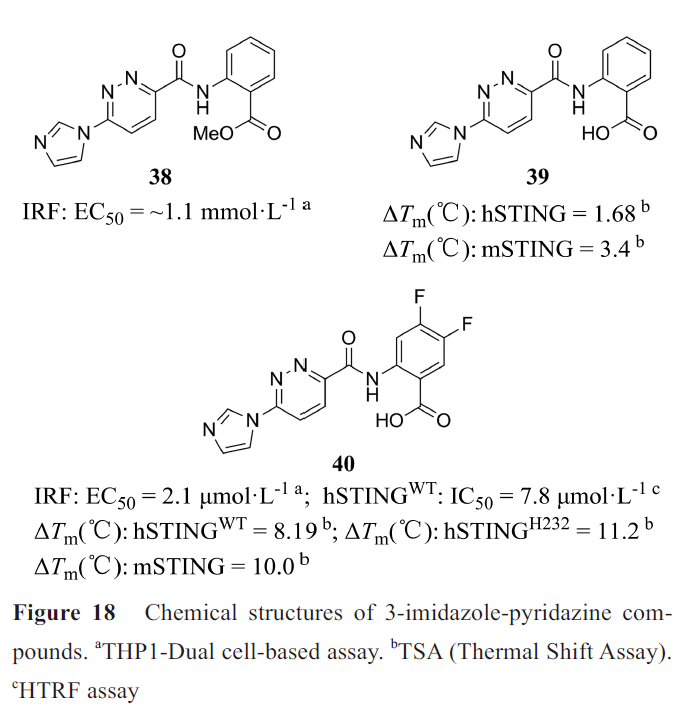
其中3-咪唑-哒嗪类化合物38(图18)依赖STING作用于cGAS的下游。进一步研究表明38为一种前药,在体外不与STING直接结合,在进入细胞后迅速转化为化合物39,从而发挥作用。39在体外可以结合STING,但在细胞检测中无活性,可能的原因是酯取代赋予化合物细胞通透性,而羧酸使化合物可以结合STING。结构优化得到含二氟取代的化合物40(SR-717),与38具有同等的细胞活性,而且在体外与常见hSTING突变型和mSTING结合。小鼠皮下注射SR-717后具有抗肿瘤活性(疗效优于抗PD-1或抗PD-L1治疗)、促进相关组织中CD8+T、自然杀伤细胞和树突状细胞的活化、促进抗原的交叉免疫。
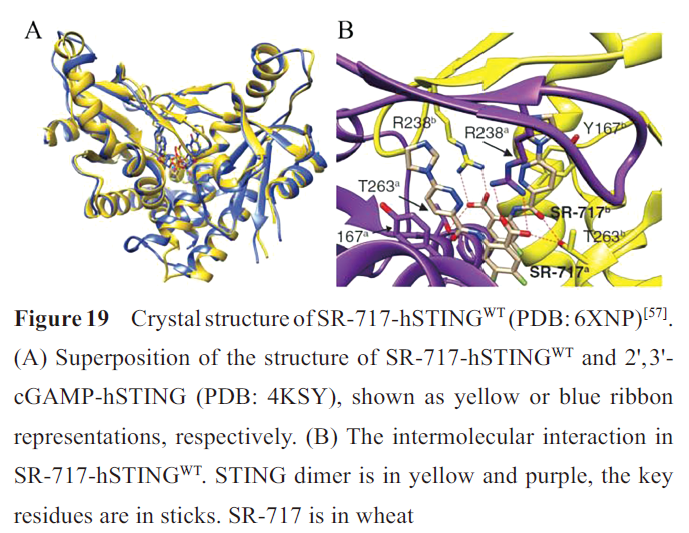
晶体复合物结构表明两分子SR-717结合在STING二聚体裂缝中,形成“闭合”构象。对比SR-717-hSTING WT和2',3'-cGAMP-hSTING的晶体结构,发现SR-717的结合模式与2',3'-cGAMP相似(图19A)。两个SR-717的哒嗪环位于结合2',3'-cGAMP的两个嘌呤位置,位于Y167和R238之间,羧酸位于结合2',3'-cGAMP的磷酸链位置。T263侧链羟基与一个SR-717分子的羧酸和另一个分子的酰胺羰基形成氢键作用,R238的胍基侧链与羧酸形成直接氢键。另外SR-717与V239、S241、N242和Y240形成水介导的氢键网络(图19B)。因此SR-717是一种稳定的2',3'-cGAMP模拟物,可能具有相似的抗肿瘤免疫活性。
·苯并噻吩类
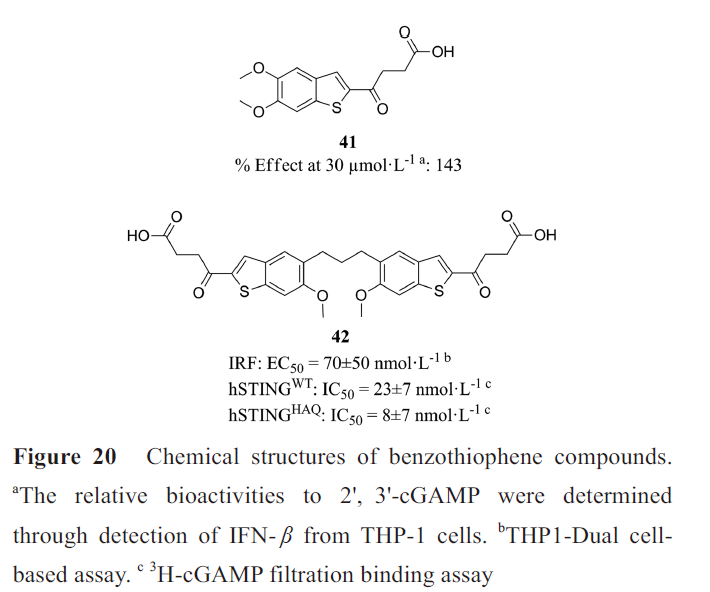
IFN-β的分泌是STING激活的一个重要作用,因此MSD选择表达hSTING HAQ的THP-1细胞,筛选能诱导IFN-β分泌的化合物,最终从大约240万个化合物中筛出了少量分子。化合物41(MSA-2, 图20)在溶液中以单体和非共价二聚体两种形式存在,处于平衡状态,其非共价二聚体结合、激活STING。MSA-2共价二聚体(如化合物42)也能与2',3'-cGAMP竞争结合STING、诱导IFN-β分泌。MSA-2诱导80%至100%的结肠癌小鼠肿瘤完全消退,并且诱导长期的抗肿瘤免疫,和抗PD-1抗体联合治疗在抑制肿瘤生长和延长生存方面优于单药治疗,并且是第一种能够口服给药的STING激动剂。
MSA-2是一种弱酸,在酸性肿瘤微环境中MSA-2的细胞进入和保留增加。皮下或口服给药后,肿瘤中MSA-2浓度高于血浆或其他非肿瘤组织,细胞因子水平的增加在肿瘤中有更高的趋势。这种优先靶向肿瘤的特性对于系统性给药的STING激动剂的抗肿瘤活性和耐受性非常关键。
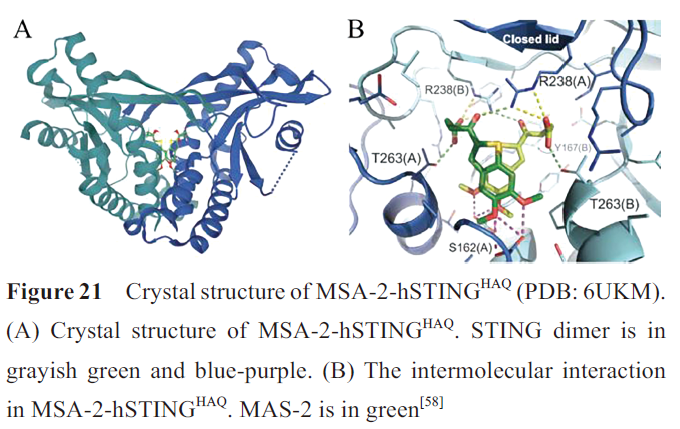
MSA-2-hSTING HAQ晶体结构显示,两分子MSA-2与hSTING HAQ结合,形成“闭合”构象(图21A)。MSA-2除与周围的几条侧链形成水分子介导的相互作用外,酮基与邻近STING亚基的R238 胍基形成氢键,羧酸基团与邻近STING亚基的T263和另一STING亚基的R238侧链形成氢键(图21B)。羧酸基团与STING的这种相互作用是MSA-2特有的,能使复合物二聚体产生非共价交联并稳定构象。
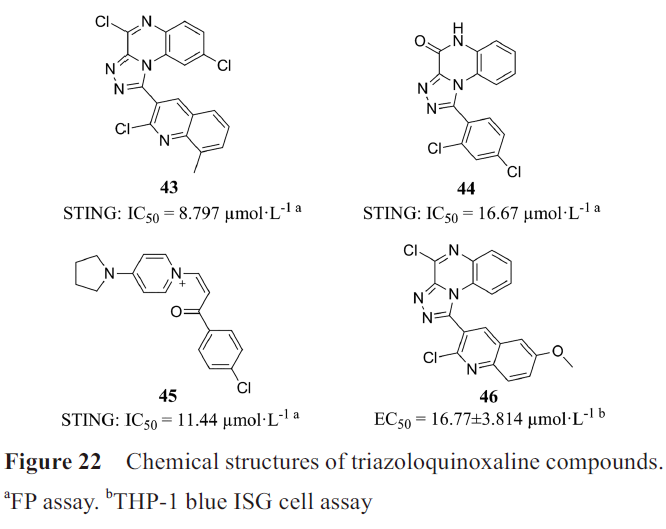
·三唑喹喔啉类
Hou等通过基于结构的虚拟筛选和荧光偏振(fluorescence polarization, FP) 实验筛选得到STING激动剂:化合物43、44和45(图22)。结构改造得到的化合物46依赖STING诱导THP-1 细胞和小鼠BMDMs细胞中IFN-β、CXCL-10和IL-6的mRNA表达,以及STING、TBK1和IRF3的磷酸化。化合物46溶解度和膜通透性有待进一步优化。
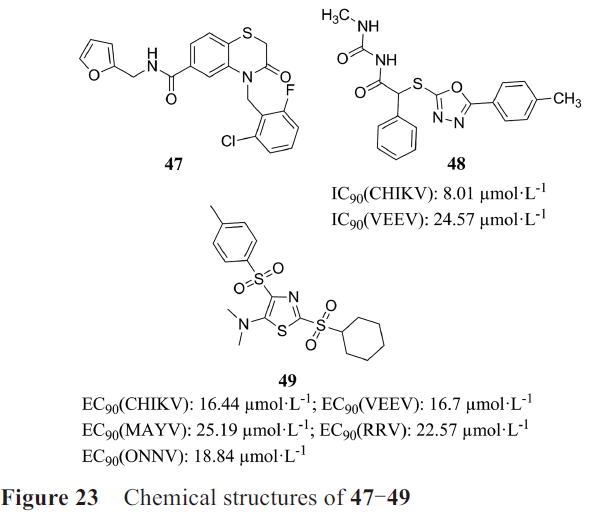
·G10、C11和M04
DeFilippis课题组通过体外THF-ISRE细胞(荧光信号反应依赖IRF3的I 型IFN的转录)高通量筛选从51632个化合物中得到化合物47(G10)、48(C11)、49(M04)(图23)。三种化合物具有相似的活性和作用机制,激活THFs细胞和原代细胞PBMCs中IRF3的磷酸化、依赖IRF3的IFN应答, 同时在小鼠RAW264.7细胞中无法检测到相关活性,且都不与STING CTD结合,因此可能为间接hSTING激动剂。
另外, C11、M04、G10都对表达hSTING HAQ的THP-1细胞没有活性,因此人们还研究了不同hSTING 突变型对化合物活性的影响。结果表明G10对R232和H232突变型更有效,对HAQ突变型的活性较低,对AQ和Q突变型几乎没有活性;M04能激活R232、H232 突变型,对HAQ仅能微弱地激活。G10和C11对多种病毒有抑制作用。
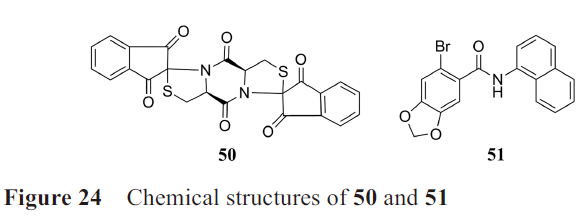
·DSDP和BNBC
Chang课题组建立了一种高通量筛选方法,化合物刺激HepAD38/cGAS-STING/ISG54Luc和HepAD38/cGAS-STINGΔC/ISG54Luc(不表达STING 的C末端区域)细胞系后,只诱导前者荧光素酶表达,可以反映化合物对cGAS和/或STING的激活。
该团队分别在2017年和2019年筛选得到的化合物50(DSDP)和51(BNBC)(图24)在缺乏cGAS和表达mSTING的细胞中没有活性,为hSTING激动剂。DSDP和BNBC可以有效抑制黄热病病毒(yellow fever virus, YFV)、登革病毒(Dengue virus, DENV)和寨卡病毒(Zika virus, ZIKV)的复制。此外,BNBC可有效诱导树突状细胞的成熟,因此可能调节CD4+和CD8+T淋巴细胞的激活,有利于慢性病毒感染和肿瘤治疗。
近年来,对STING激动剂的研究取得了突破性进展,但是开发结构更多样、更具有成药性的STING激动剂仍面临着严峻的挑战。
首先,STING激动剂主要作为抗菌、抗病毒和抗肿瘤药物,然而研究发现一些病毒可以通过抑制STING通路的反应,保护其免受宿主免疫防御,因此该类病毒可能对STING激动剂有严重的耐药性。另外,Lemos等研究发现STING 激活可诱导吲哚胺-2,3-双加氧酶(indoleamine-2,3-dioxygenase,IDO)的产生,促进低抗原性肿瘤的生长,因此对STING激动剂耐受。Tu等总结了cGAS-STING通路对肿瘤的促进和抑制作用,并发现淫羊藿素能够抑制黑色素瘤的转移。
其次,STING具有单核苷酸多态性(single nucleotide polymorphism, SNP),目前已发现5种hSTING突变型: R232 (58%)、HAQ (20%)、H232(13%)、AQ(7%)和Q (2%)。不同突变型对同一STING激动剂的敏感性不同,例如,hSTING R232 对c-di-GMP产生强烈响应,而hSTING H232 对c-di-GMP不响应。因此人们期待发现能激活hSTING大部分突变型的小分子。
第三, STING的过度激活会引起细胞因子的持续产生,导致无法控制的炎症和细胞因子风暴、组织毒性、自身免疫和促进肿瘤生长的炎症性肿瘤微环境。因此需要准确控制STING激动剂的剂量,在发挥药效的同时,最大限度地降低免疫毒性。
第四,由于STING在免疫细胞和非免疫细胞中广泛表达,所以STING激动剂系统性给药时也会诱导正常组织产生炎性细胞因子,因此目前进行临床试验的STING激动剂采用瘤内注射给药,这限制了它们的应用。需要开发可系统性给药且具有靶向性的稳定型STING激动剂(如化合物41)。
第五,STING从“开放”到“闭合”的构象变化是否为STING激活仍需进一步的研究,以期为STING激动剂研发提供新思路。总的来说,STING已经成为一个突出的药物靶点,其激动剂的研发、以及在治疗感染和癌症方面的应用有广阔的前景。






