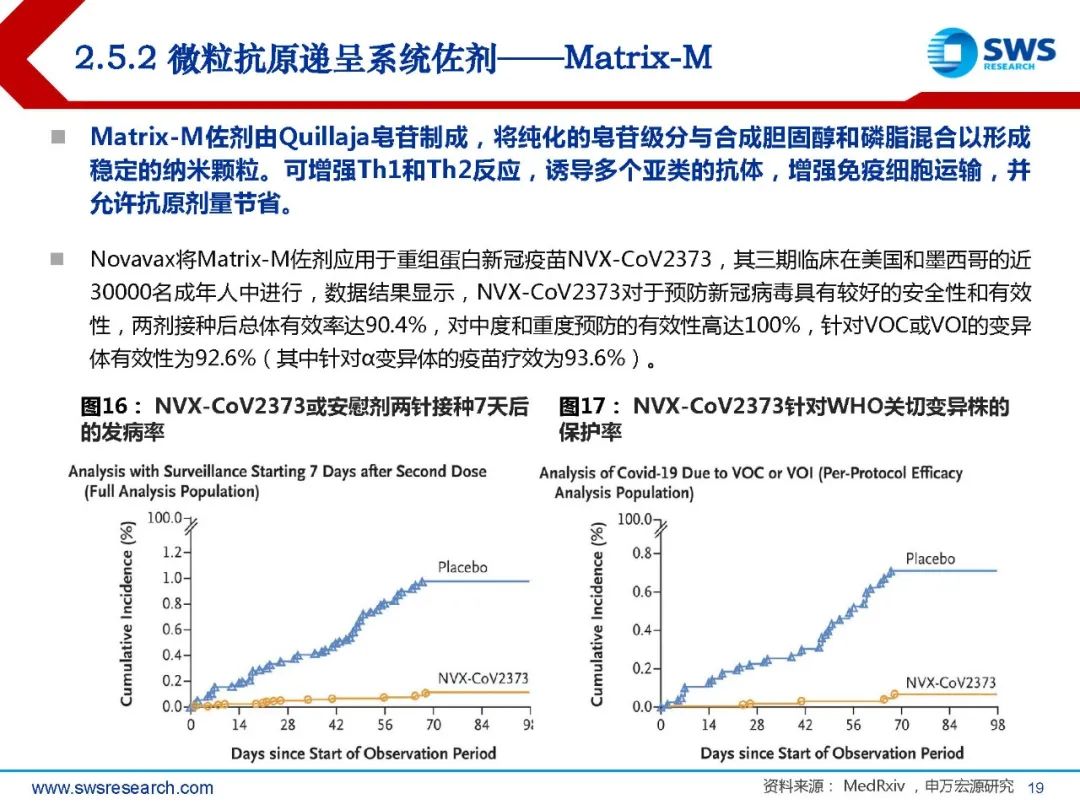
1. 佐剂的介绍及发展历程
1.1 疫苗佐剂的介绍
佐剂(Adjuvant)又称免疫调节剂或免疫增强剂(Immunepotentiator),是作为 疫苗的一种添加剂,当它先于抗原或与抗原混合注入机体后,能够增强机体对抗原的 免疫应答或者改变免疫反应的类型,属于非特异性的免疫增强剂,而其本身无抗原性。理想的佐剂不仅能够增强免疫反应,而且能使机体获得最佳的保护性免疫。
佐剂的概念出现在20世纪20年代,在马接种白喉毒素的部位产生了一个脓肿,此处的特异性抗体 滴度较高,随后发现脓肿是注射了不相关的物质所产生的,此物质增加了抗类毒素的免疫反应。1926年Glenny等人证明,吸附在明矾上的白喉毒素疫苗具有佐剂活性的物质是铝化合物。直至今 日,以铝为基础的化合物仍然是主要的人用佐剂。
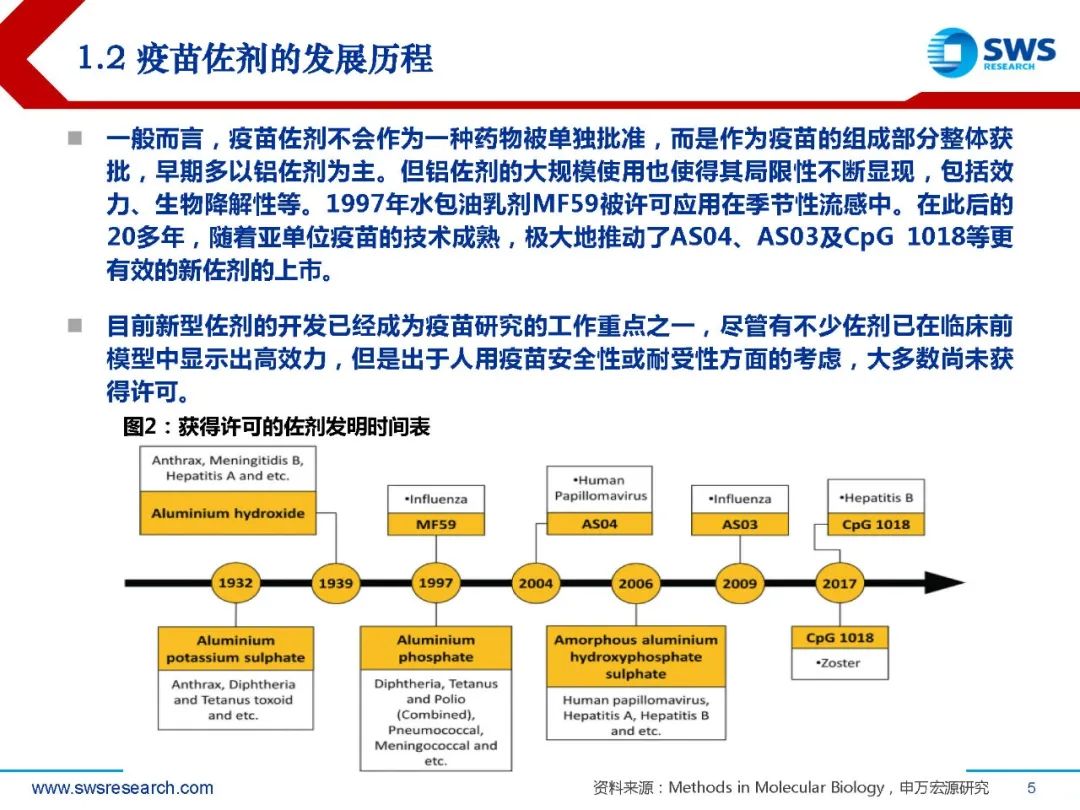
1.2 疫苗佐剂的发展历程
一般而言,疫苗佐剂不会作为一种药物被单独批准,而是作为疫苗的组成部分整体获 批,早期多以铝佐剂为主。但铝佐剂的大规模使用也使得其局限性不断显现,包括效 力、生物降解性等。1997年水包油乳剂MF59被许可应用在季节性流感中。在此后的 20多年,随着亚单位疫苗的技术成熟,极大地推动了AS04、AS03及CpG 1018等更 有效的新佐剂的上市。目前新型佐剂的开发已经成为疫苗研究的工作重点之一,尽管有不少佐剂已在临床前 模型中显示出高效力,但是出于人用疫苗安全性或耐受性方面的考虑,大多数尚未获 得许可。
1.3 佐剂作用机制的概述
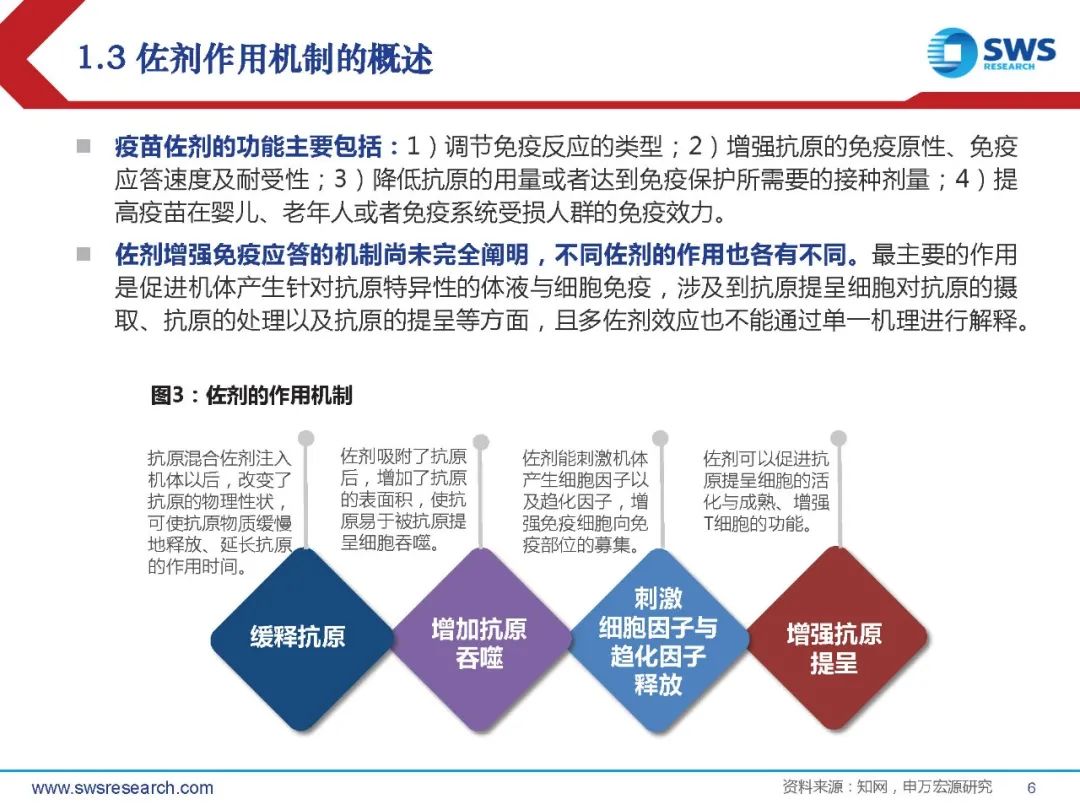
疫苗佐剂的功能主要包括:1)调节免疫反应的类型;2)增强抗原的免疫原性、免疫 应答速度及耐受性;3)降低抗原的用量或者达到免疫保护所需要的接种剂量;4)提 高疫苗在婴儿、老年人或者免疫系统受损人群的免疫效力。
佐剂增强免疫应答的机制尚未完全阐明,不同佐剂的作用也各有不同。最主要的作用 是促进机体产生针对抗原特异性的体液与细胞免疫,涉及到抗原提呈细胞对抗原的摄 取、抗原的处理以及抗原的提呈等方面,且多佐剂效应也不能通过单一机理进行解释。
2. 佐剂的分类及作用原理
疫苗佐剂的分类
从铝佐剂的发现到现在,被发现有佐剂活性的物质多种多样,根据其化学性质大致可 分为以下几类:
无机盐类佐剂——铝佐剂
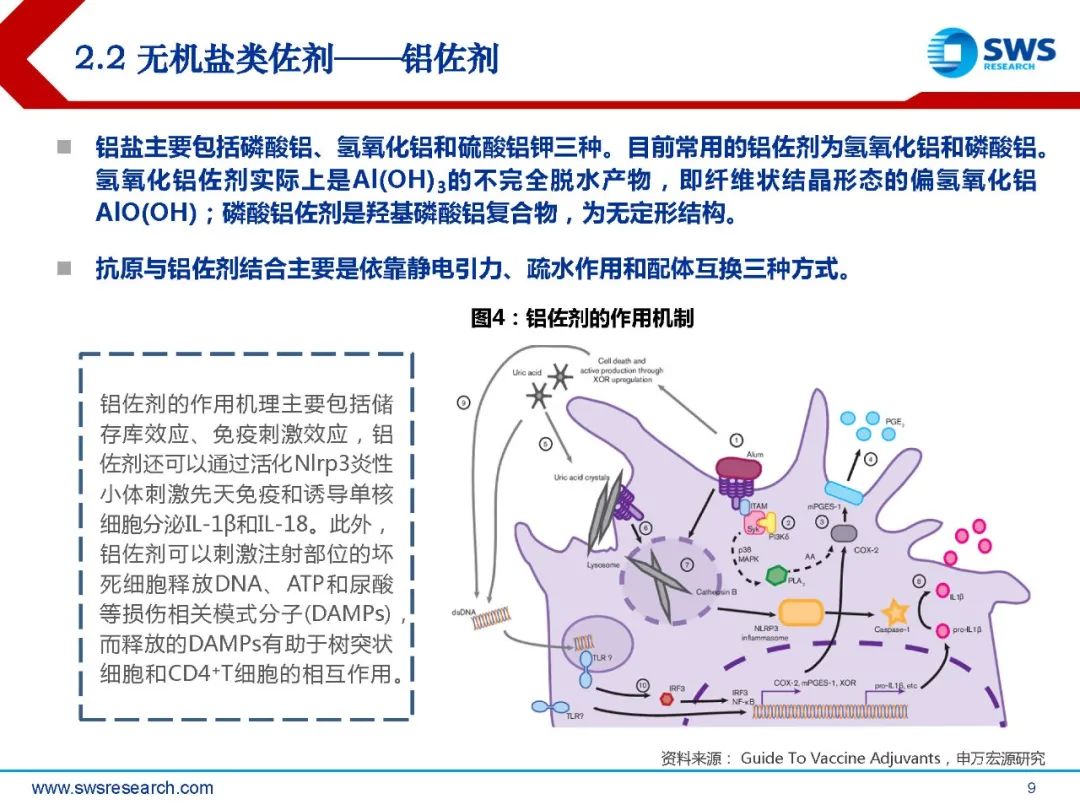
铝盐主要包括磷酸铝、氢氧化铝和硫酸铝钾三种。目前常用的铝佐剂为氢氧化铝和磷酸铝。氢氧化铝佐剂实际上是Al(OH)3的不完全脱水产物,即纤维状结晶形态的偏氢氧化铝 AlO(OH);磷酸铝佐剂是羟基磷酸铝复合物,为无定形结构。抗原与铝佐剂结合主要是依靠静电引力、疏水作用和配体互换三种方式。
铝佐剂的作用机理主要包括储 存库效应、免疫刺激效应,铝 佐剂还可以通过活化Nlrp3炎性 小体刺激先天免疫和诱导单核 细胞分泌IL-1β和IL-18。此外, 铝佐剂可以刺激注射部位的坏 死细胞释放DNA、ATP和尿酸 等损伤相关模式分子(DAMPs), 而释放的DAMPs有助于树突状 细胞和CD4 +T细胞的相互作用。
目前为止,铝佐剂仍然是人用疫苗中唯一广泛使用的佐剂。然而,铝佐剂存在极大的 缺陷:铝佐剂对增加血清抗体通常有效,但会引起注射部位反应,诱导细胞免疫的能 力较弱,在一定程度上限制了它的应用。
乳剂型佐剂——MF59
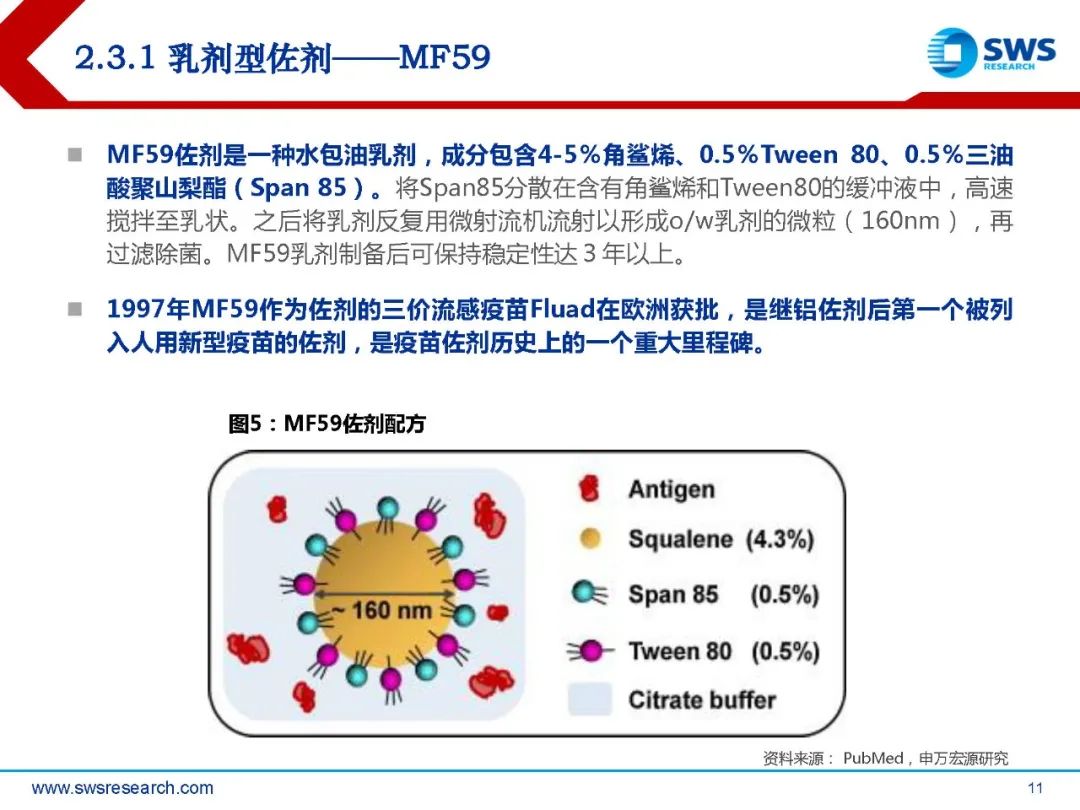
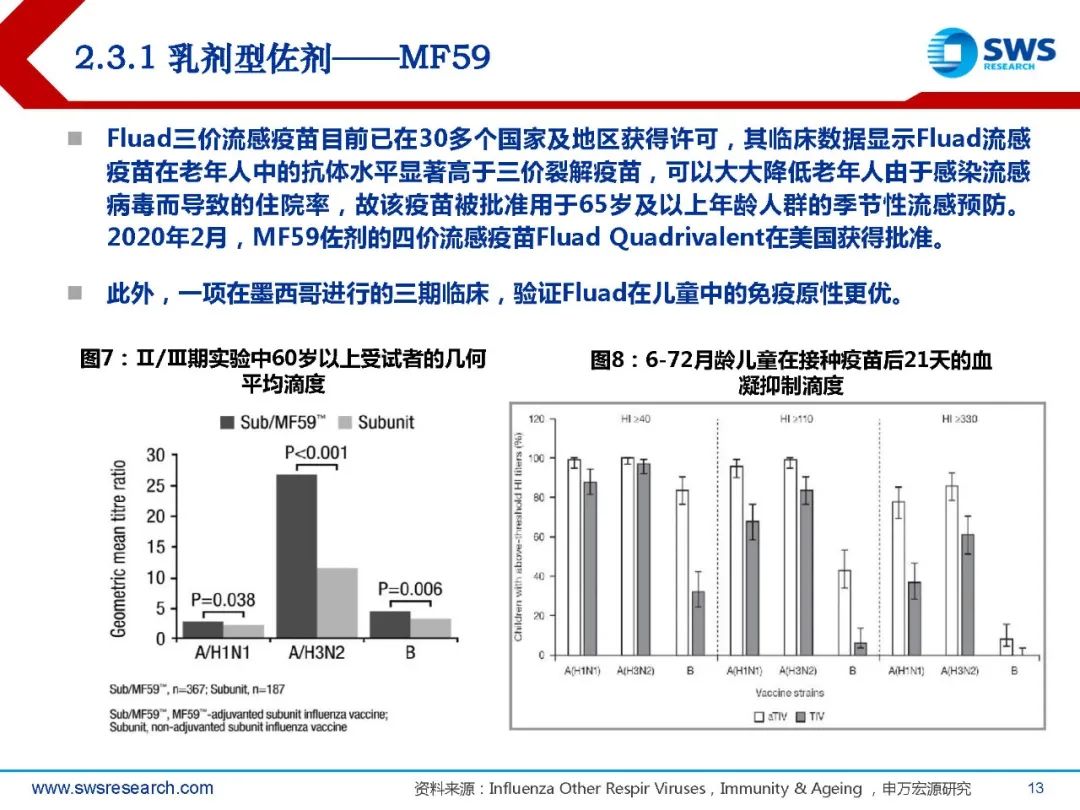
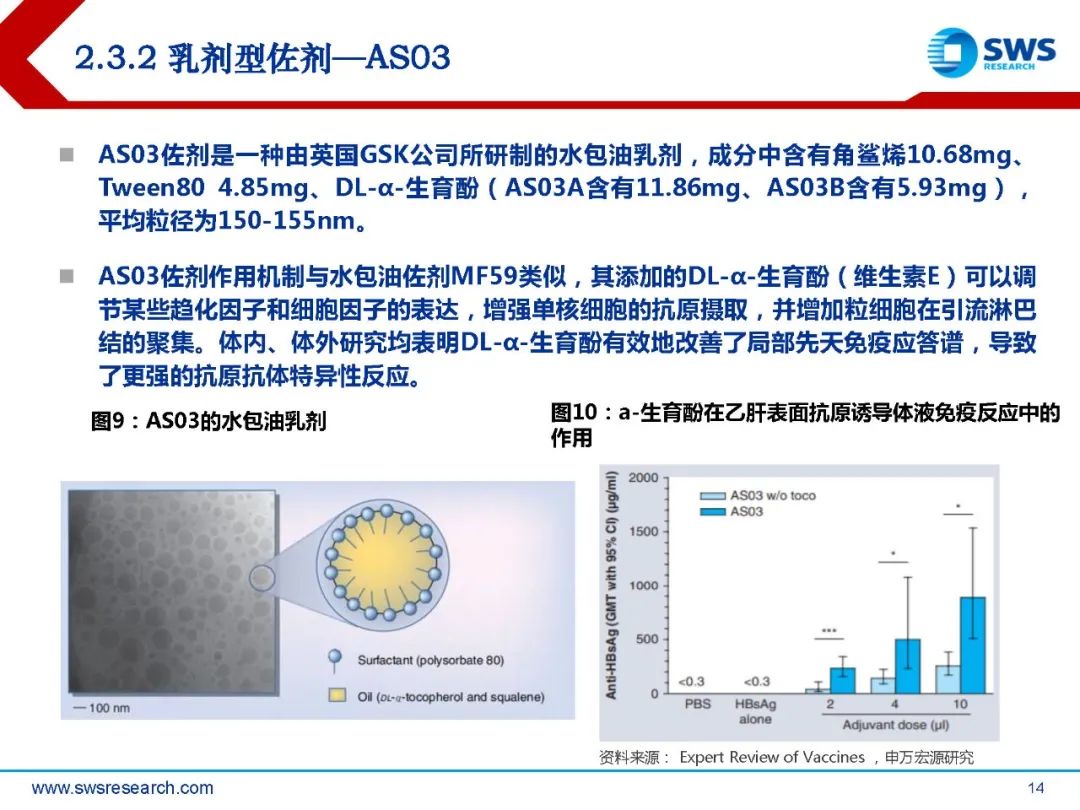
MF59佐剂是一种水包油乳剂,成分包含4-5%角鲨烯、0.5%Tween 80、0.5%三油 酸聚山梨酯(Span 85)。将Span85分散在含有角鲨烯和Tween80的缓冲液中,高速 搅拌至乳状。之后将乳剂反复用微射流机流射以形成o/w乳剂的微粒(160nm),再 过滤除菌。MF59乳剂制备后可保持稳定性达3年以上。1997年MF59作为佐剂的三价流感疫苗Fluad在欧洲获批,是继铝佐剂后第一个被列 入人用新型疫苗的佐剂,是疫苗佐剂历史上的一个重大里程碑。
MF59佐剂可诱导产生比铝佐剂更强的体液免疫反应。流感疫苗的动物实验结果显示, MF59佐剂的流感疫苗诱导的抗体免疫反应比铝佐剂高100倍,同时也能诱导产生一定 的Th1型细胞免疫反应。对MF59及其疫苗进行的GLP毒理学研究表明,MF59及其疫苗 没有潜在的系统毒性。
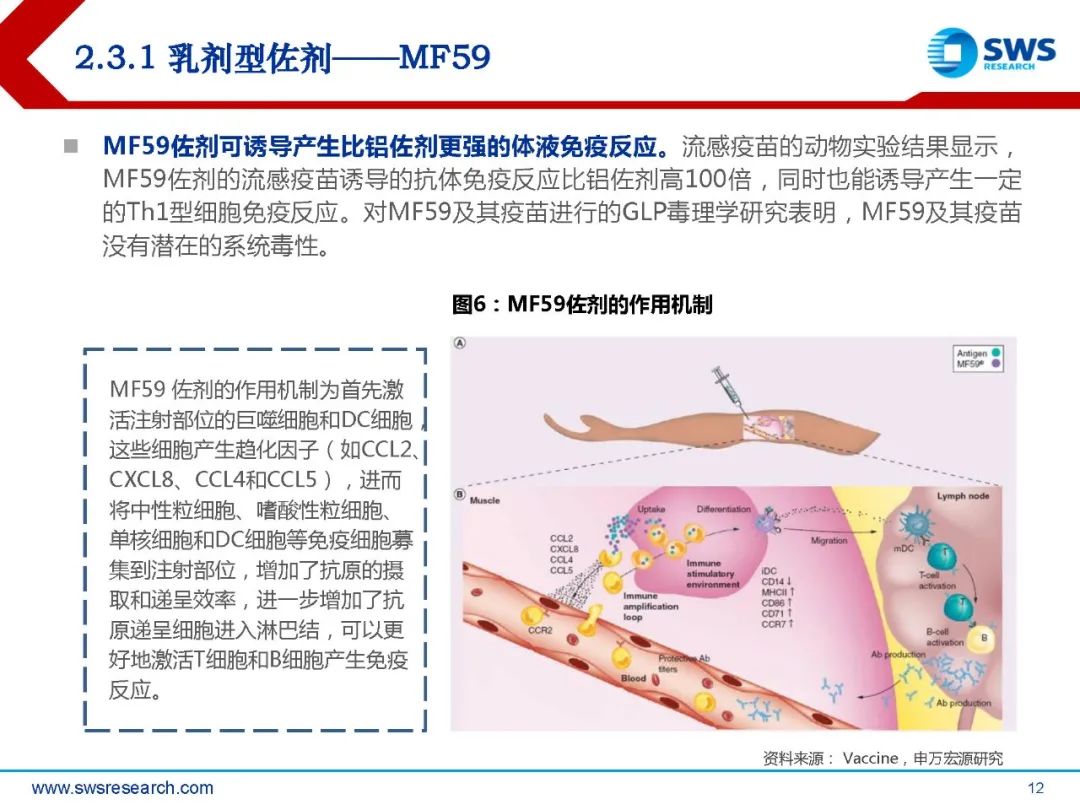
MF59 佐剂的作用机制为首先激 活注射部位的巨噬细胞和DC细胞, 这些细胞产生趋化因子(如CCL2、 CXCL8、CCL4和CCL5),进而 将中性粒细胞、嗜酸性粒细胞、 单核细胞和DC细胞等免疫细胞募 集到注射部位,增加了抗原的摄 取和递呈效率,进一步增加了抗 原递呈细胞进入淋巴结,可以更 好地激活T细胞和B细胞产生免疫 反应。
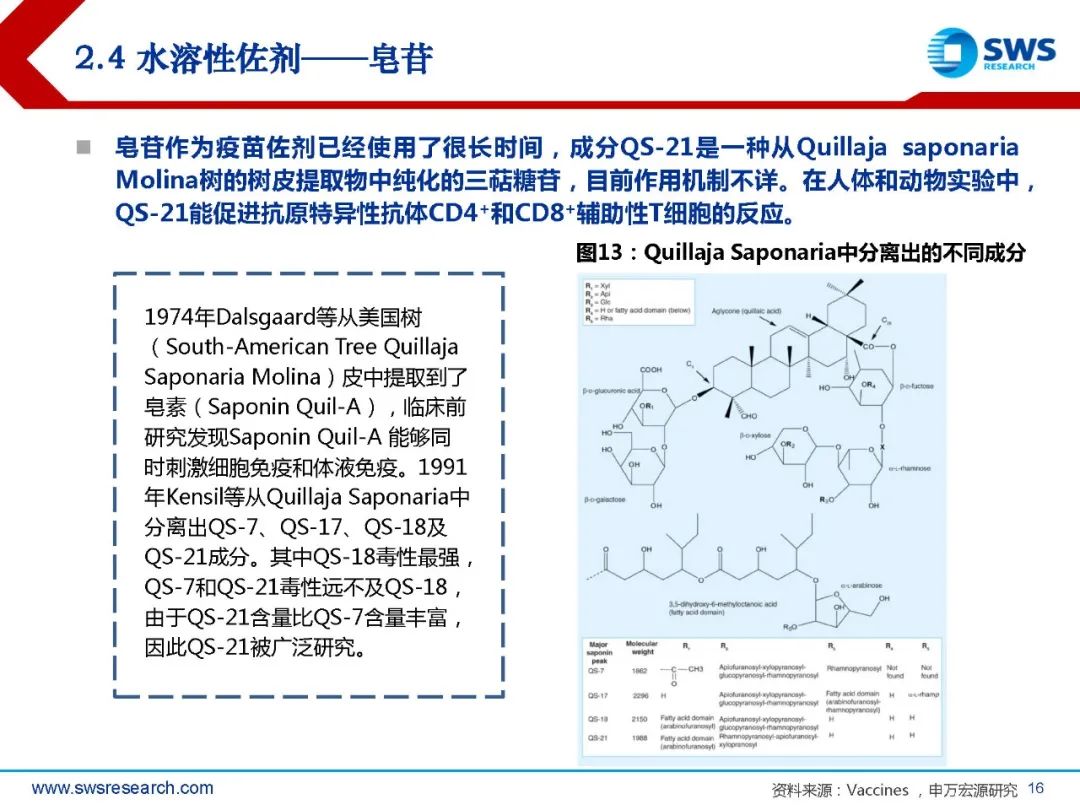
水溶性佐剂——皂苷
皂苷作为疫苗佐剂已经使用了很长时间,成分QS-21是一种从Quillaja saponaria Molina树的树皮提取物中纯化的三萜糖苷,目前作用机制不详。在人体和动物实验中, QS-21能促进抗原特异性抗体CD4+和CD8+辅助性T细胞的反应。
微粒抗原递呈系统佐剂——AS01
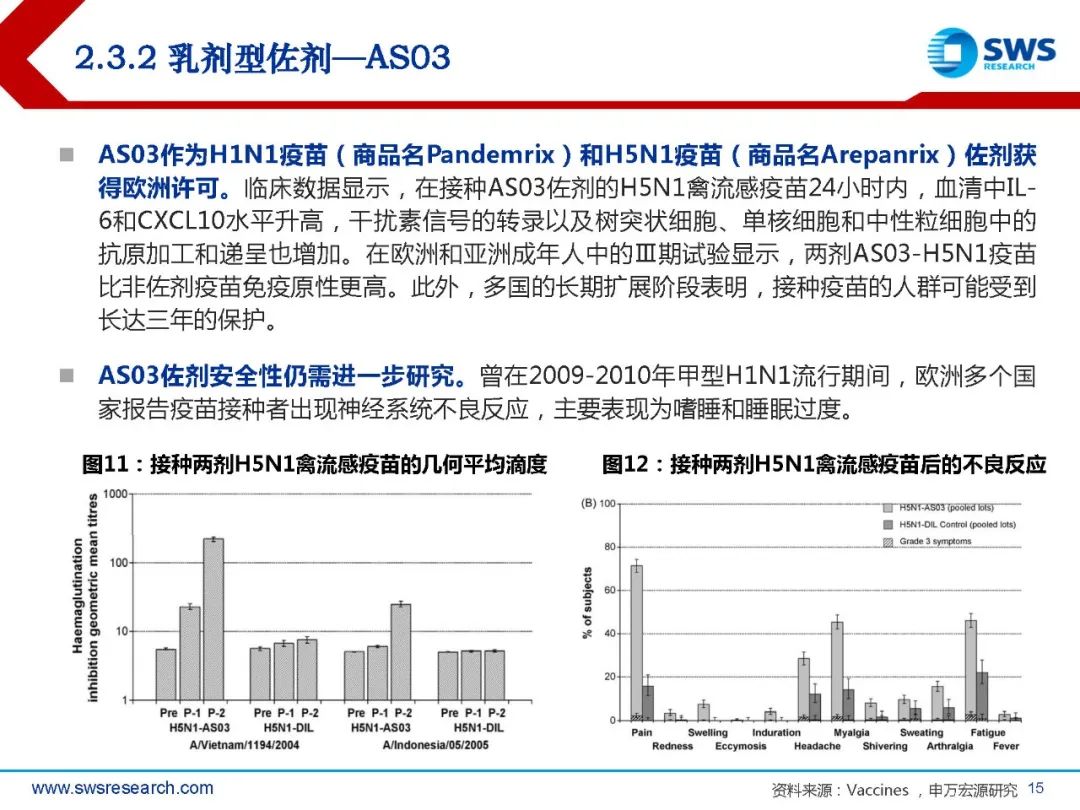
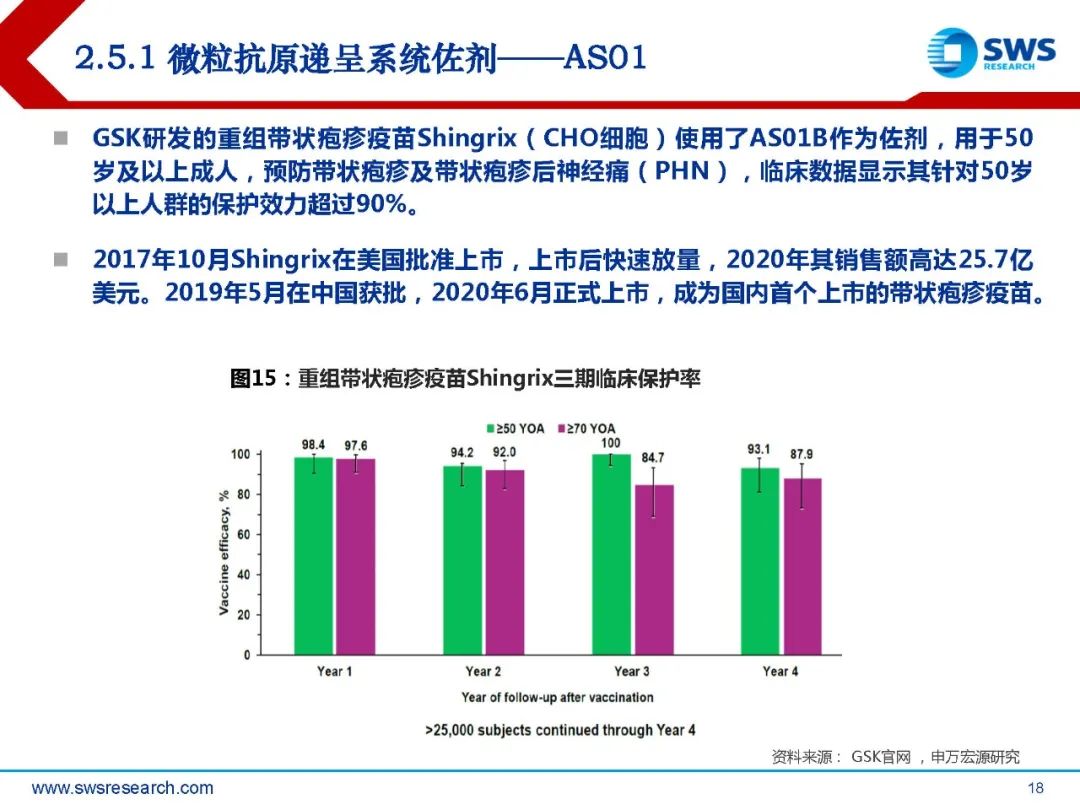
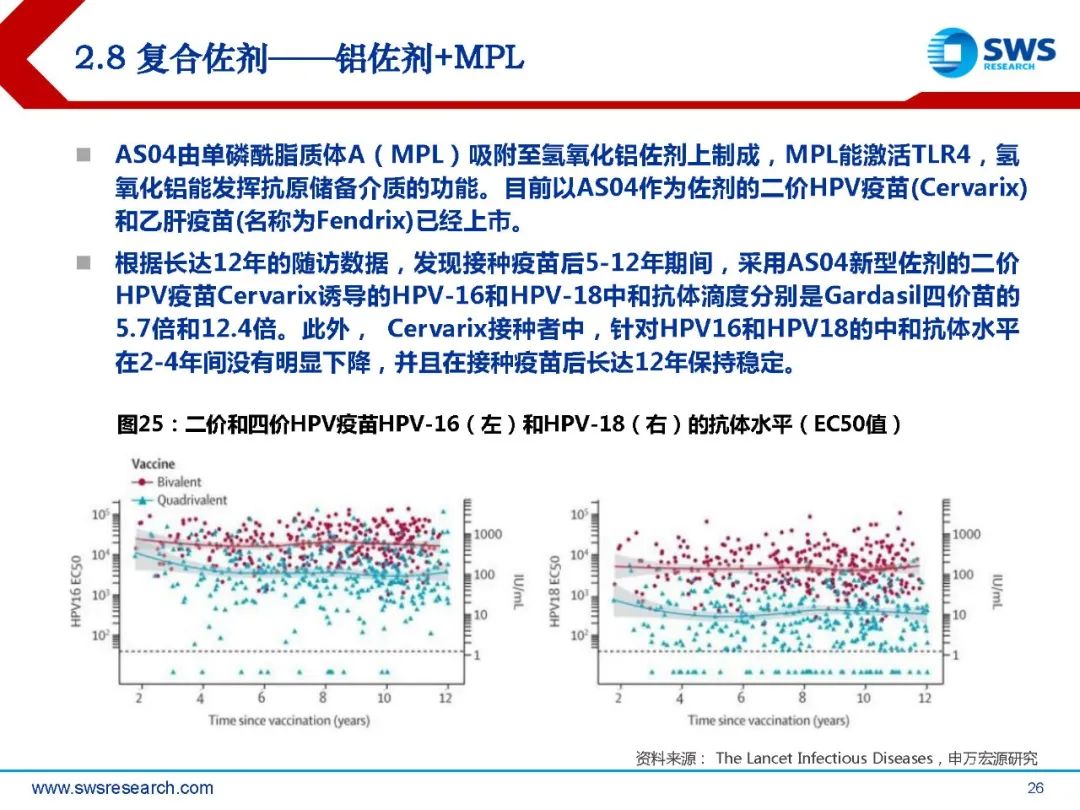
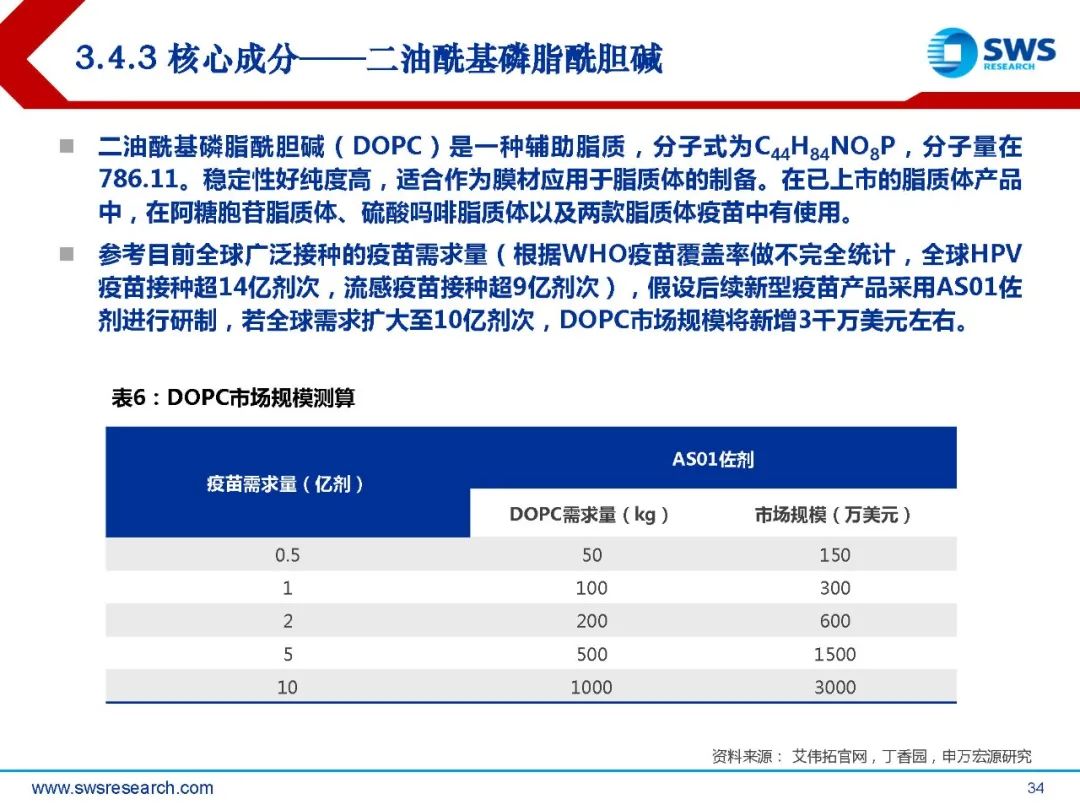
AS01是一种包含免疫刺激剂单磷酸酰脂质A(MPL)和皂树皂苷QS-21的脂质体佐剂。 成分包含皂树皂苷QS-21 50μg, 3-O-去酰基-4’-单磷酰脂A(MPL,沙门氏菌内毒 素脂多糖的解毒衍生物)50μg,二油酰基磷脂酰胆碱(DOPC)1mg,胆固醇 0.25mg。MPL和QS-21在有胆固醇存在的脂质体中共同配制。GSK研发的重组带状疱疹疫苗Shingrix(CHO细胞)使用了AS01B作为佐剂,用于50 岁及以上成人,预防带状疱疹及带状疱疹后神经痛(PHN),临床数据显示其针对50岁 以上人群的保护效力超过90%。2017年10月Shingrix在美国批准上市,上市后快速放量,2020年其销售额高达25.7亿 美元。2019年5月在中国获批,2020年6月正式上市,成为国内首个上市的带状疱疹疫苗。
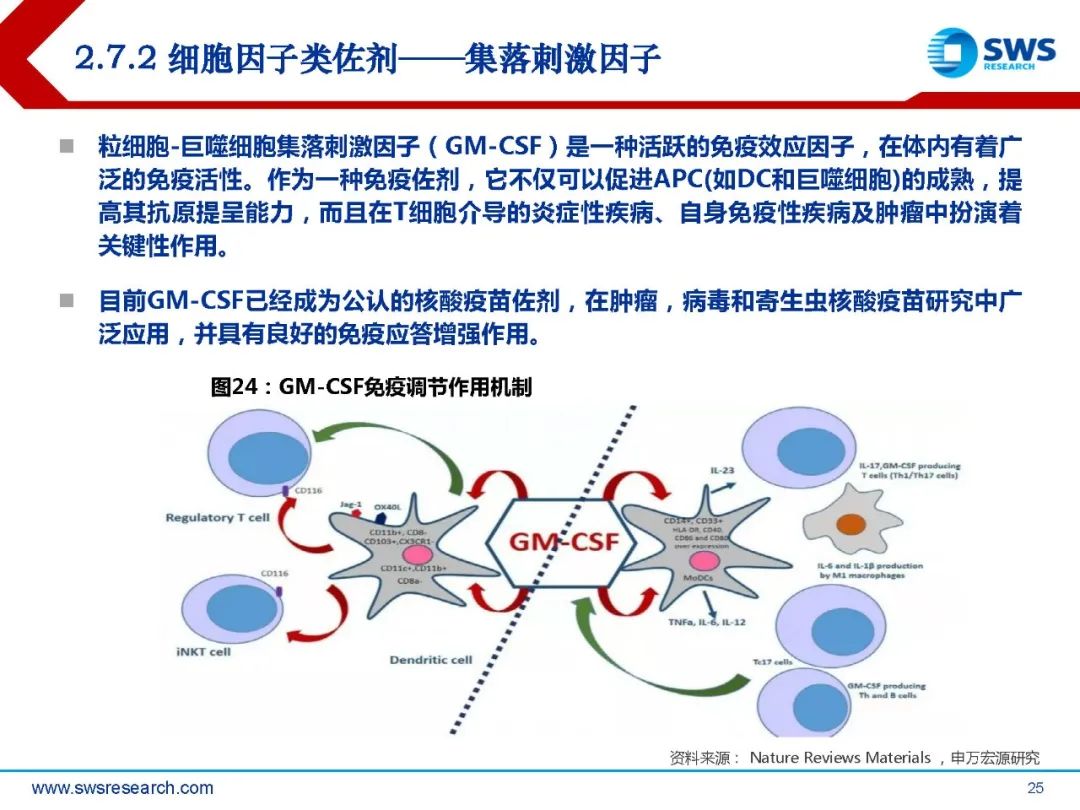
其作用机制来源于两种免疫刺激剂 MPL和QS-21:MPL通过Toll样受 体4(TLR4)激活天然免疫系统, 可直接激活表达TLR4的抗原递呈 细胞,刺激细胞因子的分泌和协同 刺激分子的表达;QS-21能激活被 膜下淋巴窦巨噬细胞(SSMs)中的 半胱天冬酶1(Caspase 1)。两 种成分同时作用于固有免疫系统, 能协同激活新的通路。但QS-21具 有溶血性,需要配合胆固醇和脂质 体形式使用以消除副作用。
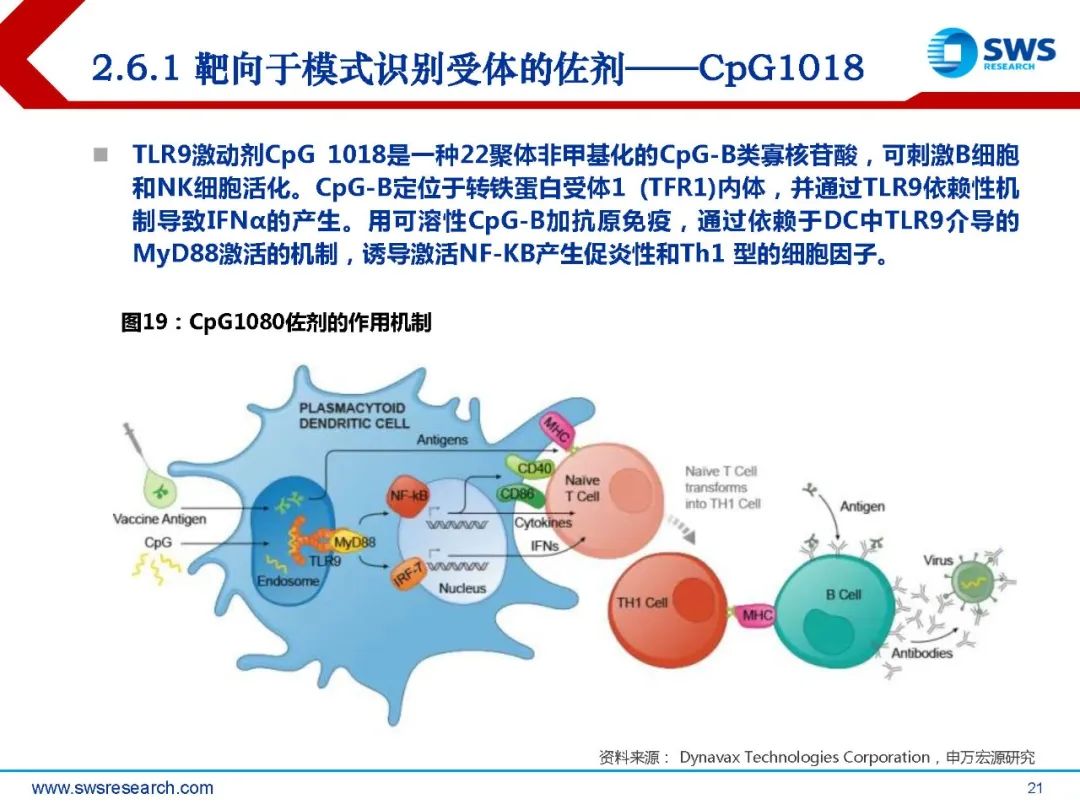
靶向于模式识别受体的佐剂
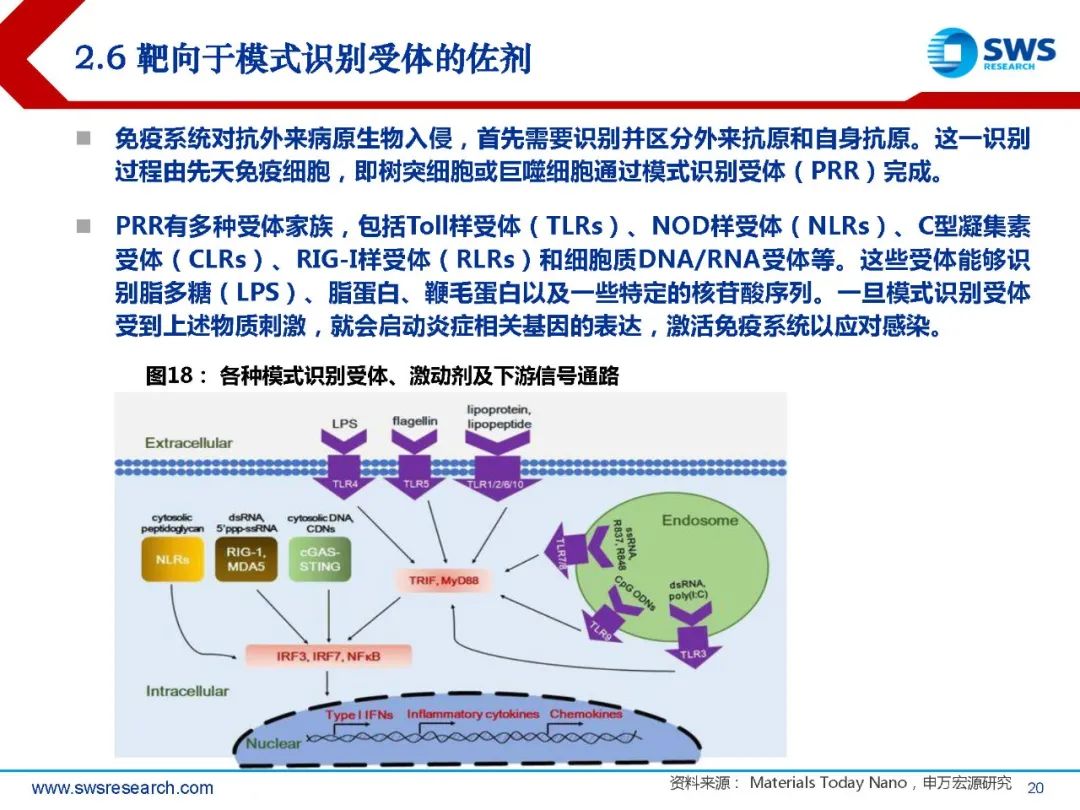
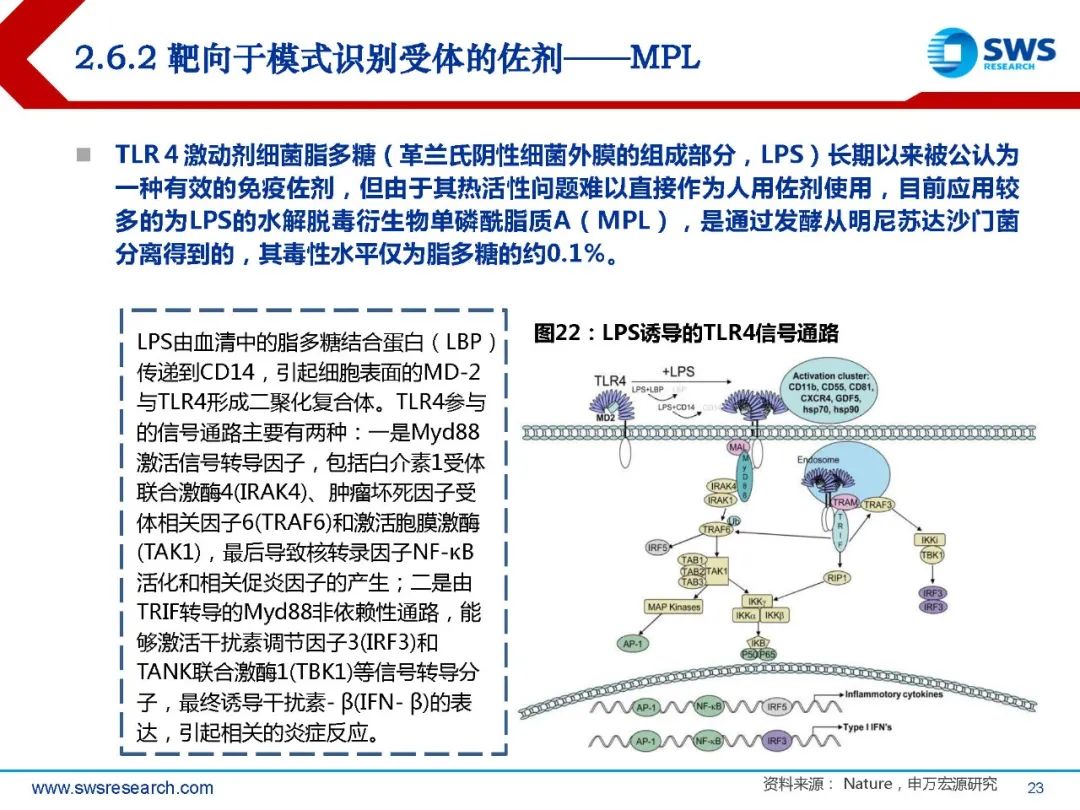
免疫系统对抗外来病原生物入侵,首先需要识别并区分外来抗原和自身抗原。这一识别 过程由先天免疫细胞,即树突细胞或巨噬细胞通过模式识别受体(PRR)完成。PRR有多种受体家族,包括Toll样受体(TLRs)、NOD样受体(NLRs)、C型凝集素 受体(CLRs)、RIG-I样受体(RLRs)和细胞质DNA/RNA受体等。这些受体能够识 别脂多糖(LPS)、脂蛋白、鞭毛蛋白以及一些特定的核苷酸序列。一旦模式识别受体 受到上述物质刺激,就会启动炎症相关基因的表达,激活免疫系统以应对感染。
细胞因子类佐剂——IL
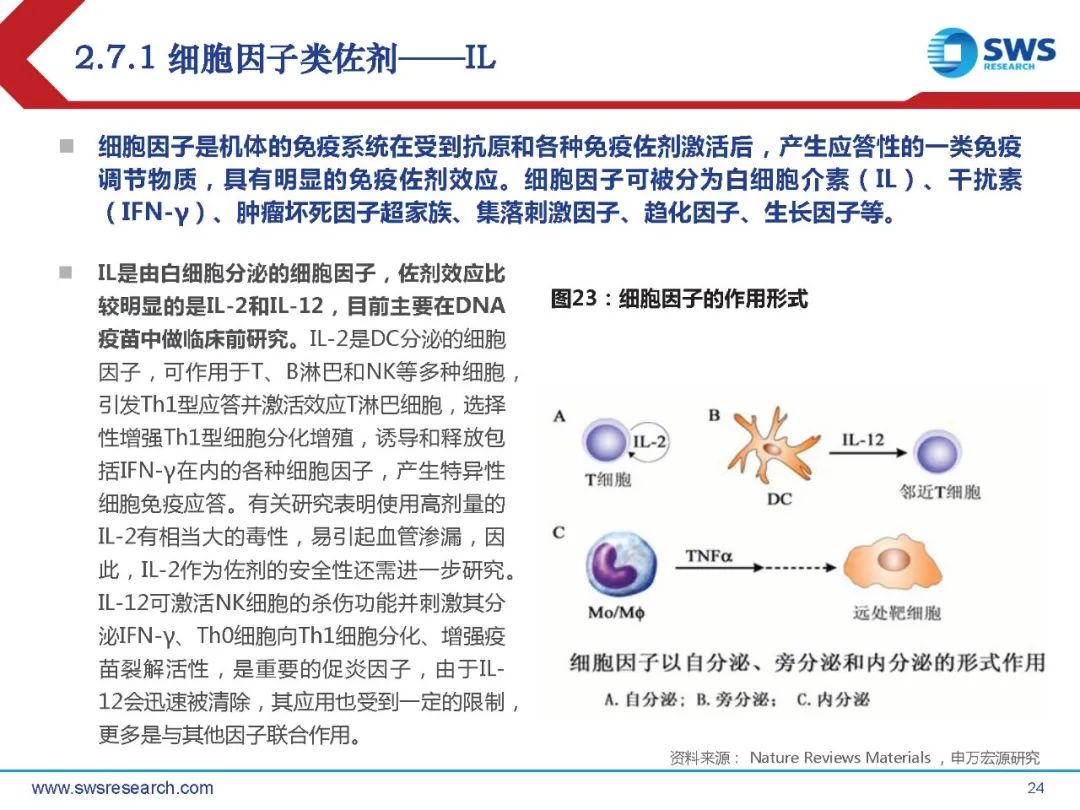
细胞因子是机体的免疫系统在受到抗原和各种免疫佐剂激活后,产生应答性的一类免疫 调节物质,具有明显的免疫佐剂效应。细胞因子可被分为白细胞介素(IL)、干扰素 (IFN-γ)、肿瘤坏死因子超家族、集落刺激因子、趋化因子、生长因子等。
IL是由白细胞分泌的细胞因子,佐剂效应比 较明显的是IL-2和IL-12,目前主要在DNA 疫苗中做临床前研究。IL-2是DC分泌的细胞 因子,可作用于T、B淋巴和NK等多种细胞, 引发Th1型应答并激活效应T淋巴细胞,选择 性增强Th1型细胞分化增殖,诱导和释放包 括IFN-γ在内的各种细胞因子,产生特异性 细胞免疫应答。有关研究表明使用高剂量的 IL-2有相当大的毒性,易引起血管渗漏,因 此,IL-2作为佐剂的安全性还需进一步研究。IL-12可激活NK细胞的杀伤功能并刺激其分 泌IFN-γ、Th0细胞向Th1细胞分化、增强疫 苗裂解活性,是重要的促炎因子,由于IL12会迅速被清除,其应用也受到一定的限制, 更多是与其他因子联合作用。
3. 佐剂的产业链分析
3.1 佐剂的市场空间
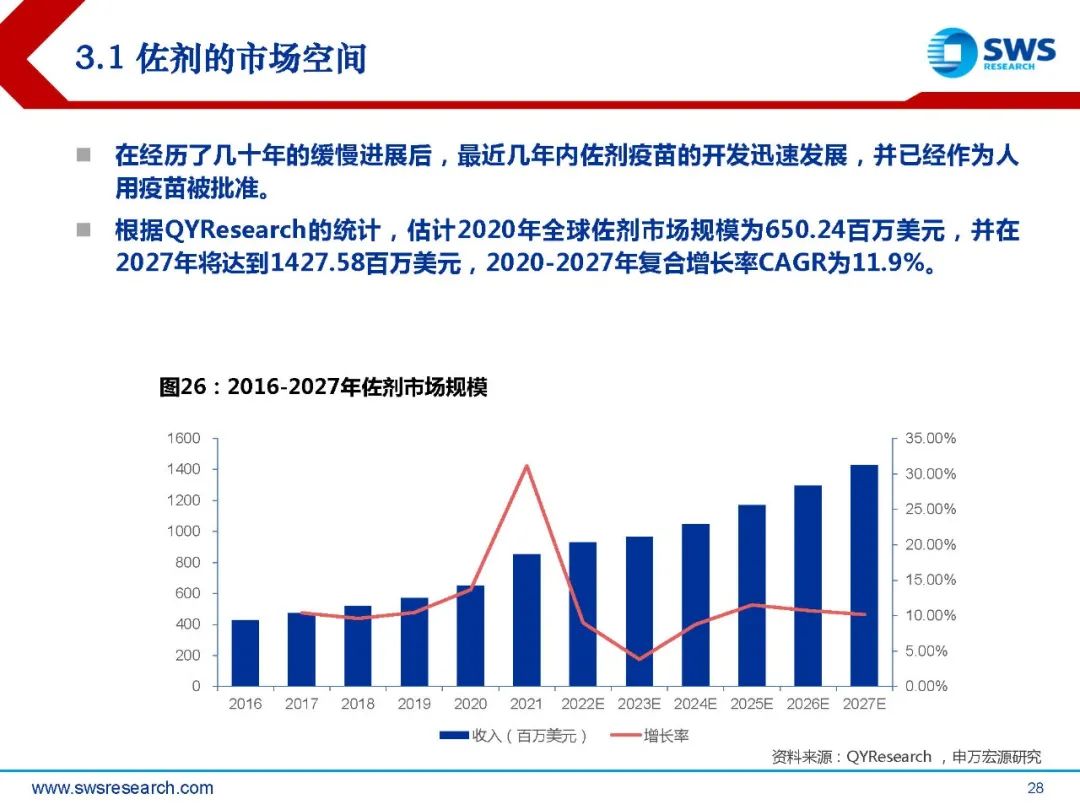
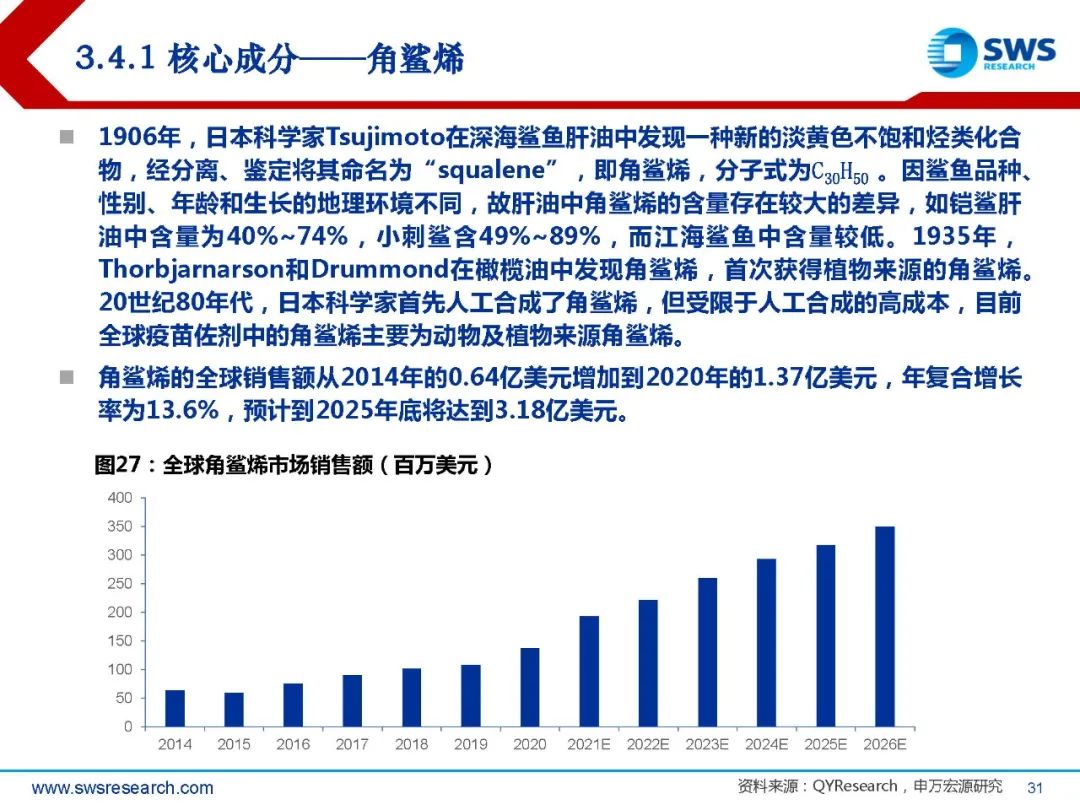
在经历了几十年的缓慢进展后,最近几年内佐剂疫苗的开发迅速发展,并已经作为人 用疫苗被批准。根据QYResearch的统计,估计2020年全球佐剂市场规模为650.24百万美元,并在 2027年将达到1427.58百万美元,2020-2027年复合增长率CAGR为11.9%。
3.2 佐剂的应用
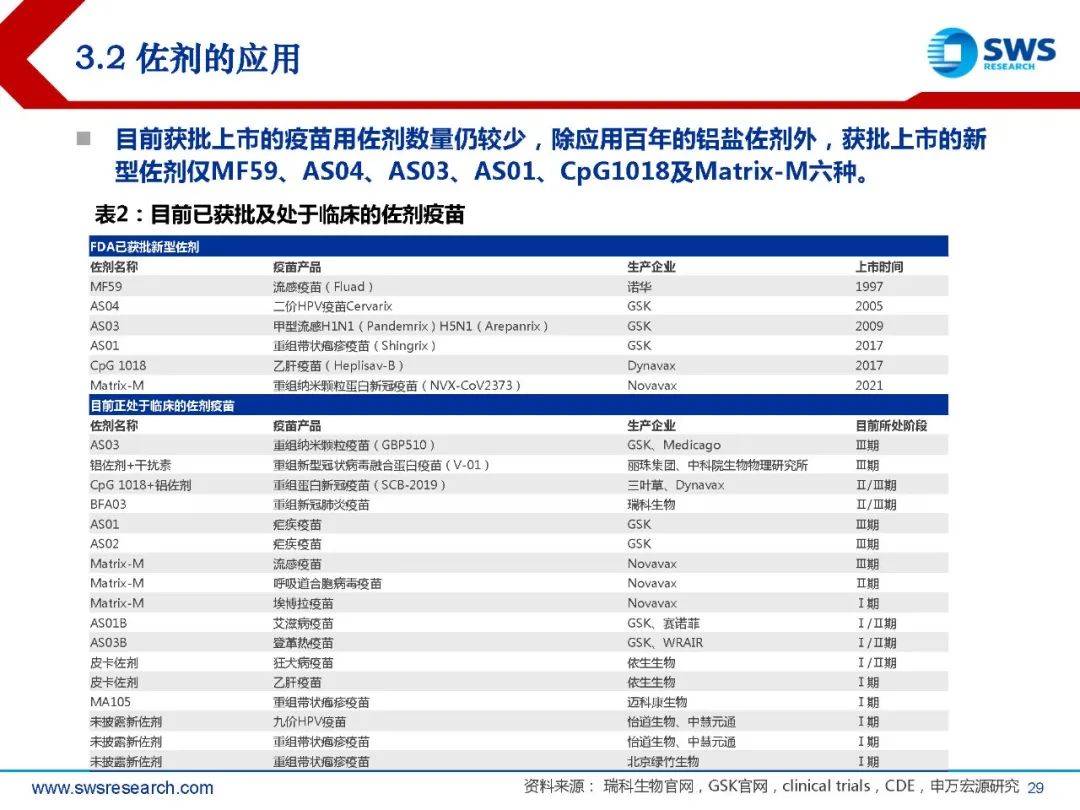
目前获批上市的疫苗用佐剂数量仍较少,除应用百年的铝盐佐剂外,获批上市的新 型佐剂仅MF59、AS04、AS03、AS01、CpG1018及Matrix-M六种。
3.3 佐剂产业链
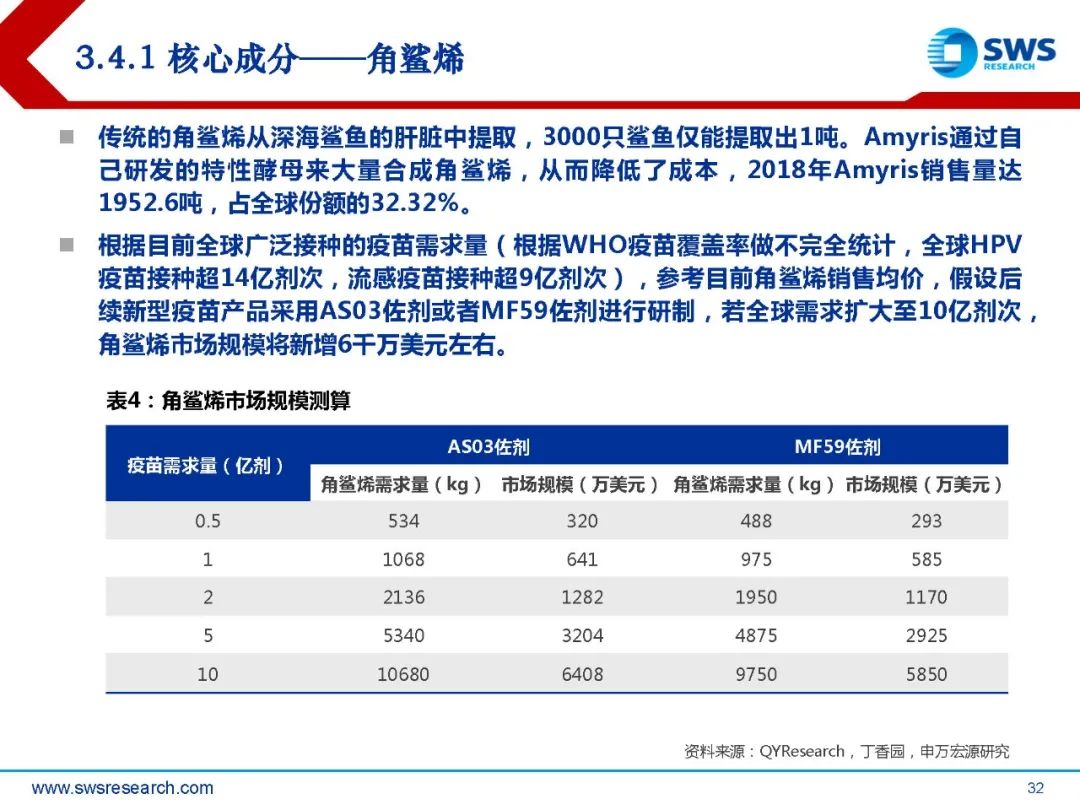
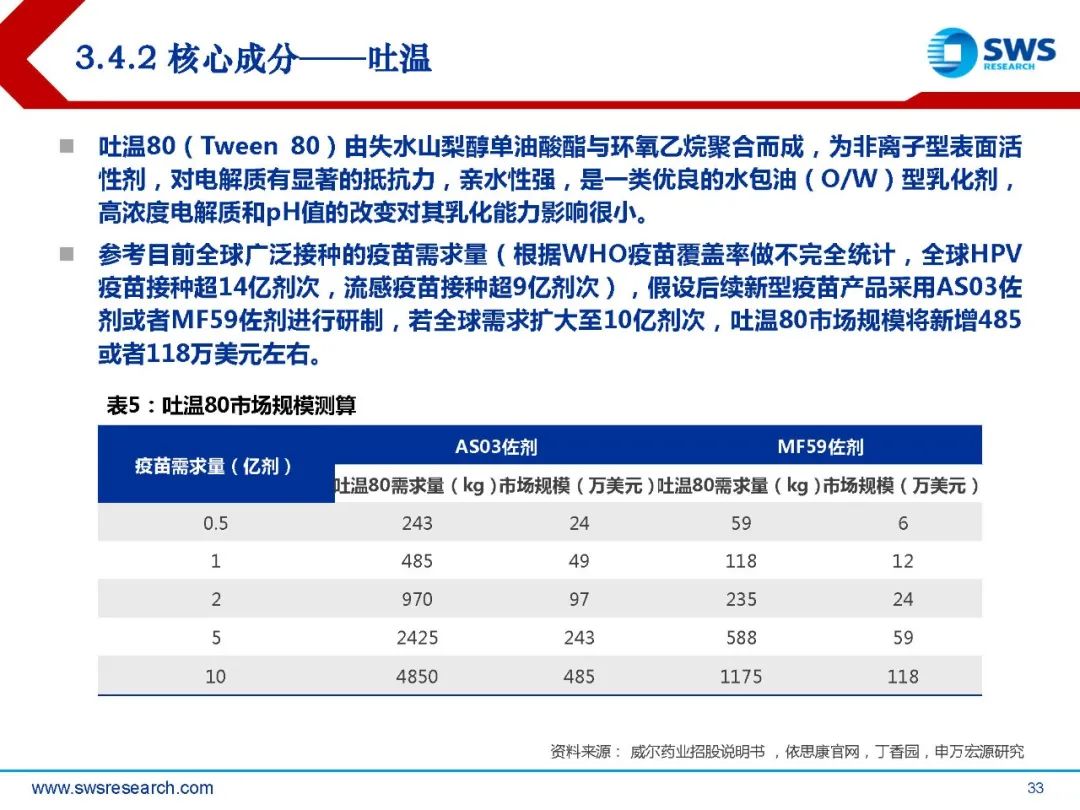
根据目前已获批的新型佐剂,相关的活性成分主要包括角鲨烯、吐温80、单磷酰脂质 A以及皂苷提取物。根据Evaluate Pharma测算,全球人用疫苗市场2015-2019年复合增长率为7.8%, 2020年市场规模约410亿美元;疫苗市场的快速扩容将带来佐剂市场及相关活性原材 料需求的快速增加。