报告出品方/作者:安信证券/马帅
图片资料来源:安信证券研究中心绘制
01
生命科学研究工具库,黄金赛道“卖水人”
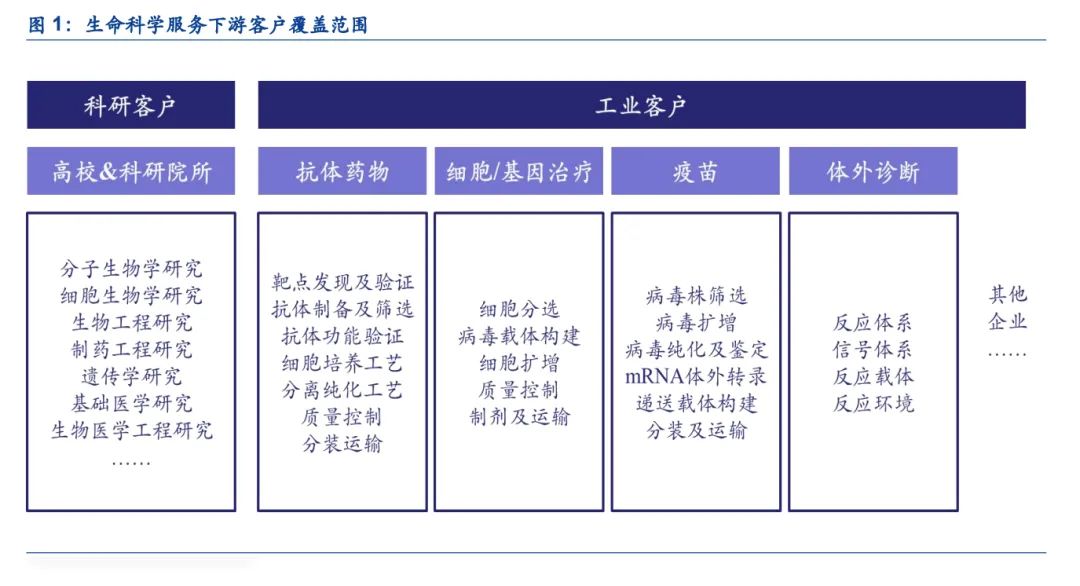
生命科学服务下游用途广泛,同时覆盖科研客户和工业客户。从下游客户来看,生命科学服务同时覆盖科研客户和工业客户:(1)科研客户是指从事基础科学研究的高等院校和科研院所,包括但不限于分子生物学、细胞生物学、生物工程、制药工程、遗传学、基础医学、生物医学工程等研究方向,一般以课题组为单位进行采购。(2)工业客户是指从事生命科学研究的各类企业,包括但不限于抗体药物研发企业、细胞/基因治疗企业、疫苗企业、体外诊断企业等,产品应用覆盖从研发到生产的各个环节。在上一篇生命科学服务图谱报告中,我们基于产品维度,从科研试剂、实验耗材、仪器设备、综合服务等方面全面解读了生命科学服务涉及到的产品及品牌。本篇报告我们将基于应用维度,重点聚焦企业客户需求,重新对生命科学服务行业进行解读,全面展现生命科学产业链“卖水人”的风采。
02
抗体药物:
分为研发端和生产端,关注自主可控
2.1. 抗体药物研发端
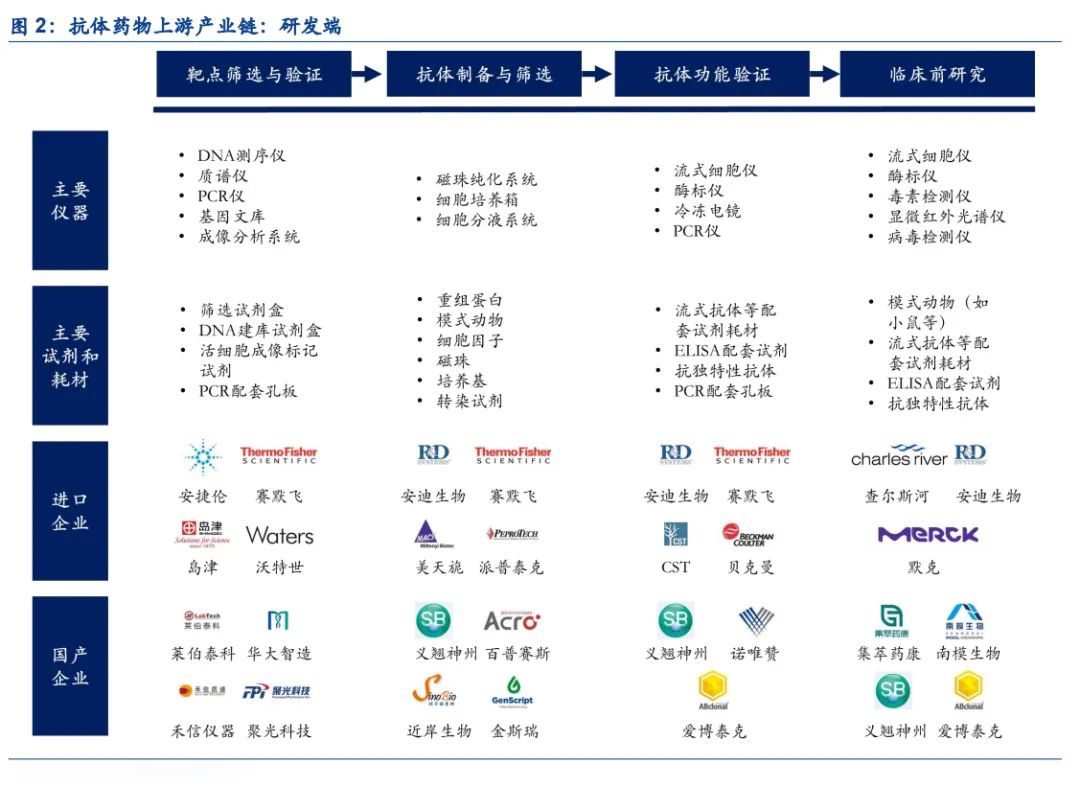
近年来单克隆抗体药物得到快速发展,根据Frost&Sullivan,2020年中国单克隆抗体市场规模为411亿元人民币,预计到2025年市场规模将达到1,945 亿元人民币,2020-2025年的年复合增长率达到36.5%。抗体药物的研发,需要经历靶点筛选与验证、抗体制备与筛选、抗体功能验证、临床前研究等阶段,涉及大量仪器设备、试剂及耗材的使用。
(1)靶点筛选与验证:抗体药物开发的起点,尤其是新靶点的发现需要更多的探索性工作,通过结合基因测序、质谱分析、成像分析等手段,筛选出具有开发潜力的创新靶点。该过程主要涉及DNA测序仪、质谱仪等大型分析仪器的使用,同时在检测过程中需要使用配套的试剂和耗材。
(2)抗体制备及筛选:根据技术路径的不同,抗体的制备可以分为杂交瘤细胞、转基因小鼠、单B细胞克隆、噬菌体展示等方法,抗体的筛选主要通过磁珠分选的方式进行。在实验过程中,靶点蛋白(重组蛋白)是刺激宿主生成抗体的重要原材料,磁珠是筛选抗体的重要原材料,得到广泛使用。此外用于细胞培养的培养基、细胞因子、细胞培养箱等使用也较为频繁。
(3)抗体功能验证:筛选出来的单克隆抗体需要进行理化性质、免疫学特性、效应作用等指标的检测,从而评估目标单克隆的功能作用。该过程既涉及到流式细胞仪、酶标仪、PCR仪等仪器设备的使用,也会涉及到流式抗体、ELISA试剂盒、抗独特性抗体等试剂耗材的使用。
(4)临床前研究:开展临床试验之前,还需要对单克隆抗体进行PK(药代动力学)、PD(药效动力学)等临床前的分析研究,这个阶段已经开始进行小试阶段的生产,同时需要开展动物学试验。该过程主要涉及流式细胞仪、酶标仪、毒素检测仪等仪器设备,同时需要使用模式动物、流式抗体、ELISA试剂盒等试剂耗材。
2.2. 抗体药物生产端
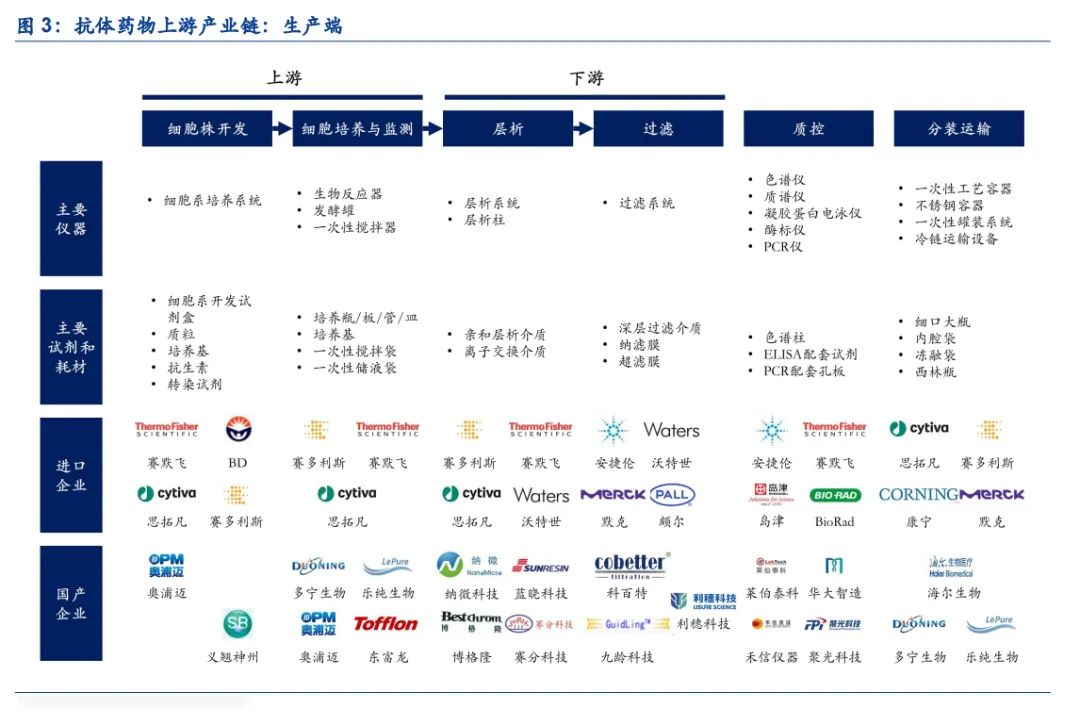
抗体药物的生产,分为上游工艺和下游工艺两个部分,其中上游工艺包括细胞株开发、细胞培养与监测等,下游工艺包括层析、过滤等分离纯化过程,此外后续还需要进行质量控制、 分装运输等环节。根据纳微科技招股说明书,单克隆抗体生产中,上游细胞培养成本占生产成本的35%左右,下游分离纯化成本占生产成本的65%左右,其中培养基、一次性反应袋、层析填料、滤膜等消耗性原料用量最大,是影响生产成本的关键材料。
(1)细胞株开发:CHO细胞具有人源化、传代效率高等优势,目前大部分抗体药物选择CHO细胞作为表达载体,因此开发出具有高表达能力的稳定细胞株至关重要。该过程主要涉及实验室条件下的细胞培养和细胞筛选,因此主要使用培养基、细胞系开发试剂盒、细胞系培养系统等工具。
(2)细胞培养与监测:细胞培养环节是抗体药的核心生产工艺,根据生产规模的要求使用不同型号的生物反应器。一次性工艺是行业发展趋势,因此涉及到一次性搅拌袋、一次性储液袋等关键耗材,此外伴随产能的提升,对于培养基等关键原材料的消耗存在明显放大效应。
(3)层析:根据反应原理的不同,抗体药物的层析主要涉及亲和层析、阳离子交换层析、阴离子交换层析等环节,因此主要涉及Protein-A亲和层析介质、离子交换层析介质等关键层析填料,同时根据产能要求提供层析系统的定制。
(4)过滤:抗体药物的过滤主要包括深层过滤、纳滤(NF)、超滤或渗滤(UF/DF)等环节, 因此主要涉及各类过滤系统及滤膜的使用,其中深层过滤通常使用纤维、滤纸等过滤介质,主要用于预过滤,纳滤主要用于病毒的清除,超滤主要用于单抗药物的浓缩。
(5)质控:每批次单克隆抗体药物生产完成后,均需要进行相关的质量控制(QC),主要涉及抗体活性等指标的检测,该过程主要涉及质谱仪、色谱仪、PCR仪等大型分析仪器的使用,同时在检测过程中需要使用配套的试剂和耗材。(报告来源:未来智库)
03
细胞/基因治疗:
研发生产一体化,试剂耗材需求旺盛
3.1. 细胞治疗上游产业链
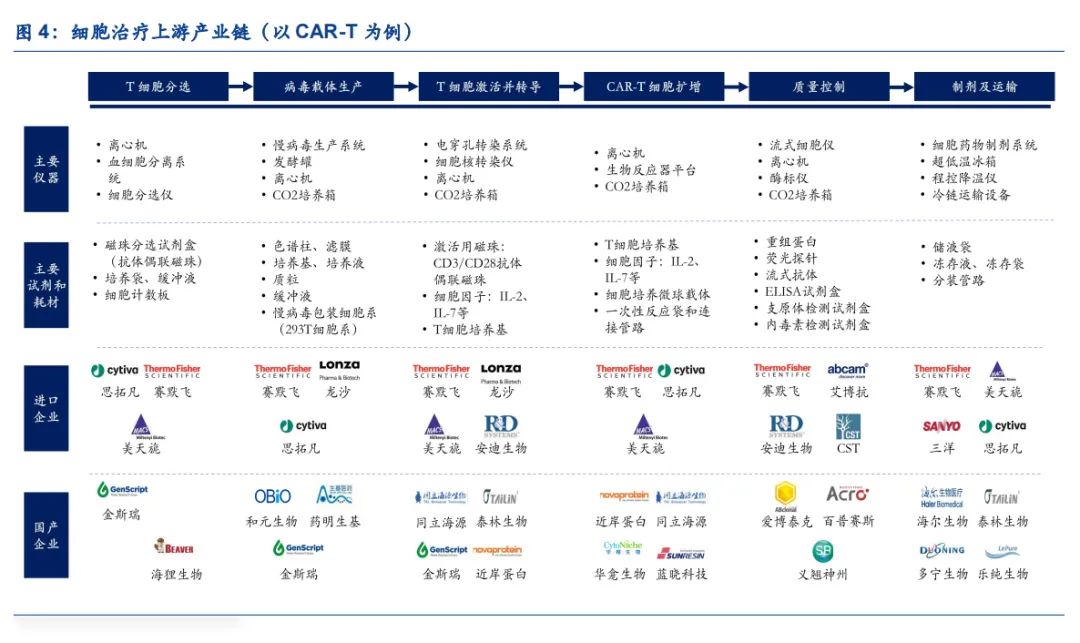
细胞治疗是指通过改造患者自体细胞进行治疗的方法,由于需要针对不同患者进行定制化开发,因此具有研发生产一体化的特点。根据Frost&Sullivan,预计中国细胞治疗市场规模将从2021年的13亿元增长至2030年的584亿元,复合增长率达到53%。以CAR-T细胞疗法为例,核心工艺流程包括T细胞分选、病毒载体生产、T细胞激活并转导、CAR-T细胞扩增、质量控制、制剂及运输等环节。定制化的属性导致CAR-T的生产成本非常高,参考文献《Cancer Therapy and Prevention》,目前每例CAR-T治疗的可变成本达到46,397美元,其中主要涉及病毒、磁珠、一次性管路、细胞因子、培养基等关键试剂耗材。
(1)T细胞分选:细胞疗法需要首选从患者体内采集外周血并进行分离,再通过磁珠分选的方式筛选出目标T细胞,自动化、封闭式的细胞分选系统是行业发展方向,决定分选结果的关键耗材是具有磁性分离作用的分选磁珠。
(2)病毒载体生产:CAR基因的转导技术包括病毒载体转染和电穿孔转染,如果选择病毒 载体的转染方式,企业需要具备GMP级别的病毒生产能力,或者通过CDMO企业进行外包生产。其中慢病毒的应用最为广泛,无血清悬浮培养工艺是行业发展趋势,培养基和质粒是关键原材料。
(3)T细胞激活并转导:通过CD3/CD28抗体偶联磁珠可以对目标T细胞进行激活,然后利用生产好的病毒载体或者电穿孔转染系统进行CAR基因转导,细胞培养箱、T细胞培养基和细胞因子扮演重要角色。
(4)CAR-T细胞扩增:转染得到的CAR-T细胞需要进行大规模的体外扩增,培养基为CAR-T细胞提供合适的生长环境,细胞因子可以刺激细胞生长及分化,细胞培养微球载体可以提升培养效率,一次性反应袋及连接导管使用后可以直接更换。
(5)质量控制:扩增后的CAR-T细胞需要进行CAR分子表达鉴定、T细胞亚型鉴定、T细胞功能鉴定、内毒素含量等检测,主要涉及重组蛋白、荧光探针、流式抗体、ELISA试剂盒等生物试剂的使用。
3.2. 基因治疗上游产业链
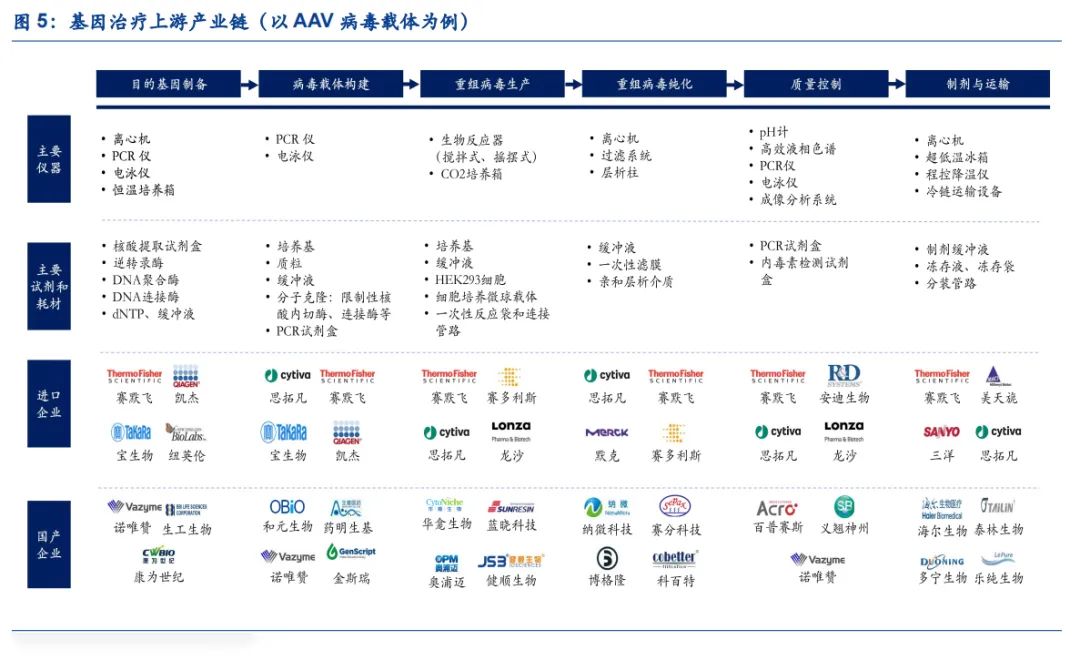
基因治疗是指将外源基因通过病毒载体递送至体内,进而解决基因缺陷问题的治疗方式。根据Frost & Sullivan,预计中国基因治疗市场规模将从2021年的2.68亿元增长至2025年的179亿元,年复合增长率达到276%。以AAV病毒载体基因治疗为例,核心工艺路径包括目的基因制备、病毒载体构建、重组病毒生产、重组病毒纯化、质量控制、制剂及运输等环节。
(1)目的基因制备:通常采用逆转录方法,以RNA作为模板通过逆转录过程得到cDNA,进一步制备目的基因的方式。该过程主要涉及核酸提取试剂盒、逆转录酶、DNA聚合酶、DNA连接酶等分子类生物试剂。
(2)病毒载体构建:目的基因的递送需要腺病毒、腺相关病毒(AAV)、慢病毒、逆转录病毒等作为载体,其中AAV病毒的应用最为广泛,将携带有目的基因的质粒转染天然AAV病毒得到重组AAV病毒,需要用到质粒及分子克隆相关的酶。
(3)重组病毒生产:AAV病毒的生产通常会采用HEK293细胞进行培养,由于HEK293具有贴壁生长的特点,经过驯化可以获得具备悬浮生长能力的稳定细胞株,通常会采用无血清培养基,此外使用微球载体可以加速细胞的生长速度。
(4)重组病毒纯化:科研级别的AAV病毒纯化可以采用密度梯度离心的方式,商业化生产中需要结合层析、过滤等纯化方式,主要涉及亲和层析介质、一次性滤膜等专用耗材。
(5)质量控制:纯化得到的AAV病毒需要进行安全性、纯度等指标的检测,主要涉及高效液相色谱、PCR仪、电泳仪等设备,以及PCR试剂盒、内毒素检测试剂盒等生物试剂。
04
疫苗:不同技术路径存在明显差异,
新技术孕育新机遇
4.1. 传统疫苗上游产业链
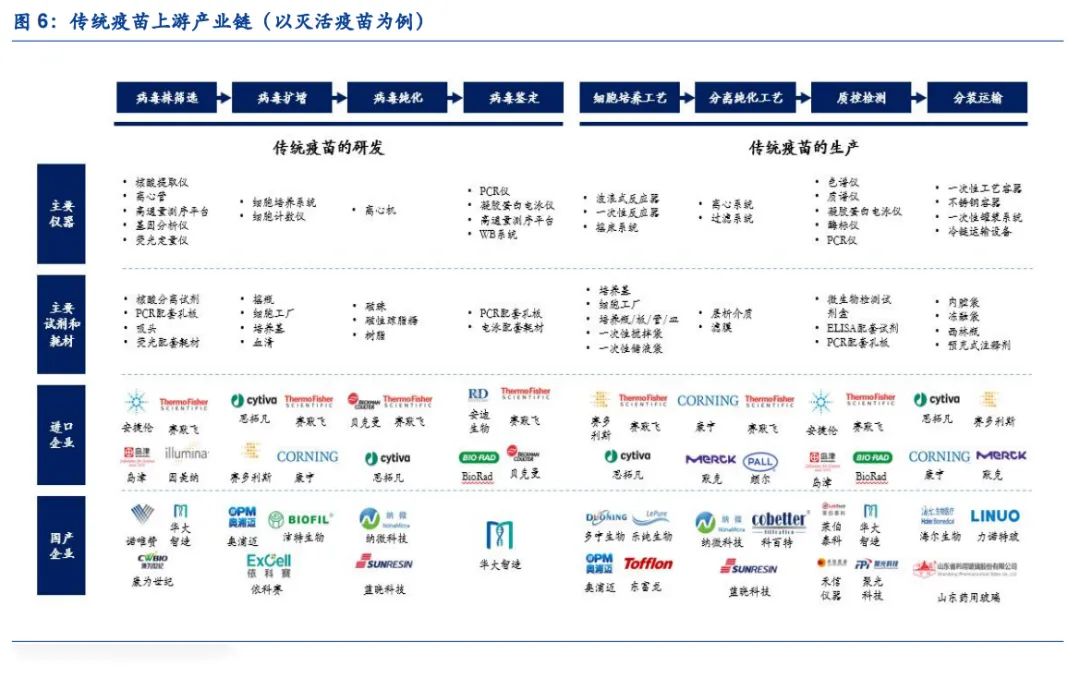
近年来疫苗行业得到快速发展,根据灼识咨询,中国疫苗市场规模由2015年的 251亿元增长至2020年的640亿元,并预计将于2030年进一步增长至2,071亿元(COVID-19 疫苗除外),年复合增长率达到12.5%。传统疫苗是指采用完整的病原体作为抗原,通过物理或化学方法处理,使其丧失感染性或毒性,同时保持良好的免疫原性,是最常见的疫苗技术路径。以灭活疫苗为例,传统疫苗的研发需要经历病毒株筛选、病毒扩增、病毒纯化和病毒鉴定等阶段,生产阶段需要经历细胞培养工艺、分离纯化工艺、质控检测、分装运输等环节,涉及大量仪器设备、试剂及耗材的使用。
(1)病毒株筛选:传统疫苗研发的起点工作,通过结合核酸提取、基因测序、基因分析等手段,筛选出后续符合要求的病毒株。该过程主要涉及到核酸提取仪、高通量测序仪、基因分析仪、荧光分析仪等大型分析仪器的使用,同时在检测过程中需要使用配套的试剂和耗材。
(2)病毒的扩增:在筛选得到目的病毒株后,需要对该病毒进行扩增培养,该过程需要一系列培养所需的仪器和试剂耗材,涉及到细胞培养系统、细胞技术仪等仪器和细胞工厂、培养基、血清等耗材。
(3)病毒的纯化:病毒纯化环节需要对蛋白样品进行脱盐和透析,臵换缓冲液或去除溶液中的杂质,同时需要一系列蛋白纯化填料,因此涉及到离心机等仪器和磁珠、磁性琼脂糖、树脂等耗材。
(4)病毒的鉴定:从培养的细胞中分离病毒后,需要采用免疫荧光和分装生物学技术进行病毒的鉴定,病毒鉴定涉及到病毒核酸和病毒蛋白的检测技术,因此通常需要使用PCR仪、凝胶蛋白电泳仪、高通量测序平台、WB系统等仪器和配套的耗材。
(5)细胞培养工艺:细胞培养工艺是传统疫苗的核心生产环节,生产过程中需要用到一系列反应器等,主要包含波浪式反应器、一次性反应器、摇床系统等仪器,同时还有培养基等试剂和细胞工厂、一次性搅拌袋、一次性储液袋和细胞瓶等耗材。
(6)分离纯化工艺:层析填料广泛应用于疫苗下游工艺中,以满足高性能,高通量及稳定的工业级分离纯化产品要求,涉及离心系统和过滤系统等仪器设备,同时包含层析介质和配套滤膜等耗材。
(7)质控检测:每批次疫苗药物生产完成后,均需要进行相关的质量控制,主要涉及疫苗活性等指标的检测,该过程主要涉及质谱仪、色谱仪、PCR仪、凝胶蛋白电泳仪、酶标仪等大型分析仪器的使用,同时在检测过程中需要使用配套的试剂和耗材。(报告来源:未来智库)
4.2. 新型疫苗上游产业链
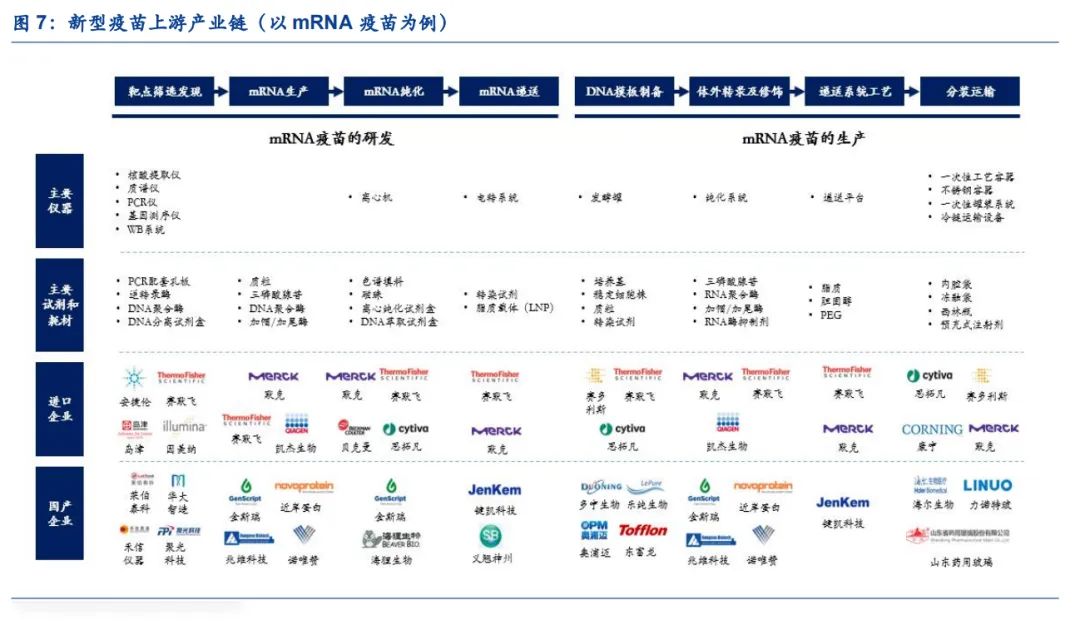
新型疫苗是采用生物化学合成技术、人工变异技术、分子微生物学技术、基因工程技术等现代生物技术研发生产的疫苗,包含重组蛋白疫苗、病毒载体疫苗、核酸疫苗等。以mRNA疫苗为例,研发阶段需要经历靶点筛选发现、mRNA的生产、mRNA的纯化、mRNA的递送阶段,生产阶段经历DNA模板制备、体外转录及修饰、递送系统工艺、分装运输等环节,涉及大量仪器设备、试剂及耗材的使用。
(1)靶点筛选发现:mRNA疫苗开发的起点,尤其是新靶点的发现需要更多的探索性工作,通过结合核酸提取、基因测序、质谱分析等手段,筛选出具有开发潜力的创新靶点。该过程主要涉及核酸提取仪、质谱仪、PCR仪、基因测序仪、WB系统等大型分析仪器的使用,同时在检测过程中需要使用配套的耗材和逆转录酶、DNA聚合酶、DNA分离试剂盒等试剂。
(2)mRNA生产:mRNA生产主要指体外转录过程,质粒DNA在体外通过RNA聚合酶转录得到mRNA,该过程主要涉及质粒、三磷酸腺苷、DNA聚合酶、加帽/加尾酶等一系列生物试剂。
(3)mRNA纯化:mRNA纯化主要指去除酶、剩余的核苷酸、质粒DNA和有缺陷的mRNA等物质。纯化过程主要涉及离心机等仪器,色谱填料和磁珠等耗材和离心纯化试剂盒、DNA萃取试剂盒等试剂。
(4)mRNA递送:目前常用的递送技术有电穿孔、阳离子聚合物脂质体等,主要涉及电转系统等仪器和转染试剂、脂质载体(LNP)等试剂。
(5)DNA模板制备:DNA模板的制备主要通过携带目标核酸序列的质粒转染大肠杆菌的方式进行扩增生产,涉及到的仪器设备有发酵罐,试剂有培养基、稳定细胞株、质粒、转染试剂等。
(6)体外转录及修饰:首先将质粒线性化处理得到正常的DNA模板,再通过酶催化的方式完成体外转录和体外修饰(加帽和加尾),主要涉及三磷酸腺苷、RNA聚合酶、加帽/加尾酶、RNA酶抑制剂等试剂。
(7)递送系统工艺:目前mRNA主要的递送载体为脂质纳米颗粒(LNP),该领域存在比较明显的专利保护,主要涉及脂质、胆固醇、PEG等原材料。
05
体外诊断:重点关注关键原料,
新冠刺激进口替代
体外诊断是指通过对血液、体液、组织等样本进行体外检测的诊断方式,根据反应原理,可以分为生化诊断、免疫诊断、分子诊断。根据医疗器械蓝皮书,中国体外诊断市场规模从2015年的362亿元增长至2019年的713亿元,年复合增长率达到18.5%。体外诊断的上游原料 包括核心反应体系、信号体系、反应环境、反应载体,其中核心反应体系决定检测的灵敏度和特异性,信号体系影响检测结果的可视程度,反应环境和反应载体可以保障反应顺利进行。根据菲鹏生物招股说明书,体外诊断整个上游的市场规模约占诊断试剂和仪器出厂口径的25%左右,约占整个终端市场的10%左右。
(1)核心反应体系:生化诊断的反应体系主要包括化学试剂、抗原、抗体、诊断酶等试剂;免疫诊断的反应体系主要包括抗原、抗体、标记酶等试剂;分子诊断的反应体系主要包括引物、dNTP、分子诊断酶、DNA建库相关酶等试剂。
(2)信号体系:生化诊断的信号体系主要是反应本身产生的有色物质;免疫诊断的信号体系包括酶底物系统、化学发光剂、胶体金、量子点等发光物质;分子诊断的信号体系包括荧光探针、荧光染料、荧光标记dNTP等。
(3)反应环境:生化诊断的反应环境主要是抗原抗体、酶所需生物缓冲溶液;免疫诊断的反应环境包括抗原抗体、酶所需生物缓冲溶液或者牛血清蛋白稀释液等;分子诊断的反应环境包括PCR缓冲液、杂交缓冲液、文库稀释缓冲液等。
(4)反应载体:生化诊断的反应载体包括普通溶液和胶乳微球;免疫诊断的反应载体包括酶标板、磁性微球、NC膜、荧光微球、量子点荧光微球等;分子诊断的反应载体包括核酸提取微球、基因芯片载体、测序磁性微球等。






