撰文:步步先生
免疫细胞治疗,是指将体外活化和扩增的自体或异体免疫效应细胞输注患者体内,以识别病原体或肿瘤细胞并进行选择性杀伤,打破免疫耐受,激活和增强机体的免疫能力。
-01-
CAR-T疗法发展简史
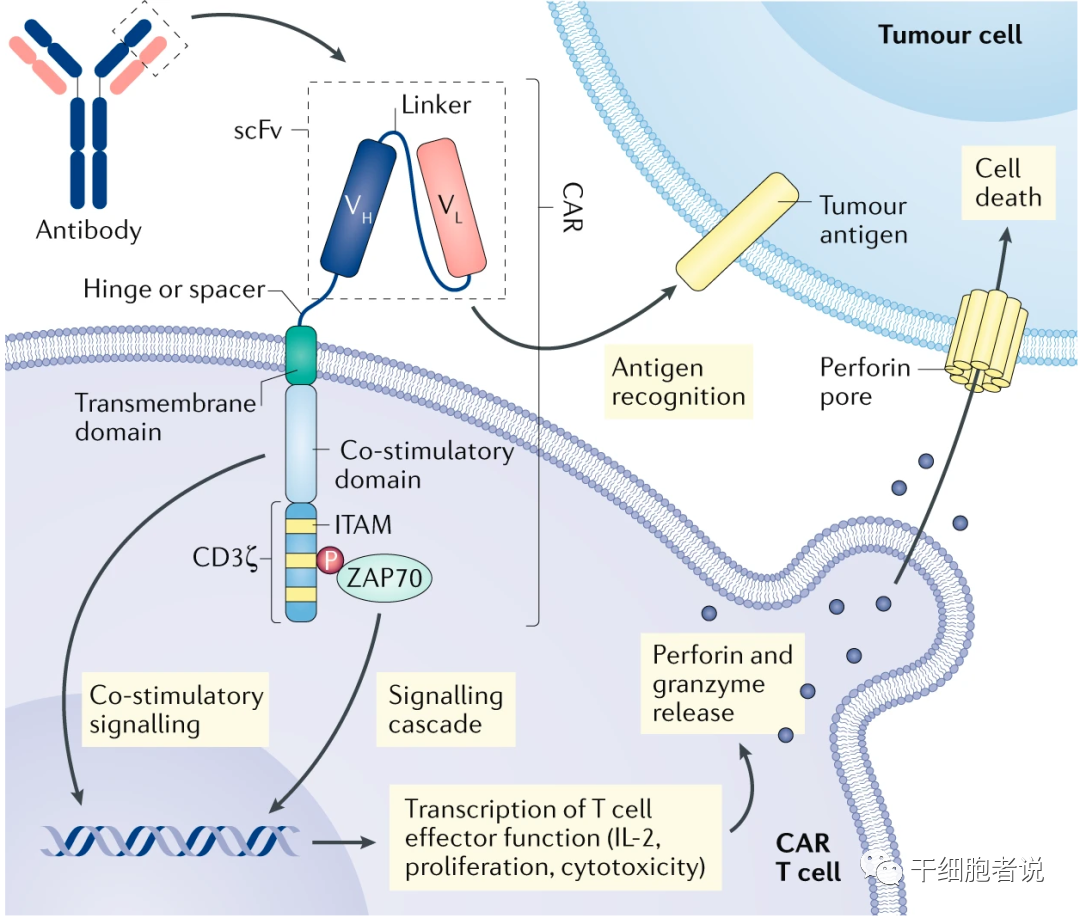
CAR主要由胞外结构域、跨膜结构域和胞内结构域这三个功能域构成。胞外结构域主要包括抗原识别结构域(scFv)和铰链区 (Hinge),其中scFv是CAR特异性结合肿瘤抗原的基础,由单克隆抗体的轻链(VL)和重链(VH)通过多肽连接而成。目前临床上主要针对靶向肿瘤相关抗原(TAA, 如CD19、CD20、CD22、CD30、CD33、BCMA等靶点) 来开发抗体。铰链区连接scFv和跨膜结构域,铰链区的长度取决于靶细胞抗原表位的位置及暴露程度。
跨膜结构域将CAR的胞外结构域与胞内信号转导结构域连接,常用的跨膜结构域来源于CD4,CD8α,CD28和CD3ζ。胞内结构域由共刺激域和信号转导结构域构成,共刺激域通常来自CD28受体家族(CD28、ICOS)或肿瘤坏死因子受体家族 (4-1BB、OX40、CD27),可协同共刺激分子和细胞内信号的双重活化,使T细胞持续增殖并释放细胞因子,提高T细胞的抗肿瘤能力。信号转导结构域通常为T细胞受体TCR/CD3ζ链或免疫球蛋白Fc受体FcεRIγ链,含有免疫受体酪氨酸活化基序 (ITAMs),发挥T细胞信号转导功能。
1986年,Steven A. Rosenberg 第一次在一位晚期的黑色素瘤患者手术切下来的肿瘤组织里发现小部分肿瘤浸润性淋巴细胞(TILs),都说T细胞是人体抵抗肿瘤的主要武器,那么,能不能利用一下这些T细胞呢?
于是,Rosenberg 将分离出来的T细胞进行体外扩增,极大的增加其数量,然后再回输到患者体内,并在回输完成后分次给患者注射大剂量IL-2来增强效应性T细胞的杀伤力,结果发现,这种治疗方法的有效率达到了40%。后来,这种疗法被称为过继性细胞免疫疗法,并基于此发展了后来的LAK细胞疗法。
1. 第一代CAR-T
但是,恶性黑色素瘤恰好是一种免疫原性很高的肿瘤,所以被动输入TILs获得了一定的疗效,可如果是免疫原性很差的肿瘤,T细胞根本就识别不出肿瘤细胞因而不能做出免疫应答,该如何解决?以色列科学家Zelig Eshhar想到,与其被动等待APC找到肿瘤抗原,为什么不主动给T细胞装上一个能够识别肿瘤细胞特异性抗原的受体呢?基因工程技术的发展使得这种想法具有了可操作性。为了克服MHC限制性,Eshhar首先找到一个合适的TAA,然后给T细胞装上对应的scFv,他将这种经过基因修饰的T细胞叫做T-bodies,这就是CAR-T的雏形。然而,因为缺乏共刺激信号,T细胞往往会未老先衰,所以第一代CAR-T的试验基本上是失败的。
CAR-T的开创者:Zelig Eshhar及第一代CAR-T设计
2. 第二代CAR-T
在第一代CAR-T的基础上,宾夕法尼亚大学的 Carl H. June 团队最终在CAR-T的治疗和应用上拔得头筹。他们设计了以CD19为靶点,4-1BB做共刺激结构域的第二代CAR-T。
2012年,6岁女孩Emily Whitehead在经历过急性淋巴性白血病两次复发后,加入了诺华CTL019疗法的 I 期临床试验。由此,Emily成为了第一个CAR-T疗法治愈的儿童白血病患儿,她的例子也让CAR-T疗法瞬间受到了极大的关注。衍生的CTL-019疗法获得FDA批准后成为全世界第一个上市的CAR-T产品。
首款CAR-T疗法的发明者:Carl H. June及第二代CAR-T设计
3. 第三代CAR-T
第三代CAR-T细胞,使用了慢病毒作为转染载体,可携带更大的基因片段进入T细胞。因此,CAR的胞内段往往可以包含两个共刺激域(CD28+4-1BB)。一些临床前研究表明,与第二代CAR-T细胞相比,第三代CAR-T细胞的疗效有时更好,有些研究则没有发现差异,甚至疗效比第二代更差。因此,单纯在数量上添加共刺激分子区,并不一定能提升CAR对T细胞的活化效果,给CAR-T细胞疗法带来更好的疗效。因此,第二代CAR-T仍然处于当前主流地位。
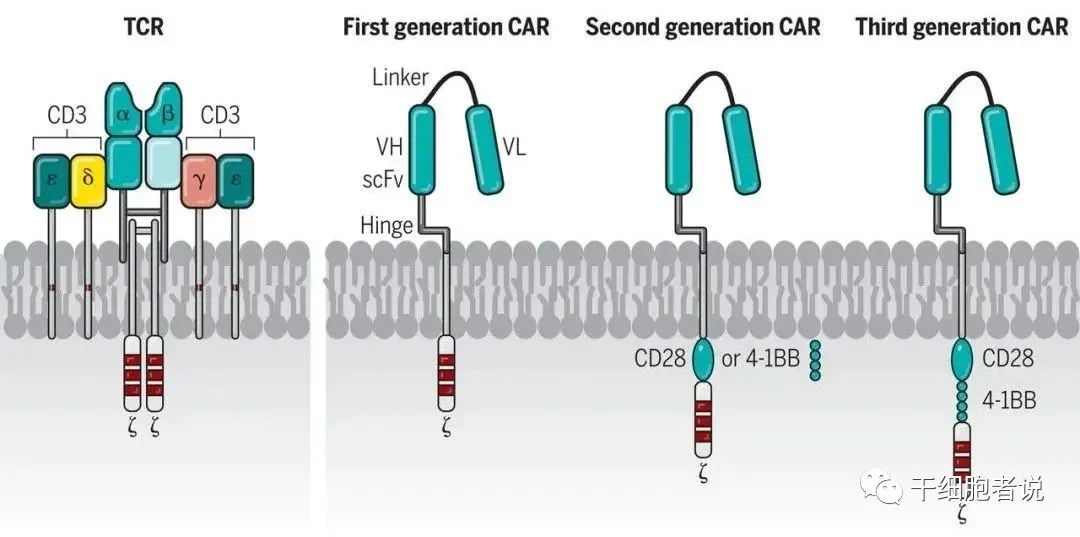
结构设计:TCR-T VS CAR -T
4. 第四代CAR-T
第四代CAR-T,也称为精准CAR-T细胞。截止到第三代CAR-T,已经知道CAR-T细胞可在患者体内存活长达10年以上,持久的生存期有利于CAR-T细胞长期监视并清除肿瘤细胞。但另一方面,CAR-T细胞也会因攻击体内正常细胞而产生巨大的毒性不良反应。有学者在第四代CAR-T的结构中添加了自杀基因或者可控性的自杀基因(例如某些药物敏感基因),从而实现对CAR-T细胞在体内存活时限进行控制。
近期,也有学者提出其他的设计思路,比如为CAR-T细胞设计一个安全开关,美国德州农工大学的研究人员设计发明了LiCAR-T (light switchable CAR-T) 细胞,在CAR的胞内部分插入一个光开关蛋白LOV2 (light-oxygen-voltage domain 2),它只有在特定蓝光激发下才能发挥功能,而在黑暗中回到“休眠”状态。
Kole T Roybal提出利用双靶点构造“与”门的疗法,被改造的T细胞只有同时识别两种抗原A和B时才能发挥杀伤作用,同样也可让T细胞只杀伤表达A但不表达B的细胞,也就是“非”门。这种CAR逻辑门可以提高CAR-T的精度,减少毒性伤害。
此外,还有学者在第四代CAR-T的设计中添加细胞因子或趋化因子受体结构,从而增加T细胞在肿瘤组织中的浸润,达到增强杀伤实体瘤的效果。
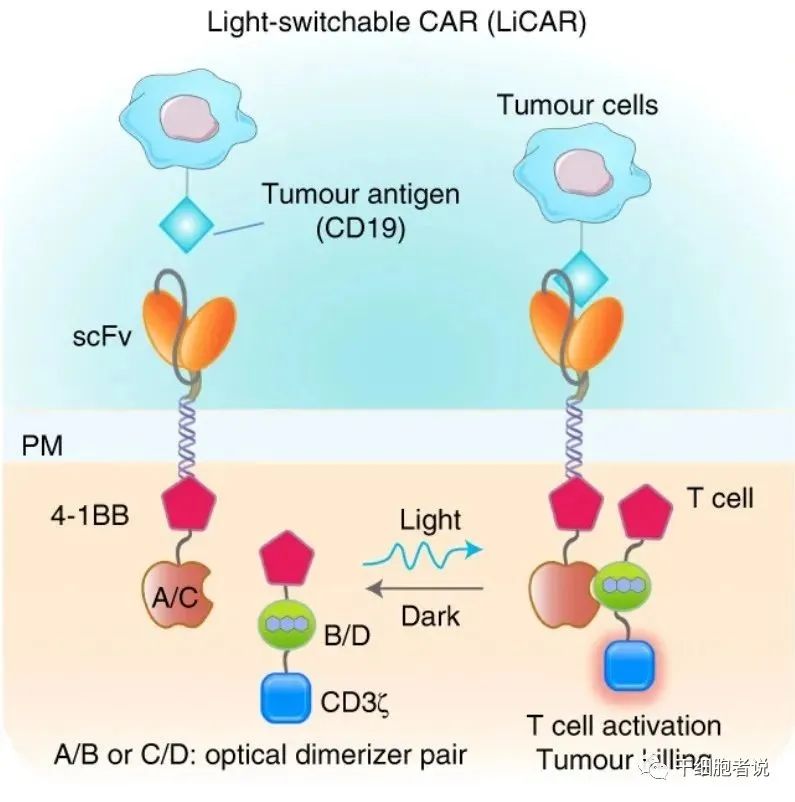
Design of light-switchable CAR (LiCAR) T cells
5. 第五代CAR-T
通常情况下,CAR-T疗法由患者自体T细胞在体外工程化然后回输,是极具个性化的疗法,一种疗法只针对一位患者,治疗成本极高。于是在研发第五代CAR-T技术时,学者们将目光聚焦在突破个体限制,实现规模化生产和治疗,以及降低成本上。通用型CAR使用BBIR CAR (生物素结合免疫受体) 或SUPRA CAR (split、universal、programmable) 这两种“第三方”系统,拆分胞外抗原靶向结构域和T细胞信号单位,以赋予CAR-T细胞识别多种抗原的能力。同时,从同种异体健康受体获取的T细胞,可在体外通过基因编辑技术 (ZFN、TALEN和CRISPR/Cas9) 破坏T细胞的TCR基因和HLAⅠ类基因,消除移植物抗宿主病 (GVHD)。不过,目前这类通用型CAR-T也有较高的技术壁垒,对安全性的要求更高。目前国内通用型CAR-T的研究尚在萌芽期。
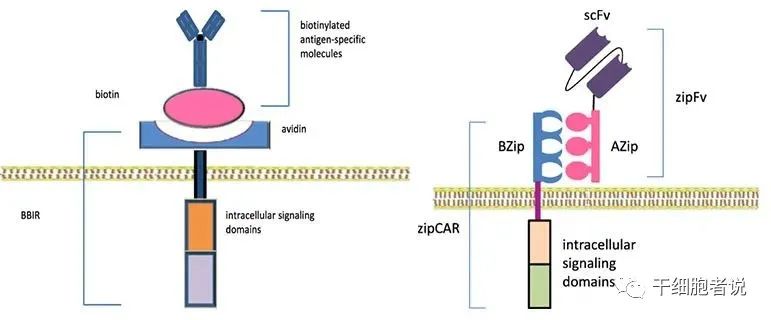
The structure of BBIR CAR and SUPRA CAR






