摘要
BHK-21细胞是世界卫生组织推荐的生产兽用疫苗的细胞,广泛应用于多种病毒的增殖,该细胞的悬浮培养已有半个多世纪的历史,如今已成为生产口蹄疫疫苗最普遍的手段。但目前所广泛采用的生产工艺远未能满足市场的需求,优化生产工艺,提高生产效率是目前口蹄疫疫苗反应器规模生产的研究热点。细胞悬浮驯化、个性化培养基开发以及反应器疫苗生产和纯化工艺是其中的关键环节,本研究针对上述的关键技术开展了相关实验,为建立高效的生产工艺奠定了基础。
前言
口蹄疫(Foot and mouth disease,FMD)是由口蹄疫病毒感染引起的一种急性、热性和高度接触性传染病,主要为偶蹄动物易感。它流行广、传播快、发病率高,可通过多种途径快速远距离传播,危害极大。BHK-21细胞即幼仓鼠肾细胞(Baby Hamster Kidney cell),已被广泛应用于多种病毒的增殖及兽用疫苗的生产。该细胞易于驯化成悬浮培养,方便进行大规模扩增,提高产量。同时,该细胞也是口蹄疫病毒的理想宿主,能够维持病毒的稳定扩增。口蹄疫作为A类动物传染病,一旦爆发疫情,将对国民经济造成巨大影响,接种疫苗是预防该病最有效的方法。随着BHK-21细胞悬浮生产工艺的应用,国内口蹄疫疫苗的生产取得了巨大的进步。然而,当前我国的防控形势仍然严峻,现有的生产水平仍存在诸如需要添加血清,工艺流程繁琐,病毒产量及收率较低等一系列问题,远远不能满足市场的需求。不断优化生产工艺,提高生产效率,仍是相关疫苗生产企业的迫切诉求,高效的口蹄疫生产工艺研究具有巨大的经济价值和广阔的市场前景。
实验设计
首先,利用本公司自主开发的无血清培养基B301,悬浮驯化了一株对口蹄疫病毒敏感的BHK-21细胞。其次,采用单一变量对照的方法,以病毒146S为判定指标,对O型MYA98株进行了接毒方式、收毒时间以及接毒比例等条件优化,初步建立了病毒生产工艺。最后,对病毒收获提纯工艺进行优化,自主开发筛选纯化助剂,提升病毒回收率。
结果
BHK-21细胞无血清悬浮驯化结果
将贴壁培养的BHK-21细胞,胰酶消化后用含2%血清的B301培养基重悬,以1×106 cells/mL的密度接种于摇瓶,每隔48h传代,待细胞生长稳定后逐步降低血清含量,直至无血清培养。结果如图1A所示,细胞连续传代生长稳定。将驯化完全的细胞以1×106 cells/mL的密度分别接种于摇瓶和10L反应器进行批培养,细胞最大密度可达8×106 cells/mL以上,反应器中密度略高于摇瓶(图1B)。

不同接毒方式对比结果
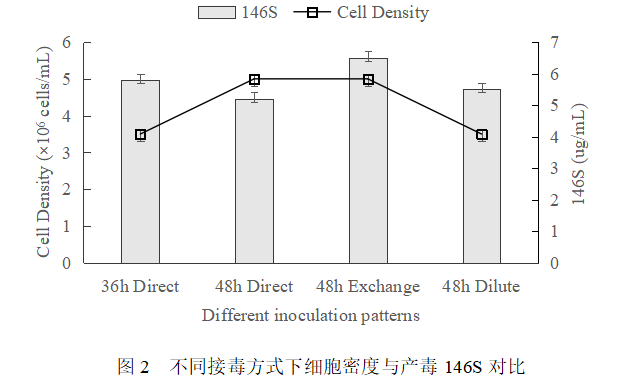
分别在细胞接种后36h和48h直接接种病毒,同时在细胞接种后48h进行换液和稀释后接种病毒,对比产毒146S情况如图2所示。综合考量了培养基营养供给、细胞生长状态及代谢副产物对产毒的影响,结果显示48h换液接毒产毒最高,但相比36h直接接毒提升有限,考虑到大规模生产中换液操作过程繁琐,耗时耗能,故采用36h直接接毒的方式,节省成本。
接毒比例及收毒时间优化结果
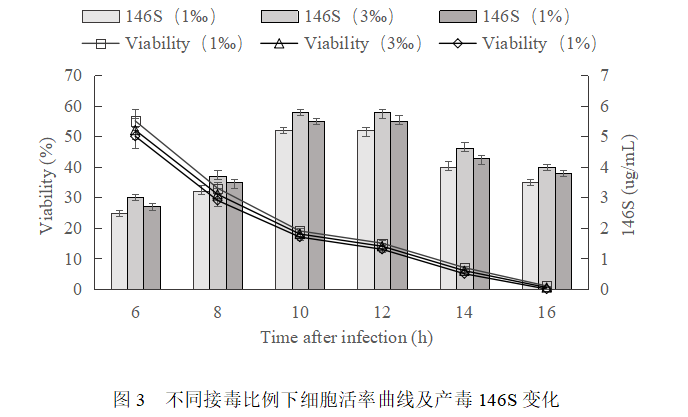
细胞生长36h至密度3.5×106 cells/mL,分别按照1‰、3‰和1%的比例接种病毒,接毒后细胞活率及产毒146S变化规律基本一致(图3),均在接毒后10h-12h,细胞80%-90%病变死亡时产毒146S最高,其中3‰的接毒比例最佳,146S可达6 ug/mL。
纯化助剂筛选优化结果
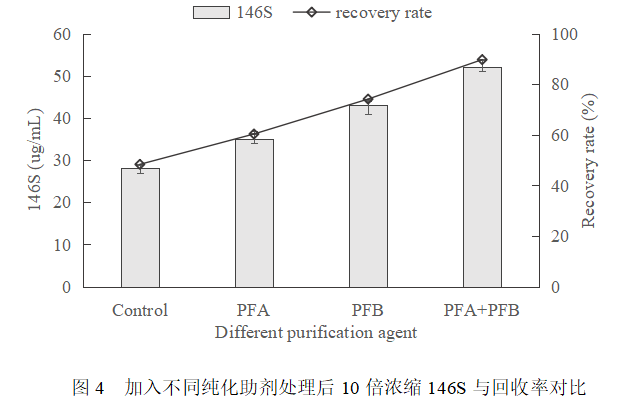
分别在收获病毒液中加入纯化助剂PFA、PFB以及两者组合,并设置不添加纯化助剂的空白对照,作用后经离心、深层过滤和中空纤维柱10倍浓缩,检测回收146S并计算回收率,结果如图4所示。添加PFA和PFB的组合回收率最高,可达90%以上,相比于空白对照提升近一倍。
总结
悬浮培养BHK-21细胞生产口蹄疫病毒疫苗是目前国内外口蹄疫生产厂家采用的主流技术,然而国内多数企业使用的是低血清培养细胞,待细胞生长至合适密度时部分换液成无血清培养基并接毒的生产方式,该工艺操作繁琐,产量偏低,而且造成了培养基和能耗等不必要的浪费,无形中增加了生产成本。优化改进现有的生产工艺,提高产量并降低成本,是生产厂家迫切的需求。
细胞的悬浮驯化和无血清培养一直是动物疫苗生产中的难点,需要长期的技术积累。得益于本公司完备的细胞驯化和培养基开发平台,以及前期实践的积累,本研究成功的将一株对口蹄疫病毒敏感的BHK-21细胞驯化为无血清悬浮培养。细胞实现每培养48h稳定1:5传代,可满足扩大生产的需求。
产毒工艺决定了细胞株和培养基能否发挥出其最大的潜能,一套高效的产毒工艺往往能取得事半功倍的效果。本研究以病毒146S作为判定指标,优化了该株BHK-21细胞的产毒工艺。由于该株BHK-21细胞的特性和无血清培养的优势,细胞在生长过程中的能量利用效率较高,且代谢副产物较少,接毒时无需进行换液或补料,直接接种病毒即可,大大地简化了生产流程,提高生产效率。优化后最佳接毒方式为细胞接种后36h直接接毒,细胞密度在3.5×106 cells/mL左右,接毒比例为3‰,收毒时间为接毒后10-12h。
病毒的收获和纯化也是口蹄疫疫苗生产中的关键环节。由于病毒收获液中含有大量的细胞碎片、核酸以及杂蛋白等,如果不经纯化除杂而直接制备成疫苗,注射到动物体内容易引起一系列的不良反应。而口蹄疫病毒的不稳定性使其在过程中易裂解失活,也增加了收获和纯化的难度。本研究筛选出两种纯化试剂并进行组合应用,大幅减少了病毒在离心、过滤和浓缩过程中的损失,将回收率提升近一倍,节约了生产成本同时提升了生产效率。






